渴肾方对糖尿病肾病大鼠肾小管间质损伤的影响
冯晓轩,王琛
上海中医药大学附属曙光医院,上海中医药大学中医肾病研究所,上海市中医临床重点实验室,肝肾疾病病证教育部重点实验室,上海 201203
糖尿病肾病(diabetic nephropathy,DN)是糖代谢异常引起的肾小球硬化症,属微血管病变,是终末期肾病的主要原因之一[1]。DN 全球发病率逐年升高,患病人数超过3.5亿[2],但目前发病机制仍不明确,且尚无有效治疗手段。DN主要与肾血流动力学改变、氧化应激、炎症、缺氧和肾素-血管紧张素-醛固酮系统(RAAS)过度激活有关[3]。对于DN肾损伤的研究主要集中于肾小球,但近年研究表明,DN早期肾损伤与肾小管关系密切,不仅可反映DN炎症和纤维化程度、氧化应激和重吸收能力,还与肾功能水平下降及DN病程进展密切相关[4]。DN肾小管结构改变主要包括肾小管基底膜增厚、肾小管萎缩、间质性炎症、间质纤维化和血管异常[5]。有研究显示,DN早期肾小球处于超滤状态,因此限制近端小管的重吸收是改善肾小球高滤过、延缓DN 病情的方法之一[6],对DN 早期治疗及预后有重要意义。
中医药在缓解DN症状方面优于部分常规疗法,且不良反应少[7]。根据中医辨证,早期DN多属气阴两虚兼络脉瘀阻证。渴肾方为王琛教授根据多年临证经验,结合DN患者多见水瘀互结致水肿的临床表现,在消白方[8]基础上加减化裁,加入桂枝、茯苓健脾利水化湿,又以赤芍、水蛭及少量大黄活血化瘀,收效良好。本实验采用高糖高脂饲料喂养联合腹腔注射链脲佐菌素(STZ)制备DN 大鼠模型,观察渴肾方对模型大鼠肾小管间质损伤的影响,初步探讨其作用机制,为该方临床治疗DN提供实验依据。
1 实验材料
1.1 动物
6周龄SPF级健康雄性SD大鼠50只,体质量160~180 g,购于上海斯莱克实验动物中心,动物许可证号SCXK(沪)2017-0005,饲养于上海中医药大学实验动物中心,温度(23±3)℃,湿度55%±15%,12 h昼夜循环照明,自由摄食饮水。本研究经上海中医药大学伦理委员会审批(PZSHUTCM210806002)。
1.2 药物及制备
渴肾方由黄芪30 g、桂枝9 g、薏苡根30 g、鬼箭羽30 g、泽兰15 g、茯苓15 g、赤芍15 g、水蛭9 g、蚕茧壳9 g、制大黄6 g组成,由上海中医药大学附属曙光医院制剂科制成水煎液,每毫升水煎液含原药材9 g。恩格列净片,德国勃林格殷格翰有限公司,10 mg/片,批号E27235,用蒸馏水制成0.86 mg/mL混悬液。
1.3 主要仪器与试剂
Nikon80i荧光显微镜+数码成像系统,日本Nikon公司;卓越金采血糖仪,瑞士Roche公司;Certrifuge离心机,德国Eppendorf公司;Mini-PROTEAN Tetra电泳及转膜仪,美国Bio-Rad公司;Tanon2500凝胶成像系统,上海天能。STZ,德国Sigma,货号s0130;α-平滑肌肌动蛋白(α-SMA)抗体,武汉博士德,货号BM0002;CD68抗体,美国Santa Cruz公司,货号sc-70761;纤维连接蛋白(FN)抗体,英国Abcam公司,货号ab45688;β-actin 抗体,美国Proteintech 公司,货号66009-1-Ig;白细胞介素(IL)-6抗体,武汉爱博泰克公司,货号A11115;Masson三色染色液,珠海贝索生物,货号BA4079A;PAS染色液,珠海贝索生物,货号BA4080A;ECL 化学发光试剂盒,美国Thermo Scientific公司,货号34095。
2 实验方法
2.1 造模
大鼠适应性饲养1周后,按体质量随机分为正常组10只和造模组40只,造模组予高糖高脂饲料(猪油18%、蔗糖20%、蛋黄3%、基础饲料59%)喂养8周,正常组予基础饲料喂养。8周后造模组禁食12 h,腹腔注射1%STZ 溶液30 mg/kg[9](临用前以0.1 mol/L、pH 4.4枸橼酸缓冲液溶解),72 h后检测大鼠随机血糖,以随机血糖≥16.7 mmol/L、尿糖阳性并稳定5 d,2周后检测尿蛋白定性阳性,即为造模成功[10]。
2.2 分组及给药
剔除死亡及未成模大鼠10只,将造模成功的30只大鼠随机分为模型组、渴肾方组和恩格列净组,每组10只。以成人标准体质量(60 kg)的10倍计算大鼠每日给药剂量,恩格列净组为1.72 mg/只,渴肾方组为18 g/只,正常组和模型组予生理盐水2 mL/只,连续8周。给药期间除正常组外,其余组继续予高糖高脂饲料喂养。
2.3 取材
给药第8周末,代谢笼留取大鼠24 h尿液。大鼠禁食12 h,尾静脉采血检测空腹血糖,以2%戊巴比妥钠腹腔注射(2 mL/kg)麻醉大鼠,腹主动脉取血,摘取左肾,一部分置于4%多聚甲醛中固定24 h,经石蜡包埋后制成3 μm切片,用于肾组织病理观察及免疫组化染色,另一部分置于-80 ℃液氮中保存,用于Western blot检测。
2.4 大鼠血清及尿液生化指标检测
血液及尿液样本离心后取上清液,采用全自动生化分析仪检测大鼠血清胆固醇含量;采用免疫散射比浊法检测尿白蛋白,GOD法检测尿肌酐,计算尿白蛋白/肌酐比率(UACR)。以上检测均由上海中医药大学附属曙光医院检验科协助完成。
2.5 肾组织病理观察
2.5.1 PAS染色
肾组织切片脱蜡至水,于二甲苯Ⅰ、二甲苯Ⅱ中各浸泡20 min,无水乙醇Ⅰ、无水乙醇Ⅱ中各10 min,梯度乙醇(95%、90%、80%、70%)各5 min,蒸馏水洗,PBS洗3次,每次3 min,置于过碘酸乙醇溶液染色10 min,流水洗后去离子水洗3次,Schiff溶液染色15 min,流水冲洗,苏木素染核1 min,1%盐酸乙醇分化,自来水冲洗,中性树胶固定,显微镜下观察肾组织病理形态。
2.5.2 Masson染色
肾组织切片脱蜡至水,于二甲苯Ⅰ、二甲苯Ⅱ中各浸泡20 min,无水乙醇Ⅰ、无水乙醇Ⅱ中各10 min,梯度乙醇(95%、90%、80%、70%)各5 min,蒸馏水洗,苏木素染核1 min,1%盐酸乙醇分化,自来水冲洗,丽春红溶液染色10 min,蒸馏水冲洗,1%磷钼酸处理5 min,1%苯胺蓝复染10 min,1%冰醋酸分化1 min,中性树胶封片,显微镜下观察肾组织胶原纤维沉积情况。
2.6 免疫组化染色
肾组织石蜡切片脱蜡复水后,EDTA 抗原修复20 min,PBS冲洗后滴加3%H2O2阻断内源性过氧化物酶,分别滴加α-SMA、CD68一抗(1∶500),37 ℃孵育60 min,PBS 冲洗后加二抗,室温孵育15 min,DAB显色,苏木素复染,二甲苯透明,中性树胶封片,显微镜下观察,计算阳性表达的平均光密度(MOD)。
2.7 Western blot检测
肾组织用含蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液裂解,4 ℃、13 000 r/min离心10 min,取上清液,BCA法测定蛋白浓度,制备蛋白样品。蛋白上样后120 V电泳60 min,湿转法100 V转膜2 h,5%脱脂奶粉封闭1 h,滴加FN 一抗(1∶3 000)、IL-6 一抗(1∶2 000)、β-actin一抗(1∶5 000),4 ℃摇床孵育过夜,滴加HRP标记IgG(1∶1 000),室温孵育1 h,PBST洗3次,ECL发光液显影,凝胶成像系统成像,以β-actin为内参,采用Image J软件计算目的蛋白相对灰度值。
3 统计学方法
采用SPSS28.0 统计软件进行分析。计量资料用-±s表示,多样本均数比较,符合正态分布及方差齐性用方差分析,组间比较用LSD法。P<0.05表示差异有统计学意义。
4 结果
4.1 渴肾方对模型大鼠空腹血糖、血清胆固醇、尿白蛋白/肌酐比率的影响
与正常组比较,模型组大鼠空腹血糖、血清胆固醇、UACR明显升高(P<0.01);与模型组比较,渴肾方组和恩格列净组大鼠空腹血糖、血清胆固醇及UACR明显降低(P<0.05)。见表1。
表1 给药8周末各组大鼠空腹血糖、血清胆固醇、UACR比较(-±s)

表1 给药8周末各组大鼠空腹血糖、血清胆固醇、UACR比较(-±s)
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05
UACR/(mg/g)1.53±0.73 5.29±0.95**3.14±0.62#2.67±0.62#组别正常组模型组渴肾方组恩格列净组只数5 5 5 5空腹血糖/(mmol/L)5.46±0.51 21.20±2.23**15.92±6.16#11.65±2.58#血清胆固醇/(μmol/L)1.43±0.15 2.98±1.46**1.63±0.22#1.90±0.38#
4.2 渴肾方对模型大鼠肾组织病理形态的影响
PAS染色显示,正常组大鼠肾小球形态正常,无基底膜增厚及系膜基质增生,肾小管无水肿、空泡样变,肾间质无炎性细胞浸润和纤维组织增生;模型组大鼠可见系膜基质增生、基底膜增厚,肾小管上皮细胞空泡样变,肾间质有大量炎性细胞浸润;渴肾方组和恩格列净组大鼠系膜基质轻度增生,基底膜轻微增厚,肾小管轻度水肿,肾间质少量炎性细胞浸润,肾小管及间质损伤较模型组有一定程度减轻。见图1。

图1 各组大鼠肾组织形态(PAS染色, 标尺=100 μm)
Masson染色显示,正常组大鼠肾小球毛细血管结构清晰,肾小管结构完整,肾间质无纤维化改变;模型组大鼠肾小管基底膜增厚,部分上皮细胞空泡变性,肾间质大量胶原纤维沉积;与模型组比较,渴肾方组和恩格列净组大鼠肾小管基底膜增厚改善,肾间质胶原纤维沉积明显减少。见图2。

图2 各组大鼠肾组织形态(Masson染色, 标尺=100 μm)
4.3 渴肾方对模型大鼠肾组织α-平滑肌肌动蛋白、CD68表达的影响
α-SMA阳性表达呈棕黄或褐色颗粒,CD68阳性表达呈蓝紫色颗粒。正常组大鼠肾组织未见α-SMA和CD68阳性表达;与正常组比较,模型组大鼠肾组织α-SMA和CD68阳性表达明显升高(P<0.01);与模型组比较,渴肾方组和恩格列净组大鼠肾组织α-SMA和CD68阳性表达明显降低(P<0.05)。见图3、图4、表2。
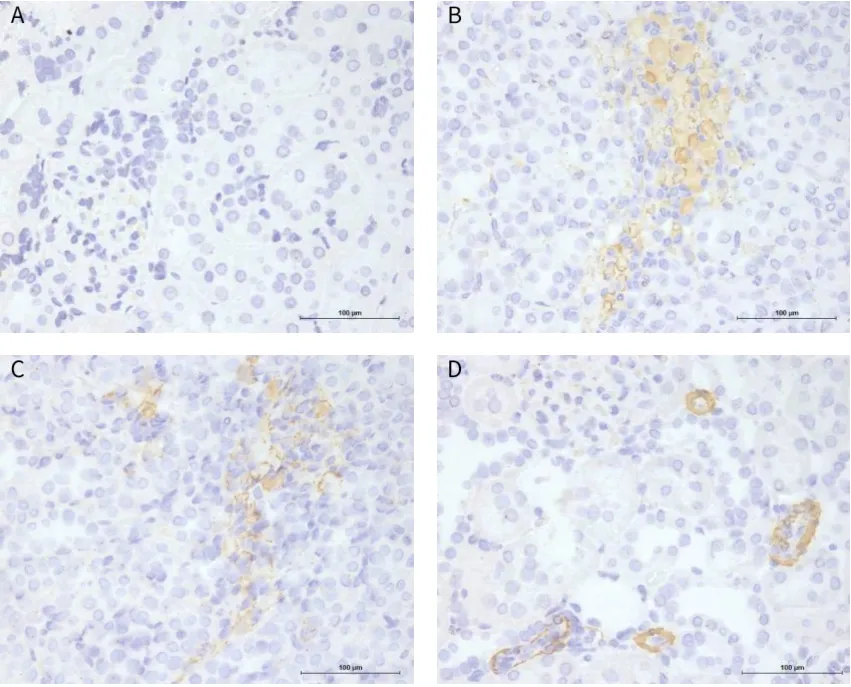
图3 各组大鼠肾组织α-SMA阳性表达(免疫组化染色, 标尺=100 μm)
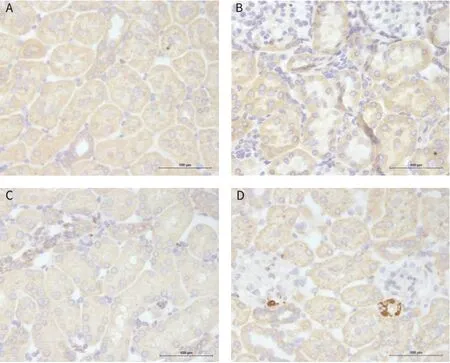
图4 各组大鼠肾组织CD68阳性表达(免疫组化染色, 标尺=100 μm)
表2 各组大鼠肾组织α-SMA、CD68表达比较(-±s,MOD)

表2 各组大鼠肾组织α-SMA、CD68表达比较(-±s,MOD)
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05
CD68 0.033±0.001 0.242±0.004**0.078±0.008#0.143±0.002#组别正常组模型组渴肾方组恩格列净组只数4 4 4 4 α-SMA 0.040±0.006 0.411±0.056**0.198±0.047#0.250±0.046#
4.4 渴肾方对模型大鼠肾组织纤维连接蛋白和白细胞介素-6蛋白表达的影响
与正常组比较,模型组大鼠肾组织FN、IL-6蛋白表达明显升高(P<0.01);与模型组比较,渴肾方组和恩格列净组大鼠肾组织FN、IL-6表达明显降低(P<0.05)。见表3、图5。
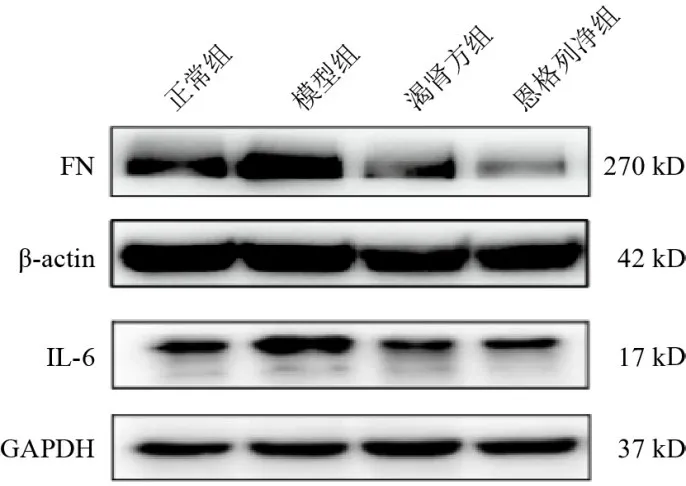
图5 各组大鼠肾组织FN、IL-6蛋白免疫印迹
表3 各组大鼠肾组织FN、IL-6蛋白表达比较(-±s)

表3 各组大鼠肾组织FN、IL-6蛋白表达比较(-±s)
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05
IL-6 0.55±0.15 0.94±0.05**0.61±0.16#0.49±0.20#组别正常组模型组渴肾方组恩格列净组只数4 4 4 4 FN 0.56±0.23 1.13±0.18**0.78±0.09#0.66±0.27#
5 讨论
DN 进展的最主要危险因素是高血糖、高血压[11],在高糖环境下,近端肾小管重吸收功能失衡可导致形态变化,致使炎症、纤维化发生,加速DN 进展[12]。DN患者高血压与胰岛素抵抗、胰岛素分泌缺乏导致的糖脂代谢紊乱及动脉粥样硬化相关。高血压可使管-球反馈机制出现障碍,导致肾小球滤过功能异常,出现蛋白尿。蛋白尿是DN进展的重要指标之一,因此,改善糖脂代谢水平对减少DN 患者尿蛋白排出,延缓DN进程有一定作用。
胰岛炎症引起的胰岛素抵抗是糖尿病发生的重要诱因[13]。CD68是一种高度糖基化的糖蛋白,在巨噬细胞和其他单核细胞中高度表达。研究表明,巨噬细胞极化是炎症反应的关键原因,参与胰岛炎症反应,直接影响DN的发展[14]。慢性肾损伤的普遍特征是由免疫介导的肾间质纤维化[15],肌成纤维细胞分化被认为是肾纤维化发展的重要表现之一[16]。α-SMA是活化的肌成纤维细胞标记蛋白[17],是肾组织纤维化标志物之一[18]。Gerrits等[19]研究表明,DN肾间质中肌成纤维细胞累积可加速肾间质纤维化形成。在一定条件下,巨噬细胞甚至可以转化为肌成纤维细胞,直接介导肾间质纤维化[20]。炎症可加重肾脏疾病进展[21],炎性细胞浸润和间质纤维化与多种炎症因子分泌有关[22]。IL-6是DN炎症反应进展的核心指标之一[23],在肾组织中广泛表达。一项临床观察显示,IL-6水平是DN进展的独立危险因素[24]。炎症因子可通过激活多种信号通路导致肾纤维化,肾纤维化是多种慢性肾病的最终表现[25]。FN是细胞外基质和基底膜中的主要非胶原性糖蛋白,由成纤维细胞、间充质细胞分泌合成的细胞纤连蛋白构成,与纤维化进程密切相关[26]。肾小管间质纤维化是DN的关键病理特征[27],因此,选取观察炎症及纤维化相关蛋白表达与病理相符,可更加客观评价渴肾方的疗效。本实验中,渴肾方组大鼠UACR较模型组明显改善,故对DN大鼠肾组织进行病理检测,以证实其有效性。PAS染色显示,与模型组相比,渴肾方组在改善肾间质炎性浸润等方面有明显作用;Masson染色显示,与模型组相比,渴肾方组在改善肾间质纤维化方面有一定效果,也从一定程度上表明,渴肾方可能是通过减轻炎症反应延缓肾纤维化进程。为进一步验证这一猜想,选取炎症与纤维化相关指标进行验证。免疫组化染色结果表明,渴肾方组大鼠肾组织CD68、α-SMA阳性表达明显低于模型组,Western blot结果表明,与模型组相比,渴肾方组大鼠肾组织IL-6、FN蛋白表达明显降低。表明渴肾方可能通过减轻肾组织炎症反应,抑制纤维化发生,延缓DN进展。
DN属中医学“消渴病”之“下消”或“消肾”等范畴。《太平圣惠方》有“夫消肾,小便白浊如脂者。此由劳伤于肾,肾气虚冷故也”,其症状与DN 临床表现相符。中医学认为,早期DN病机为本虚标实,以阴虚为本,燥热为标。渴肾方中以黄芪为君,取其益气健脾、利水消肿之效,臣以桂枝温通经脉、助阳化气,二药相合,意在调和营卫、益气化湿,使中焦之气得以运化,下焦之寒得以温煦;薏苡根清热通淋、健脾利湿,泽兰利水消肿、活血化瘀,茯苓利水渗湿、健脾宁心,赤芍清热凉血、散瘀止痛,鬼箭羽破血通经、解毒消肿,水蛭逐瘀消癥,制大黄活血通经、推陈致新,以上共为佐药,以加强健脾利湿、益气化瘀之功;蚕茧壳祛风胜湿、调和诸药为使。诸药相合,奏健脾益气、化湿通络之功。
综上所述,渴肾方能改善DN 大鼠肾小管间质损伤,其作用机制可能是通过抑制CD68、IL-6表达减轻炎症反应,抑制α-SMA、FN表达,抑制肾间质纤维化发展,从而延缓DN进程。

