基于高通量测序的明日叶不同组织内生菌群落结构分析
刘雯雯 张旭 黄奇 胡连清 陈露 周万海 魏琴 冯瑞章 赵鑫
DOI:10.3969/j.issn.2095-1191.2023.06.004
摘要:【目的】分析明日葉不同组织内生菌的群落结构和多样性,为探究明日叶和内生菌互作机制及功能菌株筛选提供参考。【方法】以四川宜宾栽培的药食兼用型明日叶为试材,采用Illumina MiSeq高通量测序技术确定根、茎、叶和果实组织内生真菌和内生细菌群落多样性。【结果】根据97%的序列相似性水平,将内生真菌和细菌的reads分别归类为1023和1871个操作分类单元(OTU)。韦恩图和热图显示明日叶各组织内生真菌和内生细菌群落结构差异性较高,种群丰度存在一定的差异。α多样性分析发现明日叶的叶内生真菌种类数最多,根内生真菌群落多样性最低,果实内生真菌群落丰富度最低;而根含有内生细菌种类数最多,茎内生细菌群落多样性最低,果实内生细菌群落丰富度最低。β多样性分析表明,组织特征对明日叶内生真菌或内生细菌群落结构有显著影响。明日叶4个不同组织中的优势真菌门和细菌门分别为子囊菌门(Ascomycota)和变形菌门(Proteobacteria)。根、茎、叶和果实中内生真菌优势属分别为Serendipita、Paramycosphaerella、多臂菌属(Trichomerium)和Apiotrichum,内生细菌优势属分别为罗尔斯通菌属(Ralstonia)、罗尔斯通菌属、甲基杆菌属(Methylobacterium)和弧菌属(Vibrio)。线性判别分析(LEfSe)表明,除根外,明日叶的茎、叶和果实中内生真菌重要差异指示种分别是Paramycosphaerella、苍白尾孢属(Pallidocercospora)和横断孢属(Strelitziana);茎、叶和果实中内生细菌重要差异指示种分别是罗尔斯通菌属、甲基杆菌属和亮杆菌属(Leucobacter)。经FUNGuild和COG功能预测发现,不同组织内生菌群功能丰富,除具有固氮、促生和抑菌等功能的菌群外,还存在较大比例未知功能菌群。【结论】明日叶中蕴含丰富多样的内生菌群,在不同组织中的群落结构、多样性、优势菌属及差异指示种存在保守性与差异性,组织特征差异是影响内生菌群的重要因素;不同组织内生菌群生态功能亦差异较大,且大量为未鉴定出种属和未定义的功能菌群。
关键词:明日叶;内生真菌;内生细菌;多样性;功能预测
中图分类号:S567.239 文献标志码:A 文章编号:2095-1191(2023)06-1622-11
Community structure analysis of the endophyte in different
tissues of Angelica keiskei (Miq.) Koidz. based on
high-throughput sequencing
LIU Wen-wen1,2, ZHANG Xu3, HUANG Qi2, HU Lian-qing2, CHEN Lu2,
ZHOU Wan-hai1,2*, WEI Qin1, FENG Rui-zhang1*, ZHAO Xin1
(1Sichuan Cinnamomum longepaniculatum Engineering Technology Research Center, Yibin University,Yibin,
Sichuan 644007, China; 2Faculty of Agriculture,Forestry and Food Engineering,Yibin University,Yibin,
Sichuan 644007,China; 3School of Life Science, Hainan University,Haikou, Hainan 570228,China)
Abstract:【Objective】The community structure and diversity of endophyte in different tissues of Angelica keiskei (Miq.)Koidz. was analyzed, to provide a theoretical basis to explore the interaction mechanism and functional strain screening of A. keiskei and endophyte. 【Method】The medicinal and edible plant A. keiskei, which was cultivated in Yibin, Sichuan, was taken as the object. The diversity of endophytic fungi and bacteria in the root, stem, leave and fruit tissues was examined by high-throughput sequencing using Illumina MiSeq. 【Result】According to the 97% sequence similarity, endophytic fungal and endophytic bacterial reads could be indentified into 1023 and 1871 operational taxonomic units(OTU), respectively. A Venn diagram and a heatmap showed that there were fairly high community structure difference between endophytic fungi or endophytic bacteria in the four different parts of tissues of A. keiskei, and the abundances of populations differed. According to α diversity analysis, the variety of endophytic fungi in the leaves of A. keiskei was the most, the diversity of endophytic fungal community in the roots was the lowest, and the abundance of endophytic fungal community in the fruits was the lowest. The variety of endophytic bacteria in the roots of A. keiskei was the most, the diversity of endophytic bacterial community in the stems was the lowest, and the abundance of endophytic bacterial community in the fruits was the lowest. β diversity analysis showed that the characteristics of tissues had a significant effect on the community structure of the endophytic fungi or endophytic bacteria in A. keiskei. Ascomycota and Proteobacteria were the dominant fungal phylum and bacterial phylum in the four different parts of tissues of A. keiskei respectively. The dominant genera of endophytic fungi in the roots, stems, leaves and fruits were Serendipita, Paramycosphaerella, Trichomerium and Apiotrichum respectively, and the dominant genera of endophytic bacteria were Ralstonia, Methylobacterium and Vibrio respectively. Linear discriminant analysis showed that, the most important biomarkers of the endophytic fungi in the stems, leaves and fruits were Paramycosphaerella, Pallidocercospora and Strelitziana respectively. The most important biomarkers of endophytic bacteria in stems, leaves and fruits were Ralstonia, Methylobacterium and Leucobacter respectively. FUNGuild and COG functional predictions showed that the function of endophyte in different tissues was abundant, and there was a large proportion of unknown functional endophyte in addition to those that could fix nitrogen, promote growth and inhibit bacteria. 【Conclusion】There are abundant and diverse endophytes in A. keiskei. The community structure, diversity, dominant genera and biomarkers in different tissues are conservative and different, and the difference of tissue characteristics is an important factor affecting the endophyte. The ecological functions of endophyte in different tissues are also quite different, and a large number of species and functional endophyte are not identified.
Key words: Angelica keiskei(Miq.) Koidz.; endophytic fungi; endophytic bacteria; diversity; function prediction
Foundation items:Sichuan National Natural Science Foundation (2022NSFSC0176);Application Project of Sichuan Science and Technology Department(2018JY0495);High-level Innovation and Entrepreneurship Team Project of Yibin Science and Technology Bureau(2021YGC03)
0 引言
【研究意義】明日叶[Angelica keiskei (Miq.) Koidz.]属伞形科当归属草本植物,是一种经济价值极高的药食两用植物(Gong et al.,2020)。药用植物的次生产物积累、药用品质和抗病等与组织内微生物有复杂的作用关系,内生菌能对宿主植物物质循环和能量转换过程中的信号识别、信号转导和基因表达等产生显著影响,从而促进植物对营养成分的吸收和代谢(蔡媛等,2021),部分内生菌还可代谢产生与宿主相同或相似作用的天然活性成分,此特征已成为挖掘新型药物的重要来源(郭文秀等,2022)。因此,开展特色药食两用植物明日叶不同组织的内生菌群落结构及多样性研究,有助于揭示明日叶不同组织内生菌群落结构特征,且对挖掘可提高其有效成分含量的内生菌资源及开发促进明日叶生长、生物转化和品质提升的方法具有重要意义。【前人研究进展】目前已对蛇足石衫、黄精和白蔹等多种药用植物内生菌群落结构、多样性和组织分布特征等开展了相关研究(Fan et al.,2020;李鉴滨等,2022),亦对内生菌响应宿主植物内环境因子及调节宿主植物生长、活性次生代谢物积累和分布进行了分析(黄雪珍和赵龙飞,2023),发现内生菌分布于植物器官或组织中,每个植物器官均代表内生细菌群落特有的生态位。Dong等(2018)对中草药三七不同部位的内生细菌进行多样性分析,得出根部的慢生型大豆根瘤菌、鞘氨醇单胞菌和苯基杆菌等内生细菌数量均高于茎部和叶部。许国琪等(2021)发现青藏高原冰川棘豆不同组织间形成了保守性内生细菌和特异性内生真菌共存的群落结构,为其不同组织适应极端环境提供帮助。陈美琪等(2023)发现对虎耳草不同组织内生真菌的多样性指数均高于多数已报道的其他药用植物,且根部内生真菌的多样性明显高于茎部和叶部。张丽芳等(2023)发现火棘根中内生细菌物种最丰富,参与各种代谢调控的细菌丰度最高。关于明日叶的研究主要集中在栽培技术、活性物质提取与鉴定及中药药性探析等方面。关于内生菌,本课题组前期采用纯培养法筛选明日叶不同器官可培养的内生真菌和产黄酮菌株,浅析了明日叶不同组织内生真菌群落结构和多样性,但分离的菌株数量和类型较少,多样性较低(刘雯雯等,2022)。大量研究表明传统的平板分离法并不能真正反映内生菌群落特征,高通量测序技术能提供更加可靠和深入的分析(陈美琪等,2023)。【本研究切入点】有关明日叶内生细菌的群落结构及组织差异尚缺乏系统的认识。【拟解决的关键问题】收集四川宜宾栽培的药食兼用型明日叶的根、茎、叶和果实组织,基于高通量测序技术分析明日叶不同组织中内生真菌和内生细菌群落组成和多样性,并比较内生真菌和内生细菌群落结构差异,探究明日叶中特有的微生物资源及其功能,为探寻功能微生物资源和明日叶的功能开发应用,挖掘能合成或促进植物活性产物的菌株资源提供理论依据和技术支撑。
1 材料与方法
1. 1 试验区概况
明日叶采样点位于四川省宜宾市宜宾学院试验农场(东经104°59′76″,北纬28°47′77″)。属中亚热带季风湿润气候,气候温和,热量丰足,雨量充沛,光照适宜,冬暖春早,无霜期为347 d,年平均温度17.5 ℃,年均降水量1070.4 mm。
1. 2 样品采集和处理
在采集地选择不同位点的5株3年生且长势良好的明日叶植株,将整棵植株挖出,尽量保持根系完整,立即放入内置冰袋的冰盒内运送至实验室,用大量无菌水对明日叶植株表面和根系附着泥土进行冲洗后,用无菌剪刀将不同位品按根、茎、叶和果实组织分开。将不同位点每株明日叶不同组织的混合样品作为一个生物学重复,共设3个重复。称取50 g的各组织样品于超净工作台中无菌水冲洗多次,再依次用75%乙醇(40 s)、3% NaClO(3 min)、75%乙醇(40 s)无菌化处理,最后无菌水洗涤3次,无菌滤纸吸干表面水分,置于-80 ℃超低温冰箱中保存,用于明日叶内生菌群落结构分析。
1. 3 明日叶微生物DNA提取与测序
明日叶不同组织样本的总基因组DNA使用FastDNA®SPIN Kit for Soil试剂盒进行提取,借助1%琼脂糖凝胶电泳和NanoDrop 2000超微量分光光度计分别测定DNA提取质量和DNA浓度、纯度。PCR使用引物ITS1F(5'-CTTGGTCATTTAGAGGA AGTAA-3')和ITS2R(5'-GCTGCGTTCTTCATCGAT GC-3')对内生真菌ITS1区进行扩增;使用引物799F(5'-AACMGGATTAGATACCCKG-3')和1193R(5'-AC GTCATCCCCACCTTCC-3')对内生细菌16S rDNA的V5~V7区进行扩增。利用凝胶回收试剂盒(Gel Extraction Kit)对扩增目标片段切胶回收,2%琼脂糖凝胶电泳和Quantus™荧光仪对产物检测并定量,使用NEXTflexTM DNA-Seq Kit建库。最后利用Illumina公司Miseq PE300平台进行测序。上述工作均委托上海美吉生物医药科技有限公司完成。
1. 4 测序数据处理
将测序获得的数据过滤去除引物和接头序列、非特异性扩增序列和嵌合体,得到有效序列用于进一步分析。按照97%相似水平进行操作分类单元(Operation taxonomic unit,OTU)聚类,利用R软件绘制韦恩图后展开OTU聚类分析。α多样性指数包括Shannon指数(反映内生菌群落多样性)和Chao1指数(反映内生菌群落丰富度)。通过对OTU数据分析,利用柱状图统计样本中内生真菌和内生细菌在门和属水平上群落结构的分类学组成,确定优势菌门和优势菌属。基于主要OTU丰度信息绘制热图,反映不同样本间物种分布的相似性和差异性。在ANOSIM组间差异检验下进行NMDS分析,用于判断分组是否有意义。根据分类学组成对样本进行线性判别分析(LEfSe),找出对样本划分产生显著性差异影响的群落或物种。使用FUNGuild和EggNOG数据库分别预测内生真菌和内生细菌的功能,统计内生真菌Trophic Mode(营养方式)和Guild(功能分组)丰度结果,比对内生细菌OTU的COG家族信息。
1. 5 统计分析
试验数据采用SPSS 22.0和Excel 2007进行统计分析。利用上海美吉生物医药科技有限公司的I-sanger云数据分析平台进行在线数据分析。
2 结果与分析
2. 1 明日叶植物内生菌OTU数量
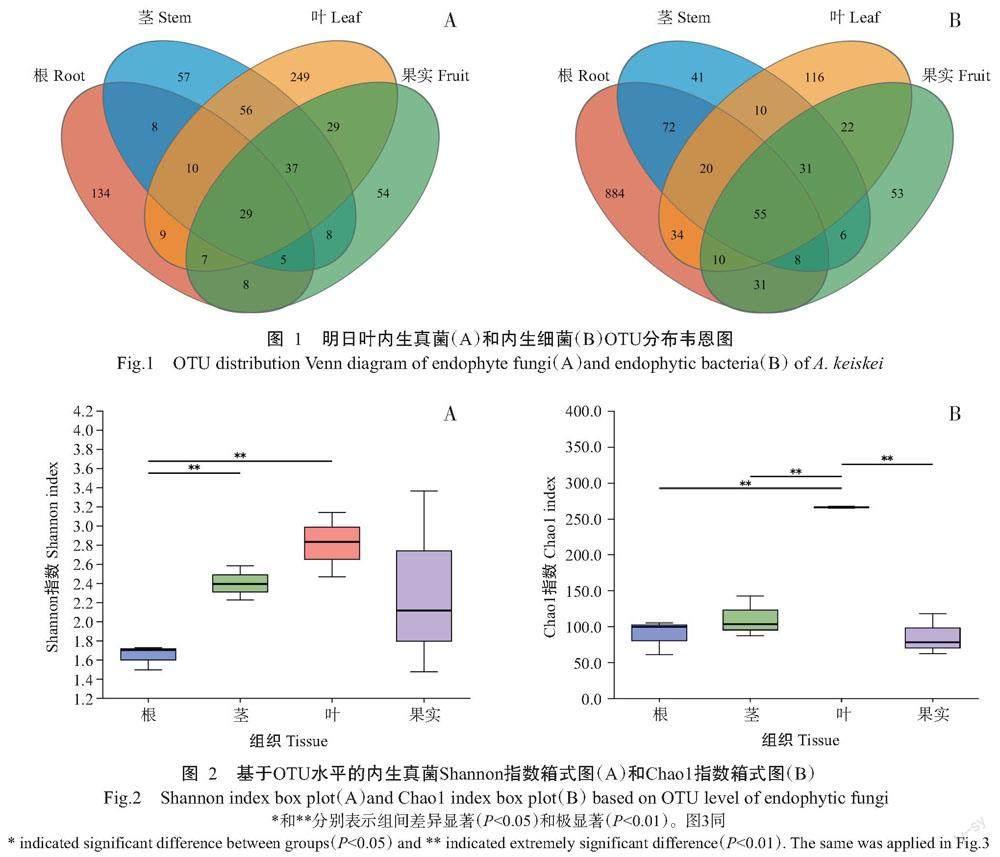
明日叶内生真菌OTUs总数为1023个,其中根、茎、叶和果实分别含有210、210、426和177个,4个组织共有内生真菌OTUs 29个;叶部特有OTUs数量最多,为249个,茎部次之,果实特有OTUs数量最少,仅54个(图1-A)。明日叶各组织内生细菌共获得1871个OTUs,其中根、茎、叶和果实分别含有1114、243、298和216个,4个组织共有内生细菌OTUs 55个;根特有OTUs数量最多,为884个,其次是叶116个,茎最少,仅41个(图1-B)。
2. 2 明日叶植物内生菌α和β多样性
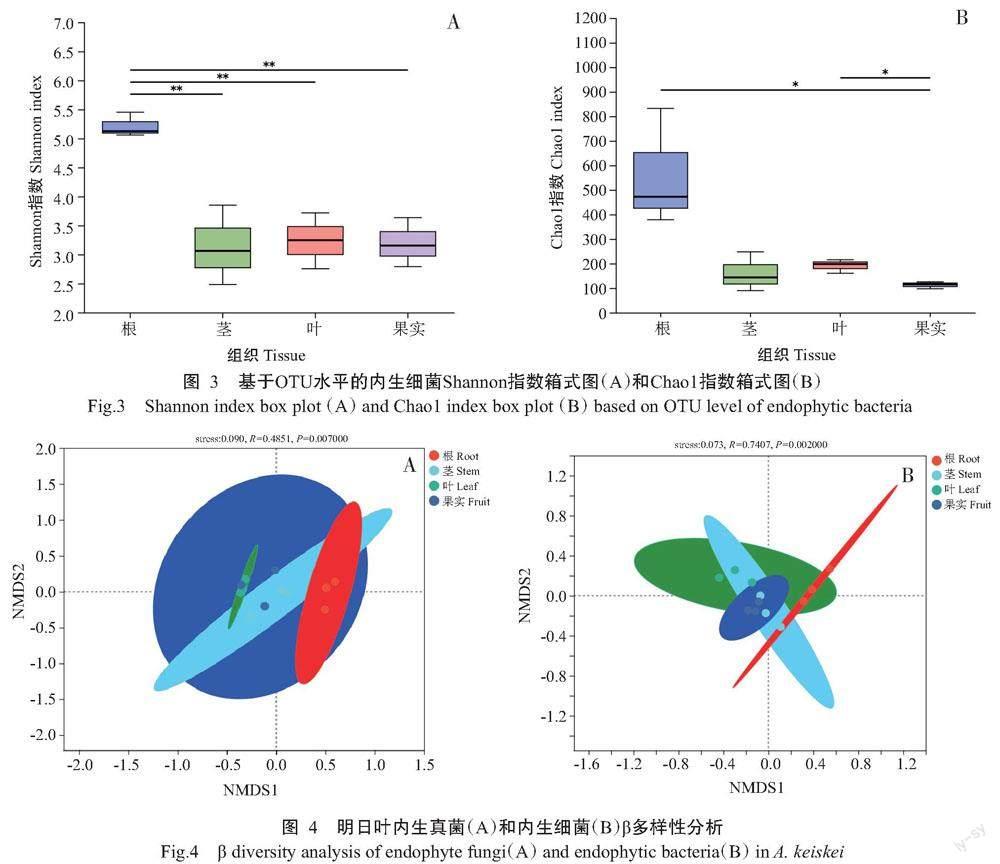
2. 2. 1 内生真菌α多样性 测序共获得247037条内生真菌有效序列,平均测序覆盖率达99.962%。由Shannon指数箱式图(图2-A)可知,明日叶的根与茎、根与叶差异极显著(P<0.01,下同),其他组织间无显著差异(P>0.05,下同),Shannon指数大小依次是叶>茎>果实>根;Chao1指数箱式图(图2-B)显示叶与其他3个组织间均差异极显著,Chao1指数大小依次为叶>茎>根>果实。说明叶部内生真菌群落多样性和丰富度均最好。
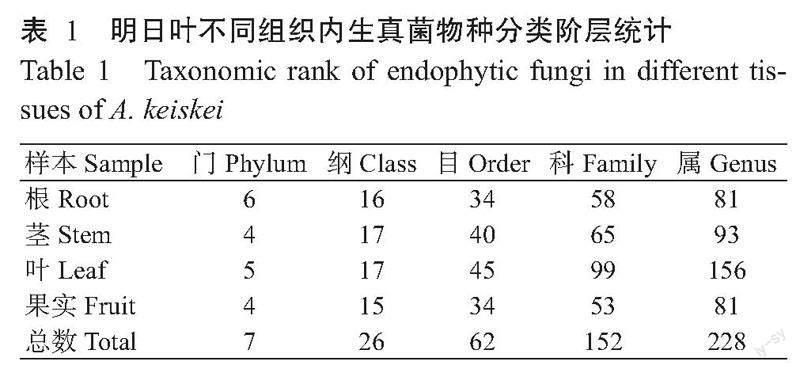
2. 2. 2 内生细菌α多样性 测序共获得87178条内生细菌有效序列,平均测序覆盖率为99.808%。结合Shannon指数和Chao1指数箱式图(图3)可知,明日叶根的Shannon指数与其他组织间均差异极显著,而其他组织间无显著性差异;果实的Chaol指数与根和叶间差异显著(P<0.05,下同)。因此,在Shannon指数上各组织排序依次是根>叶>果实>茎,Chao1指数大小依次为根>叶>茎>果实。说明根部内生细菌的群落多样性和丰富度均最好,叶部其次。
2. 2. 3 内生菌β多样性 基于ANOSIM组间差异检验的NMDS分析表明,组织间内生真菌OTU(R=0.4815,P=0.007)和内生细菌OTU(R=0.7407,P=0.002)均存在极显著差异(图4)。Stress主要用于检验NMDS分析结果的优劣,通常认为Stress<0.1时,不同样本具有一个好的排序,内生真菌NMDS分析Stress=0.090,内生细菌Stress=0.073,因此在内生真菌和内生细菌菌群结构的差异分析中,分组是一个好的排序。
2. 3 明日叶植物内生菌组成分析
在门、属分类水平上对明日叶不同组织内生菌进行群落组成和相对丰度分析,由于许多物种占比小,未有代表意义,因此将相对丰度<1%的物种归于其他类(others)。
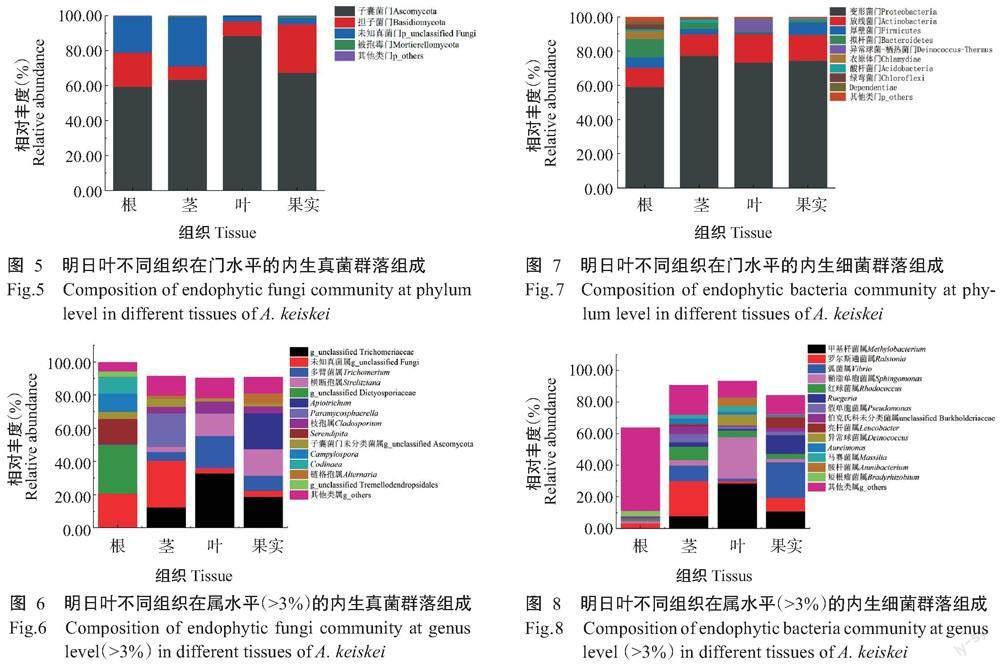
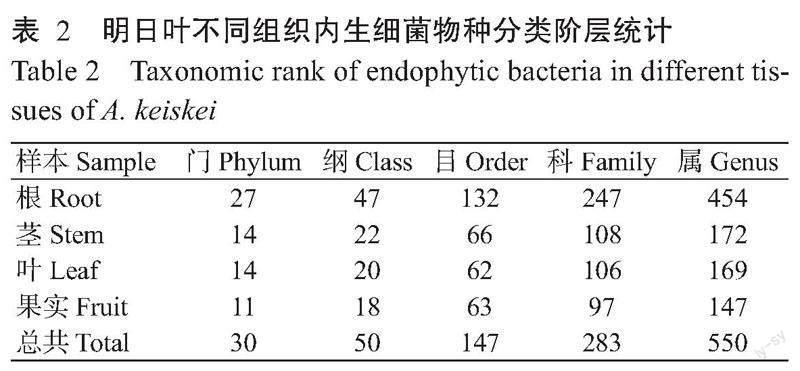
2. 3. 1 内生真菌组成 700个内生真菌OTUs比对到7个门和228个属。在门水平上,根部菌门数最多,为6个(表1)。由图5可知,子囊菌门(Ascomycota)在根、茎、叶和果实组织中均占主要优势,其中在叶部占比最高;而其他类门(p_others)和擔子菌门(Basidiomycota)在果实占比均高于根、茎和叶,未知真菌门(p_unclassified Fungi)在茎中相对占比最多。在属分类水平上,根有81个菌属,未知真菌属(g_unclassified Fungi)、g_unclassified Dictyosporiaceae、Serendipita、Campylospora、Codinaea、子囊菌门未分类菌属(g_unclassified Ascomycota)和g_unclassified Tremellodendropsidales 等7个菌属的相对丰度占比大于3.00%,其他类属(g_others)占比5.51%;茎有93个菌属,未知真菌属、Paramycosphaerella、g_unclassified Trichomeriaceae、多臂菌属(Trichomerium)、子囊菌门未分类菌属、横断孢属(Strelitziana)和枝孢属(Cladosporium)等7个菌属的相对丰度占比大于3.00%,其他类属占比11.79%;叶有156个菌属,g_unclassified Trichomeriaceae、多臂菌属、横断孢属、枝孢属和未知真菌属等5个菌属的相对丰度占比大于3.00%,其他类属占比11.99%;果实有81个菌属,Apiotrichum、g_unclassified Trichomeriaceae、横断孢属、多臂菌属、链格孢属(Alternaria)、枝孢属和未知真菌属等7个菌属的相对丰度占比大于3.00%,其他类属占比9.78%。4个组织共有内生真菌属32个,占总属类的14.03%(图6)。
2. 3. 2 内生细菌组成 1393个内生细菌OTUs比对到30个门和550个属(表2)。由图7可知,在门分类水平上,变形菌门(Proteobacteria)在根、茎、叶和果实中占主要优势。拟杆菌门(Bacteroidetes)、衣原体门(Chlamydiae)、绿弯菌门(Chloroflexi)、Dependentiae及其他类菌门在根中相对占比均最高;放线菌门(Actinobacteria)、异常球菌—栖热菌门(Deinococcus-Thermus)在叶中相对占比最多;厚壁菌门(Firmicutes)在果实的相对占比均高于其他组织;而酸杆菌门(Acidobacteria)在茎中相对占比最高。在属分类水平上,根有454个菌属,仅罗尔斯通菌属(Ralstonia)和短根瘤菌属(Bradyrhizobium)2个菌属相对丰度占比大于3.00%,其他类属占比52.66%;茎有172个菌属,罗尔斯通菌属、弧菌属(Vibrio)、红球菌属(Rhodococcus)、假单胞菌属(Pseudomonas)、甲基杆菌属(Methylobacterium)、伯克氏科未分类菌属(g_unclassified Burkholderiaceae)、Aureimonas和鞘脂单胞菌属(Sphingomonas)等8个菌属的相对丰度占比大于3.00%,其他类属占比18.54%;叶有169个菌属,甲基杆菌属、鞘脂单胞菌属、异常球菌属(Deinococcus)、胺杆菌属(Amnibacterium)、红球菌属和马赛菌属(Massilia)6个菌属相对丰度占比大于3.00%,其他类属占比10.50%;果实有147个菌属,弧菌属、Ruegeria、甲基杆菌属、罗尔斯通菌属、亮杆菌属(Leucobacter)和红球菌属等6个菌属相对丰度占比大于3.00%,其他类属占比11.81%。4个组织共有内生细菌属58个,占总属类的10.55%(图8)。
2. 3. 3 内生菌群落结构热图分析 对明日叶不同组织内生真菌和内生细菌测序所得的OTU结果在属水平上进行分类,并利用相对丰度信息绘制热图,选取在属水平上前30的物种进行聚类分析(图9),在内生真菌方面,叶和果实聚为一类,而对于内生细菌,茎和果实聚为一类。根与其他3个组织的菌群物种组成和物种丰度差距均最大。
2. 4 明日叶不同组织内生菌群落差异性
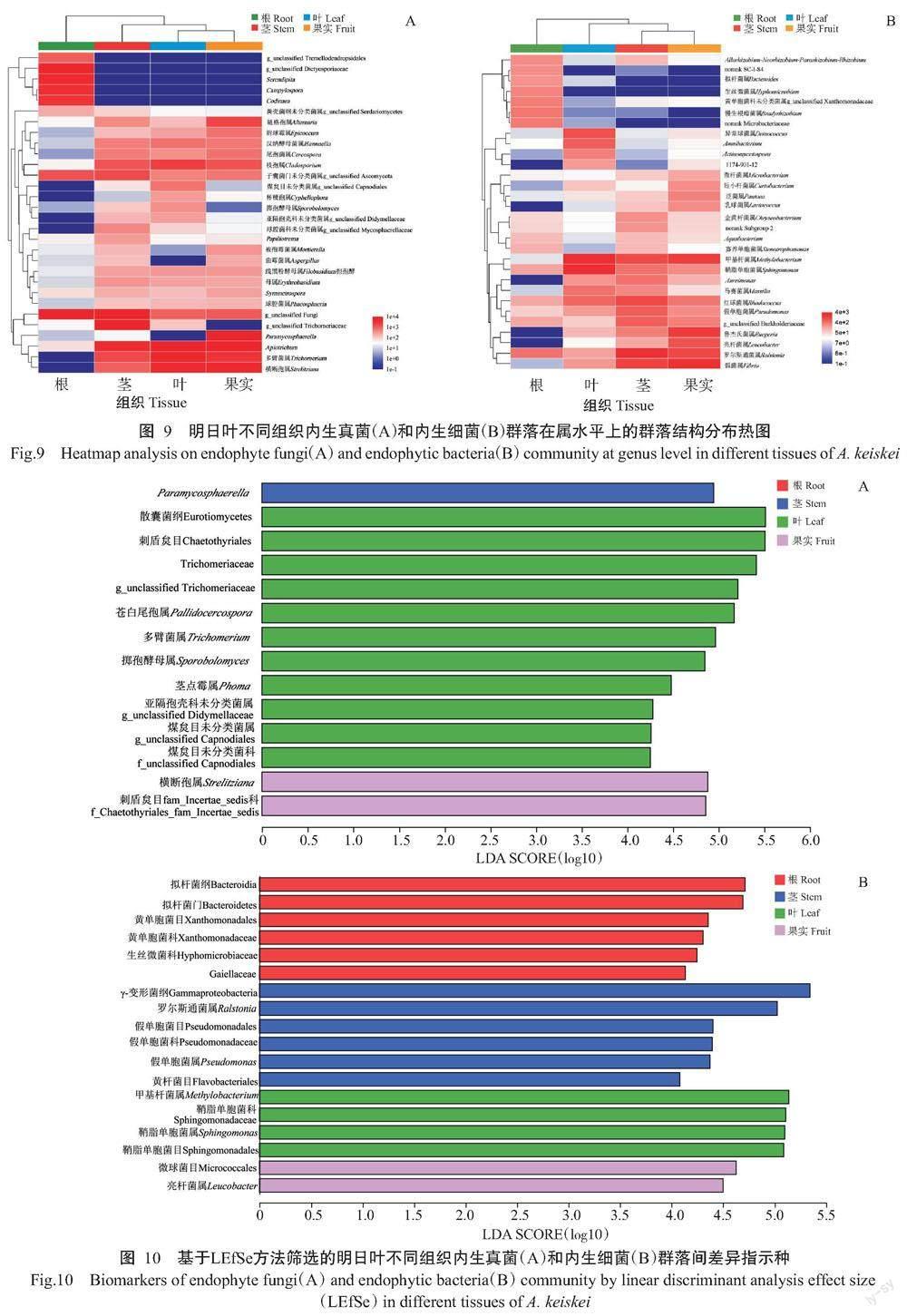
采用LEfSe分析方法进行明日叶不同组织内生菌差异显著分析,寻找具有差异的生物标识(Biomarker)。设置LDA阈值为4,从图10-A可看出,除根外,Paramycosphaerella是茎中起重要作用的内生真菌类群;散囊菌纲(Eurotiomycetes)、刺盾炱目(Chaetothyriales)、Trichomeriaceae、苍白尾孢属(Pallidocercospora)、多臂菌属、掷孢酵母属、茎点霉属、亚隔孢壳科未分类菌属(g_unclassified Didymellaceae)、煤炱目未分类菌科(f_unclassified Capnodiales)和煤炱目未分类菌属(g_unclassified Capnodiales)是叶中起重要作用的内生真菌类群;横断孢属和刺盾炱目的fam_Incertae_sedis科是果中起重要作用的内生真菌类群。从图10-B可知,根中起重要作用的内生细菌类群是拟杆菌纲(Bacteroidia)、拟杆菌门、黄单胞菌目(Xanthomonadales)、黄单胞菌科(Xanthomonadaceae)、生丝微菌科(Hyphomicrobiaceae)和Gaiellaceae;茎中起重要作用的内生真菌类群是γ-变形菌纲(Gammaproteobacteria)、罗尔斯通菌属、假单胞菌目(Pseudomonadales)、假单胞菌科(Pseudomonadaceae)、假单胞菌属和黄杆菌目(Flavobacteriales);叶中起重要作用的内生细菌类群是甲基杆菌属、鞘脂单胞菌目(Sphingomonadales)、鞘脂单胞菌科(Sphingomonadaceae)和鞘脂单胞菌属;果实中起重要作用的内生细菌类群是微球菌目(Micrococcales)和亮杆菌属。
2. 5 明日叶内生菌菌群功能组成
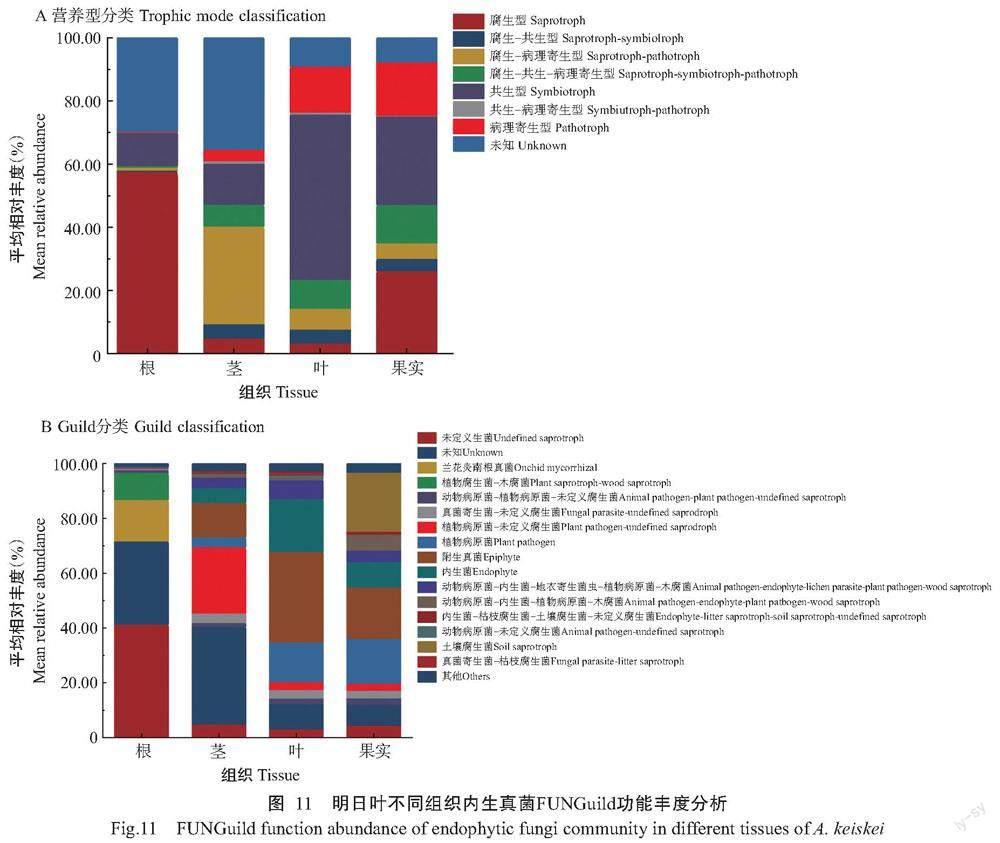
2. 5. 1 内生真菌 通过FUNGuild数据库内生真菌群落功能预测(图11)可知,从营养类型看,腐生型(57.67%)、未知(29.79%)和共生型(10.42%)在根组织中占比较大;茎中未知型(35.36%)、腐生—病理寄生型(30.89%)和共生型(13.01%)占优势;叶中共生型(52.33%)、病理寄生型(14.49%)和腐生—共生—病理寄生型(9.17%)占比较高;果实中共生型(28.04%)、腐生型(26.19%)、病理寄生型(16.96%)和腐生—共生—病理寄生型(12.21%)具有优势。根据Guild分类,又分为植物病原菌、附生真菌、植物内生菌、土壤腐生菌、兰花类菌根真菌、植物腐生菌—木腐菌等17种。除未知腐生菌和未定义功能外,根中菌根真菌(15.05%),茎中植物病原菌—未定义腐生菌(24.14%)和附生真菌(12.55%),叶中植物病原菌(14.48)、附生真菌(32.99%)和内生菌(19.27%),以及果实中植物病原菌(16.36%)、附生真菌(16.78%)和土壤腐生菌(21.55%)功能菌群在各组织Guild分类中的占比均超过10.00%。
2. 5. 2 内生细菌 通过比对EggNOG数据库得到24种COG功能,包括RNA加工和修饰(A),染色质结构和动态变化(B),能量产生与转换(C),细胞循环调控、细胞分裂、染色体分裂(D),氨基酸转运和代谢(E),核苷酸转运与代谢(F),碳水化合物的运输和代谢(G),辅酶转运与代谢(H),脂质转运和代谢(I),翻译、核糖体结构和生物合成(J),翻译(K),复制、重建和修复(L),细胞壁/细胞膜/膜结构的生物合成(M),细胞活力(N),翻译后修饰、蛋白质周转、伴侣(O),无机离子转运与代谢(P),次生代谢产物的合成、转运和代谢(Q),一般功能预测(R),未知功能基因家族(S),信号转导机制(T)、细胞内转运、分泌和液泡运输(U)、防御机制(V)、細胞外结构(W),以及细胞骨架(Z),其丰度随组织的不同而异。明日叶不同组织内生细菌COG功能组成分析显示,根中排名前10的COG功能分布是S>E>R>C>K>M>T>P>G>L,茎中S>E>R>C>K>P>T>M>G>J,叶中S>E>R>C>K>P>G>M>T>I,果实中S>E>R>K>C>G>P>M>J>T。在明日叶根(2.58%)、茎(2.59%)、叶(2.94%)、果实(2.29%)组织中Q相关基因均有表达。
3 讨论
3. 1 不同组织中内生菌多样性和丰富度的差异分析
相关研究认为,宿主植物群落多样性受植物种类及同种植物不同组织的结构、功能和特有化学成分等因素影响(Deng et al.,2019)。通过对冰川棘豆内生菌多样性研究可知,内生真菌和内生细菌群落结构和多样性存在差异(许国琪等,2021);对蛇足石杉内生真菌的研究(Fan et al.,2020)发现,其叶部具有相对茎和根组织更为丰富的内生菌群落组成。本研究中,明日叶4个不同组织均定殖丰富的内生真菌和内生细菌,但其分布存在器官组织差异性,叶中也表现出较高的内生真菌群落多样性和丰富度,根部最低,而根中内生细菌群落多样性和丰富度最高。究其原因,可能叶部除来源于茎部真菌外,较大的表面积利于来自空气、水分或其他生物的真菌附着并进入植物体,植物光合作用产生的丰富营养物质也为真菌共生创造优越条件。但也有研究发现根中具有最高的内生真菌丰富度和多样性(Wang et al., 2022),可能与宿主种类、生长环境不同有关,还应做进一步研究。有报道得出中药石莲根部内生细菌的多样性和丰富度显著高于叶和茎(Huo et al.,2020),可能由于内生细菌常以根际土壤微生物为起点,经根部表面和内部开始定殖,随着蒸腾作用沿着维管束向茎部和叶部迁移,且微生物对根部浸染程度强于地面部分,从而导致根部内生细菌群落多样性高于其他组织。
3. 2 不同组织中内生菌的群落组成分析
通过聚类热图分析,明日叶的根、茎、叶和果实微生物菌群组成差异较大,但茎、叶和果实组织内生真菌和内生细菌群落结构相近,由于三者发育来源均属于地面组织,可能是三者内生菌结构更为类似的原因,说明明日叶组织是影响其内生菌种群结构与多样性变化因素之一。
白蔹、蛇足石杉等药用植物的内生菌中子囊菌门为优势类群(Fan et al.,2020;李鉴滨等,2022),子囊菌门是真菌中种类最多的类群,占真菌总数的40%,可能与奠基者效应及其遗传特性有关(张淼等,2020),且在根际土壤、藏茶、葡萄表皮等中均占比较高。本研究中子囊菌门亦为不同组织内生真菌优势菌门,该门类中大多数为腐生菌,具有较强的物质分解和合成能力,在养分循环中起着重要作用(张爱梅等, 2021),是最易与植物互惠共生的门类,因此该菌门对明日叶不同组织的养分循环和代谢具有意义。高通量测序的明日叶不同组织优势菌属与纯培养内生真菌结果有较大差异(刘雯雯等,2022),说明传统培养法解析植物内生真菌群落多样性的深度与高通量技术有较大差别。此外,茎、叶和果实共有的多臂菌属具有促进宿主植物产生药用价值物质的作用(Nassal et al.,2018)。仅存在于根中的Serendipita能产生促进宿主互作的效应分子(Mahdi et al.,2022)。Campylospora、横断孢属和Apiotrichum等菌属可合成有用的生物活性物质或对寄主植物具有重要的生态效应。本研究中仍有一些OTU序列在不同的分类水平上未被注释分类,表明明日叶体内还蕴含有大量未知的内生真菌,有待深入研究。
明日叶4个组织中优势细菌门类为变形菌门。变形菌门是植物内部存在的最广泛的细菌门类,物種和遗传多样性丰富,具有生物固氮、病虫害防治和土壤修复等辅助作用,莼菜嫩芽、茎和叶(张秋玉等, 2022)及甜樱桃(赵柏霞和闫建芳,2022)不同组织内生细菌分析均发现,优势细菌门类为变形菌门,且变形菌门丰度越高,组织内碳氮养分及有机质含量就越多。放线菌门、厚壁菌门和拟杆菌门是促进生物进化、挖掘农用抗生素菌群的重要种质资源来源,其在明日叶中占比也较高。此外,本研究利用高通量测序结果注释到的一些具有不同功能的优势菌或核心种,如假单胞菌属的某些菌株可分泌生长素和抗生素,作为生物防治菌(王红莹等, 2021)。罗尔斯通菌属具有碳固定和能量利用的代谢特点。马赛菌属广泛存在于水体、植物根际和叶际等环境中,具有分泌生长素和酶、增强植物抗逆性、耐受重金属等功能(陈翔,2021)。分布于根中的短根瘤菌属具有固氮作用;叶中甲基杆菌属和鞘脂单胞菌属具有促生和抑制病原体的作用,表明组织特征是影响明日叶内生菌群落结构的重要因素,明日叶不同组织内生菌的种类、丰度和功能有较大差异。同时,明日叶组织中还存在大量未被注释的微生物类群,可为挖掘促生、抗逆及医药等有重要应用价值的新种提供基础。
3. 3 不同组织内生菌功能预测分析
内生真菌与植物宿主的演化选择过程中,为应对植物不同时期、不同组织的生理状态,具备共生、腐生和寄生生存策略,并发挥自生重要的生态作用,而内生细菌通过与宿主植物间基因的横向转移,参与宿主关键的生命活动(孙红敏等,2016)。本研究利用FUNGuild对内生真菌群落营养模式和功能分析发现,不同组织中未知营养型和功能型均占比较大,说明FUNGuild数据库解析不全面,也反映出明日叶存在大量待挖掘的内生真菌资源。根中腐生型功能群较高,可能因为根接触土壤,根际土壤中腐生真菌种类多,腐生真菌进入根中成为内生真菌的概率更高,同时腐生真菌可产生氧化酶和水解酶,利于碳水化合物的分级,与养分循环密切相关(宁琪等,2022)。茎中病理腐生型功能群较多,叶和果实中共生型功能群占比较高,可能由于植物内生真菌在不同组织中发挥不同功能,导致不同组织优势功能类群分布不同。针对内生细菌功能,氨基酸运输与代谢和能量产生与转换的相关基因在各组织中均占比较高,为各组织提供基础保障;叶组织无机离子运输与代谢相关基因比其他组织高,可能与叶活动功能代谢快有关。次生代谢产物是内生菌发挥功能作用的物质基础(李盼盼等,2018),明日叶不同组织中均存在一定比例的次生代谢产物生物合成、分解代谢相关基因,为微生物参与宿主植物代谢提供可能。
4 结论
明日叶中蕴含丰富多样的内生菌群,在不同组织中的群落结构、多样性、优势菌属及差异指示种存在保守性与差异性,组织特征差异是影响内生菌群的重要因素;不同组织内生菌群生态功能亦差异较大,且大量为未鉴定出种属和未定义的功能菌群。
参考文献:
蔡媛,刘浩,孔文平,钟灿,谢景,王勇庆,黄建华,张水寒. 2021. 多花黄精内生菌群落结构多样性及其与有效成分含量相关性研究[J]. 中草药,52(13):4023-4030. [Cai Y,Liu H,Kong W P,Zhong C,Xie J,Wang Y Q,Huang J H,Zhang S H. 2021. Study on community and diversity of endophyte and its correlation with active ingredient content in Polygonatum cyrtonema[J]. Chinese Traditional and Herbal Drugs,52(13):4023-4030.] doi:10.7501/j.issn.0253-2670.2021.13.025.
陈美琪,王兴,黎俊彦,谭绮雯,李鉴滨,姚华雄,张玉鑫,谢思韵,邓祖军. 2023. 基于高通量测序和组织分离法的虎耳草内生真菌多样性分析及其抗氧化活性研究[J]. 中草药,54(6):1924-1934. [Chen M Q,Wang X,Li J Y,Tan Q W,Li J B,Yao H X,Zhang Y X,Xie S Y,Deng Z J. 2023. Study of endophytic fungi diversity of Saxifraga stolonifera based on high-throughput sequencing method and tissue isolation method and their antioxidant activities[J]. Chinese Traditional and Herbal Drugs,54(6):1924-1934.] doi:10.7501/j.issn.0253-2670.2023.06.025.
陈翔. 2021. 人工湿地污水处理系统马赛菌(Massilia)组成、分布特征及影响因素研究[D]. 青岛:青岛理工大学. [Chen X. 2021. Study on the composition distribution characteristics and influencing factors of Massilia in constructed wetland wastewater treatment system[D]. Qingdao:Qingdao Technological University.]
郭文秀,巨凤,沈芋蓉,谭璐,李新爱,郭大乐,邓赟. 2022. 川芎内生菌Pseudeurotium ovale代谢产物研究[J]. 天然产物研究与开发,34(2):239-244. [Guo W X,Ju F,Shen Y R,Tan L,Li X A,Guo D L,Deng Y. 2022. Study on metabolites of Pseudeurotium ovale isolated from Ligusticum chuanxiong[J]. Natural Product Research and Deve lopment,34(2):239-244.] doi:10.16333/j.1001-6880. 2022.2.009.
黃雪珍,赵龙飞. 2023. 药用植物内生菌对宿主植物促生作用机制研究进展[J]. 微生物学通报,50(4):1653-1665. [Huang X Z,Zhao L F. 2023. Mechanism of endophytes of medicinal plants in promoting the growth of host plants[J]. Microbiology China,50(4):1653-1665.] doi:10.13344/j.microbiol.china.221120.
李鉴滨,张增峰,谭绮雯,陈美琪,姚华雄,邓祖军. 2022. 基于高通量解析和可培养技术的白蔹内生真菌类群分析及分离菌株的抗痤疮致病菌活性[J/OL]. 微生物学通报. 2022-11-24. https://kns.cnki.net/kcms/detail/11.1996.q.20221122.1551.003.html. [Li J B,Zhang Z F,Tan Q W,Chen M Q,Yao H X,Deng Z J. 2022. Taxonomic analysis of fungal endophytes from Ampelopsis japonica (Thunb.) Makino by high-throughput sequencing and culture-dependent methods and the activity of the isolated strains against acne-associated pathogens[J/OL]. Microbiology China. 2022-11-24. https://kns.cnki.net/kcms/detail/11.1996.q.20221122.1551.003.html.]
李盼盼,袁晓龙,李金海,申国明,高林,李青诚,高加明,张鹏. 2018. 湖北烟草内生真菌生物多样性和种群结构分析[J]. 微生物学报,58(10):1853-1863. [Li P P,Yuan X L,Li J H,Shen G M,Gao L,Li Q C,Gao J M,Zhang P. 2018. Biodiversity and community structure of endophy tic fungi isolated from Nicotiana tabacum L.[J]. Acta Microbiologica Sinica,58(10):1853-1863.] doi:10.13343/j.cnki.wsxb.20180125.
刘雯雯,冯瑞章,魏琴,周万海,王虹,杜永华. 2022. 明日叶可培养内生真菌分离鉴定及功能性筛选[J]. 食品与发酵工业,48(15):137-144. [Liu W W,Feng R Z,Wei Q,Zhou W H,Wang H,Du Y H. 2022. Isolation,identification and functional screening of culturable endophytic fungi from Angelica keiskei[J]. Food and Fermentation Industries,48(15):137-144.] doi:10.13995/j.cnki.11-1802/ts.029994.
宁琪,陈林,李芳,张丛志,马东豪,蔡泽江,张佳宝. 2022. 被孢霉对土壤养分有效性和秸秆降解的影响[J]. 土壤学报,59(1):206-217. [Ning Q,Chen L,Li F,Zhang C Z,Ma D H,Cai Z J,Zhang J B. 2022. Effects of Mortierella on nutrient availability and straw decomposition in soil[J]. Acta Pedologica Sinica,59(1):206-217.] doi:10. 11766/trxb202006020213.
孙红敏,魏玉珍,方晓梅,余利岩,张玉琴. 2016. 蛇足石杉内生细菌多样性[J]. 微生物学报,56(4):614-628. [Sun H M,Wei Y Z,Fang X M,Yu L Y,Zhang Y Q. 2016. Diversity of endophytic bacteria isolated from Huperzia serrata[J]. Acta Microbiologica Sinica,56(4):614-628.] doi:10.13343/j.cnki.wsxb.20150275.
王红莹,李春燕,宋发军,林爱华,孟艳艳. 2021. 一株白及内生细菌的分离鉴定及抑菌机理初步研究[J]. 中南民族大学学报(自然科学版),40(2):246-251. [Wang H Y,Li C Y,Song F J,Lin A H,Meng Y Y. 2021. Isolation and identification of an endophytic bacterium from Bletilla striata and preliminary study of antibacterial mechanism[J]. Journal of South-central Minzu University(Na tural Science Edition),40(2):246-251.] doi:10.12130/znmdzk.20210305.
许国琪,刘怡萱,曹鹏熙,姬亚丽,李敬科,李小燕,刘星. 2021. 基于Illumina MiSeq测序技术对冰川棘豆(Oxytropis glacialis)不同组织内生菌多样性的研究[J]. 生态学报,41(12):4993-5003. [Xu G Q,Liu Y X,Cao P X,Ji Y L,Li J K,Li X Y,Liu X. 2021. Endophytes diversity of Oxytropis glacialis at different tissues based on Illumina MiSeq sequencing[J]. Acta Ecologica Sinica,41(12):4993-5003.] doi:10.5846/stxb202005081148.
张爱梅,殷一然,孔维宝,朱学泰,杨颖丽. 2021. 西藏沙棘5种不同组织内生细菌多样性[J]. 生物多样性,29(9):1236-1244. [Zhang A M,Yin Y R,Kong W B,Zhu X T,Yang Y L. 2021. Diversity of endophytic bacteria in five types of tissues of Hippophae tibetana[J]. Biodiversity Science,29(9):1236-1244.] doi:10.17520/biods.2021034.
張丽芳,胡海林,桂腾茸,高秀,徐晴芳,朱铃,徐启贺,蔡建. 2023. 火棘不同组织内生细菌群落多样性[J/OL]. 广西植物. 2023-04-13. https://kns.cnki.net/kcms/detail/45.1134. q.20230411.1651.014.html. [Zhang L F,Hu H L,Gui T R,Gao X,Xu Q F,Zhu L,Xu Q H,Cai J. 2023. Diversity of endophytic bacterial community in different Pyracantha fortuneana tissues[J/OL]. Guihaia. 2023-04-13. https://kns.cnki.net/kcms/detail/45.1134.q.20230411. 1651.014.html.]
张淼,陈裕凤,陈龙,黄飘玲,韦露玲. 2020. 不同地区药用植物两面针根际土壤真菌种群多样性差异分析[J]. 生物技术通报,36(9):167-179. [Zhang M,Chen Y F,Chen L,Huang P L,Wei L L. 2020. Difference analysis of the community diversity of fungi in the rhizosphere soil of Zanthoxylum nitidum(Roxb.)DC in different regions[J]. Biotechnology Bulletin,36(9):167-179.] doi:10.13560/j.cnki.biotech.bull.1985.2020-0667.
张秋玉,陈晶,周雪妹,龚汉雨,余光辉. 2022. 莼菜不同组织内生细菌多样性的比较分析[J]. 中南民族大学学报(自然科学版),41(3):285-291. [Zhang Q Y,Chen J,Zhou X M,Gong H Y,Yu G H. 2022. Diversity of entophytic bacteria in different tissues of Brasenia schreberi[J]. Journal of South-central Minzu University(Natural Scien ce Edition),41(3):285-291.] doi:10.12130/znmdzk. 20220305.
赵柏霞,闫建芳. 2022. 高通量技术分析‘砂蜜豆’甜樱桃不同组织内生细菌多样性[J]. 中国农业科技导报,25(3):66-77. [Zhao B X,Yan J F. 2022. Diversity analysis of endophytic bacterial community in different tissues of ‘Summit’ sweet cherry using high-throughput sequencing[J]. Journal of Agricultural Science and Technology,25(3):66-77.] doi:10.13304/j.nykjdb.2021.0647.
Deng Z S,Liu X D,Zhang B C,Jiao S,Qi X Y,Sun Z H,He X L,Liu Y Z,Li J,Chen K K,Lin Z X,Jiang Y Y. 2019. The root endophytic fungi community structure of Pennisetum sinese from four representative provinces in China[J]. Microorganisms,7(9):332. doi:10.3390/microorganisms7090332.
Dong L L,Cheng R Y,Xiao L N,Wei F G,Wei G F,Xu J,Wang Y,Guo X T,Chen Z J,Chen S L. 2018. Diversity and composition of bacterial endophytes among plant parts of Panax notoginseng[J]. Chinese Medicine,13(1):41. doi:10.1186/s13020-018-0198-5.
Fan S P,Miao L Y,Li H D,Lin A H,Song F J,Zhang P. 2020. Illumina-based analysis yields new insights into the diversity and composition of endophytic fungi in cultivated Huperzia serrata[J]. PLoS One,15(11):e0242258. doi:10.1371/journal.pone.0242258.
Gong S X,Xu B,Gu X Z,Li W H,Yu Y,Zhang Wei,Wang Z W. 2020. Study on the effects of sugar alcohols and Angelica keiskei flour on cookie quality,antioxidant,and nutrition[J]. Cereal Chemistry,97(3):714-722. doi:10. 1002/cche.10287.
Huo X W,Wang Y,Zhang D W,Gao T,Liu M M. 2020. Characteristics and diversity of endophytic bacteria in endangered Chinese herb Glehnia littoralis based on illumina sequencing[J]. Polish Journal of Microbiology,69(3):283-291. doi:10.33073/pjm-2020-031.
Mahdi L K,Miyauchi S,Uhlmann C,Garrido-Oter R,Langen G,Wawra S,Niu Y L,Guan R,Robertson-Albertyn S,Bulgarelli D,Parker J E,Zuccaro A. 2022. The fungal root endophyte Serendipita vermifera displays inter-kingdom synergistic beneficial effects with the microbiota in Arabidopsis thaliana and barley[J]. ISME Journal,16(3):876-889. doi:10.1038/s41396-021-01138-y.
Nassal D,Spohn M,Eltlbany N,Jacquiod S,Smalla K,Marhan S,Kandeler E. 2018. Effects of phosphorus-mobilizing bacteria on tomato growth and soil microbial activity[J]. Plant and Soil,427(1-2):17-37. doi:10.1007/s11104-017-3528-y.
Wang R,Zhang Q,Ju M,Yan S,Zhang Q,Gu P. 2022. The endophytic fungi diversity,community structure,and ecological function prediction of Sophora alopecuroides in Ningxia,China[J]. Microorganisms,10(11):2099. doi:10.3390/microorganisms10112099.
(責任编辑 邓慧灵)
收稿日期:2023-04-15
基金项目:四川省自然科学基金项目(2022NSFSC0176);四川省科学技术厅应用基础项目(2018JY0495);宜宾市科技局高端创新创业团队项目(2021YGC03)
通讯作者:周万海(1979-),https://orcid.org/0000-0002-8013-0029,博士,副教授,主要从事农业资源开发利用研究工作,E-mail:wanhaizhou@126.com;冯瑞章(1978-),https://orcid.org/0000-0002-1601-5843,博士,教授,主要从事微生物资源开发利用研究工作,E-mail:ruizhangfeng@126.com
第一作者:刘雯雯(1991-),https://orcid.org/0000-0002-8659-430X,主要从事微生物学研究工作,E-mail:965501606@qq.com

