两种新型的BTK和HDAC抑制剂在弥漫性大B细胞淋巴瘤细胞中的协同抗肿瘤作用*
杨 婕, 魏 婷, 许艳丽, 玉 斌, 杨 荧, 李庆山,△
(1华南理工大学附属第二医院血液科,广东 广州 510180;2暨南大学附属广州红十字会医院血液科,广东 广州 510220;3华南理工大学医学院,广东 广州 510006)
弥漫性大B 细胞淋巴瘤(diffuse large B-cell lymphoma, DLBCL)是B 细胞非霍奇金淋巴瘤(non-Hodgkin lymphoma, NHL)中最常见的亚型,具有不同的临床病理特征。通过基因表达谱,根据淋巴瘤细胞的起源细胞可以将DLBCL 病例分为生发中心B细胞样(germinal center B-cell-like, GCB)型、活化B细胞样(activated B-cell-like, ABC)型和未确定型[1]。在采用利妥昔单抗(rituximab, RTX)联合环磷酰胺、阿霉素、长春新碱、强的松一线治疗(R-CHOP)化疗方案的DLBCL 患者中,ABC 型患者的预后明显差于GCB 型患者。在非GCB 型DLBCL 的治疗中,治疗后总体复发率超过30%[2-3]。一些难治/复发病例对CD20 单抗产生耐药性,这使得治疗更加困难。因此,寻求新的治疗策略,可为该疾病的临床治疗提供新的思路。
组蛋白脱乙酰酶(histone deacetylase, HDAC)是从组蛋白中去除乙酰基的酶家族,是关键的表观遗传沉默因子。HDAC 抑制剂通过干扰HDAC 可以逆转肿瘤抑制基因的转录抑制并影响多种基因的表达、诱导DNA 损伤并抑制DNA 修复、在多个层面上与细胞凋亡的线粒体和死亡受体介导途径相互作用,上调促凋亡和下调抗凋亡蛋白[4]。pracinostat 是一种基于羟肟酸的新型组蛋白去乙酰酶抑制剂。在体外,pracinostat 抑制I 类,II 类和IV 类HDAC,对其他锌结合酶没有影响,并且对多种肿瘤细胞系显示出显著的抗增殖活性[5]。作为B 细胞受体(B cell receptor, BCR)依赖性细胞生长的关键介质,由BTK介导的BCR 信号通路的异常激活也是部分NHL 包括DLCBL 的另一个重要致病因素[6-7]。BTK 参与B细胞发育的各个方面,如增殖、凋亡和细胞迁移[6]。BTK抑制剂已证实在B 细胞恶性肿瘤中具有治疗活性。据报道,BTK 抑制剂如伊布替尼在治疗B 细胞NHL方面显示出巨大的潜力[8],但作为单药疗效有限[9]。泽布替尼是第二代BTK 抑制剂,与伊布替尼相比,泽布替尼具有更强的BTK 靶点占据和更低的脱靶效应。首例报道CAR-T 细胞治疗失败后,HDAC 和BTK 双重抑制治疗复发/难治性DLBCL 的案例,为未来的治疗开辟了新的可能性[10]。在病例报道中,原发性骨髓弥漫性大B 细胞淋巴瘤的老年患者在RCHOP 治疗无效后,同时给予HDAC 抑制剂西达本胺和BTK 抑制剂伊布替尼,患者达到完全缓解[11]。靶向BCR 通路中PI3K 和HDAC 双重抑制剂也在体外和人DLBCL 异种移植小鼠模型中显示出抗肿瘤功效[12]。HDAC 和BTK 的双重抑制在DLBCL 治疗中显示出协同作用,其在临床上已进行尝试且取得令人满意的疗效,但仍缺乏基础实验及机制验证[10]。
本研究以人弥漫性大B 细胞淋巴瘤细胞为研究对象,从细胞水平探讨BTK 抑制剂泽布替尼和HDAC 抑制剂pracinostat 联用是否可促进DLBCL 细胞凋亡,抑制肿瘤细胞生长,发挥协同抗肿瘤效应,为pracinostat 作为新型治疗药物的开发以及DLBCL的临床治疗提供参考和数据支持。
材 料 和 方 法
1 细胞
人弥漫性大B 细胞淋巴瘤(NU-DUL-1 为ABC型,SU-DHL-6 为GCB 型)细胞株购自上海中乔新舟生物科技有限公司,所有实验均使用处于对数生长期的细胞。
2 主要试剂和仪器
泽布替尼(zanubrutinib)和pracinostat(SB939)购自Selleck;CellTiter-Glo®2.0 Cell Viability Assay 购自Promega;Annexin V/7-AAD 购自BD;多腺苷二磷酸核 糖 聚 合 酶1[poly(ADP-ribose) polymerase 1,PARP1]、caspase-3、caspase-8 和tubulin-HRP 抗体购自CST;三色预染蛋白Marker、Tris/甘氨酸/SDS 电泳缓冲液(10×)、PAGE 凝胶快速制备试剂盒(10%)、PAGE 凝胶快速制备试剂盒(15%)、封闭用BSA、TBS/Tween 缓冲液(10×)、Omni-ECL™基础型化学发光检测试剂盒(皮克级)和Omni-ECL™超灵敏化学发光检测试剂盒(飞克级)购自上海雅酶生物医药科技有限公司;甘氨酸、SDS 和Tris 碱购自生工生物工程股份有限公司;Amersham Protran 0.2 µm 硝酸纤维素膜购自Cytiva。
3 方法
3.1 细胞培养 DLBCL 细胞的NU-DUL-1 细胞(ABC 亚型)以及SU-DHL-6 细胞(GCB 亚型)在含有10%的FBS 和 1% 青霉素-链霉素的RPMI-1640 培养基中培养。
3.2 CellTiter-Glo 法检测药物对细胞增殖的影响收集对数生长期的NU-DUL-1和SU-DHL-6细胞离心后用完全培养基重悬,将细胞以每孔5 000 个细胞、100 µL 的密度接种到96 孔细胞培养板中,用浓度为0、2.5、5、10、20、40、80 和160 µmol/L 的单药泽布替尼和浓度为0、15.63、31.25、62.5、125、250、500、1 000、2 000 nmol/L 的单药pracinostat 分别处理NUDUL-1 细胞和SU-DHL-6 细胞。将96 孔板在培养箱中分别培养24、48 和72 h 后,用CellTiter-Glo 试剂裂解细胞,并在室温孵育30 min 后在多功能酶标仪检测测定发光值(relative light unit, RLU),使用SynergyFinder(https://synergyfinder.fimm.fi)选用零相互作用效价(zero interaction potency, ZIP)模型[13]计算出联合用药的协同指数,大于10 表示两种药物之间的相互作用为协同效应(小于-10:两种药物之间的相互作用可能是拮抗性的; -10~10:两种药物之间的相互作用可能是相加的;大于10:两种药物之间的相互作用可能是协同的)。
3.3 CellTiter-Glo 法检测药物对细胞增殖抑制的协同作用 收集对数生长期的NU-DUL-1 和SU-DHL-6细胞离心后用完全培养基重悬,将细胞以每孔5 000个细胞、100 µL 的密度接种到96 孔细胞培养板中,用浓度为0、5、7.5、10、12.5和15 µmol/L的泽布替尼和浓度为0、15.63、31.25、62.5、125 和250 nmol/L 的pracinostat,单药或联合处理NU-DUL-1 细胞和SUDHL-6 细胞。将96 孔板在培养箱中分别培养48 h后,用CellTiter-Glo 试剂裂解细胞,并在室温孵育30 min后在多功能酶标仪检测测定发光值。
3.4 Annexin V/7-AAD 流式细胞术检测药物对细胞凋亡的影响 收集对数期生长的细胞,以每孔5×105细胞、2 mL 接种至6 孔板中,用浓度为0、20 µmol/L的泽布替尼和浓度为0、200 nmol/L 的pracinostat 单药或联合处理NU-DUL-1 细胞,用浓度为0、20 µmol/L 的泽布替尼和浓度为0、150 nmol/L 的pracinostat 单药或联合处理SU-DHL-6 细胞。培养箱培育48 h 后,收集细胞培养液于1.5 mL EP 管中,以2 000 r/min,室温离心5 min后,弃上清,预冷PBS洗涤后,加入1×Binding Buffer 缓冲液,离心后重悬为100 µL,加入5µL Annexin V-APC 和5 µL 7-AAD,混匀后室温避光孵育15 min,加入1×Binding Buffer 缓冲液重悬至500 µL,采用流式细胞仪检测细胞凋亡情况。
3.5 Western blot 法检测凋亡相关蛋白表达 收集对数期生长的细胞,以每孔1×106细胞、3 mL 接种至6孔板中,用浓度为0、10、20 µmol/L 的泽布替尼和浓度为0、100、200 nmol/L 的pracinostat 单药或联合处理NU-DUL-1细胞,用浓度为0、10、20 µmol/L 的泽布替尼和浓度为0、150、300 nmol/L 的pracinostat 单药或联合处理SU-DHL-6 细胞。培养箱培育48 h 后,收集细胞培养液于1.5 mL EP 管中,以2 000 r/min,室温离心5 min 后,弃上清,再次用预冷PBS 洗涤后离心并弃上清。提取细胞总蛋白,制备蛋白样品,于10%和6% SDS-PAGE 中分离,转移到硝酸纤维素膜,然后用0.4%丽春红染色以观察蛋白质上样量。在使用TBST 配制的5%脱脂牛奶中封闭1 h后,将膜与Ⅰ抗4 ℃孵育过夜,然后使用HRP 连接的Ⅱ抗室温孵育1 h。根据制造商的说明使用化学发光显色成像,检测目的蛋白变化。使用ImageJ 软件对蛋白条带灰度进行半定量,并使用GraphPad Prism 8.0 软件进行统计学分析和绘图。
4 统计学处理
所有体外实验均进行了3 次及以上独立重复实验,代表性结果显示在图中。使用GraphPad Prism 8.0 软件进行统计学分析。两组之间比较采用t检验。多组资料(>2)之间的比较采用单因素方差分析(one-way ANOVA),方差齐性检验不齐时,选择Brown-Forsythe检验和Welch检验;满足方差齐性,则选择方差分析(ordinary ANOVA 分析)。药物协同指数计算采用使用SynergyFinder(https://synergyfinder.fimm.fi)选用ZIP 模型[13]。计量数据均采用均数±标准差(mean±SD)表示。以P<0.05表示差异有统计学意义。
结 果
1 泽布替尼和pracinostat 可抑制NU-DUL-1 细胞和SU-DHL-6细胞增殖
采用不同浓度的泽布替尼和pracinostat 分别处理NU-DUL-1 和SU-DHL-6 细胞24 h、48 h 和72 h 后,CellTiter-Glo 法检测结果显示,与空白对照组相比,泽布替尼和pracinostat 单药处理NU-DUL-1 和SUDHL-6 细胞后,能显著抑制细胞增殖,且呈时间和剂量依赖关系,见图1。通过GraphPad Prism 8.0 软件计算得到泽布替尼的IC50和pracinostat 的IC50,并以此作为后续实验浓度的参考,见表1。

表1 泽布替尼和pracinostat的IC50Table 1.The IC50 of zanubrutinib and pracinostat

Figure1.Inhibitory rates of the proliferation of NU-DUL-1 and SU-DHL-6 cells after treated with different concentrations of zanubrutinib (A) and pracinostat (B) for 24, 48 and 72 h were detected by CellTiter-Glo luminescent cell viability assay.图1 CellTiter-Glo法检测不同浓度泽布替尼和pracinostat处理24、48和72 h对NU-DUL-1和SU-DHL-6细胞增殖的影响
2 泽布替尼联合pracinostat具有协同抗肿瘤作用
采用不同浓度的泽布替尼与pracinostat 单药或联合使用处理NU-DUL-1 和SU-DHL-6 细胞48 h 后,使用SynergyFinder(https://synergyfinder.fimm.fi)选用ZIP 模型[13]计算出联合用药的协同指数,大于10,表示两种药物之间的相互作用为协同效应。根据图2 显示,泽布替尼和pracinostat 的联合使用对弥漫性大B 细胞瘤细胞NU-DUL-1 和SU-DHL-6 具有很强的协同抗肿瘤效应。
计算各组细胞的抑制率,我们发现,两药联合使用对细胞增殖的抑制也存在剂量依赖性,图2A 中每个色块内的数字代表对应浓度的两药联合后对细胞增殖的抑制率,色块的饱和度越高代表抑制率越大。在同一浓度的泽布替尼,随着联合使用的pracinostat浓度的增加,细胞抑制率随之增大;反之亦然。根据柱状图显示,联合组的细胞增殖率明显低于单药组,差异有统计学意义(P<0.05),见图2B。
3 泽布替尼联合pracinostat 促进弥漫性大B 细胞淋巴瘤细胞NU-DUL-1和SU-DHL-6细胞凋亡
Annexin V-APC/7-AAD 流式细胞术检测结果显示,NU-DUL-1 细胞中,空白对照组凋亡细胞占比为(8.84±1.47)%,泽 布 替 尼 组 凋 亡 细 胞 占 比 为(37.30±2.50)%,pracinostat 组 凋 亡 细 胞 占 比 为(37.53±2.80)%,联合 用药 组凋亡 细胞 占 比为(88.63±2.45)%;SU-DHL-6 细胞中,空白对照组凋亡细胞占比为(8.63±2.95)%,泽布替尼组凋亡细胞占比为(35.70±4.50)%,pracinostat 组凋亡细胞占比为(32.30±3.05)%,联合用药组凋亡细胞占比为(68.33±3.00)%。联合用药组与空白对照组和单药组相比,凋亡细胞比例的差异均有统计学意义(P<0.05)。见图3。
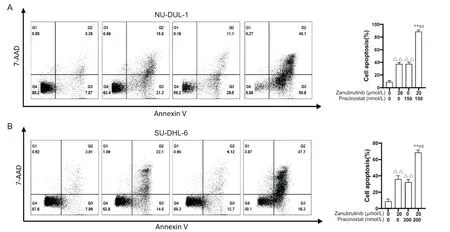
Figure 3.Cell death rates of NU-DUL-1 (A) and SU-DHL-6 (B) cells induced by combination of zanubrutinib and pracinostat.Mean±SD.n=3.△△P<0.01 vs control (without treatment); **P<0.01 vs zanubrutinib alone; ##P<0.01 vs pracinostat alone.图3 泽布替尼联合pracinostat诱导NU-DUL-1和SU-DHL-6的细胞死亡率
4 泽布替尼联合pracinostat 通过上调凋亡蛋白PARP1 和caspase-3/8 剪切诱导弥漫性大B 细胞淋巴瘤细胞NU-DUL-1和SU-DHL-6细胞凋亡
Western blot结果显示,在NU-DUL-1和SU-DHL-6细胞中,与对照组及单药组相比,联合组的caspase-3、caspase-8和PARP1的表达量降低,而剪切增多,即cleaved caspase-3、cleaved caspase-8和cleaved PARP1表达量增多;其灰度值统计结果表明,在NU-DUL-1及SU-SHL-6 细胞中,联合组与单药组相比,cleaved caspase-3、cleaved caspase-8 和cleaved PARP1 表达量增多(P<0.01),见图4。上述结果说明,联合用药可以更大程度地激活caspase-3 和caspase-8,促进PARP1 剪切,从而诱导弥漫性大B 细胞淋巴瘤细胞NU-DUL-1和SU-DHL-6发生凋亡。

Figure 4.Protein expression levels of PARP1, cleaved PARP1, caspase-3, cleaved caspase-3, caspase-8 and cleaved caspase-8 in NU-DUL-1 (A) and SU-DHL-6 (B) cells were determined by Western blot.Mean±SD.n=3.△△P<0.01 vs control (without treatment); **P<0.01 vs zanubrutinib (10 µmol/L) alone; ##P<0.01 vs pracinostat (20 µmol/L) alone.图4 Western blot 检测NU-DUL-1 和SU-DHL-6 细胞中PARP1、cleaved PARP1、caspase-3、cleaved caspase-3、caspase-8 和cleaved caspase-8蛋白水平
讨 论
BTK是包括DLBCL的ABC亚型在内的B细胞恶性肿瘤发病机制的关键分子之一[7,14-15],目前研究者已开发了许多针对该靶点的抑制剂。泽布替尼是一种新型口服BTK抑制剂,与其他BTK抑制剂一样,在BTK的三磷酸腺苷结合口袋内的Cys481处形成不可逆共价键。泽布替尼已被批准用于治疗复发/难治性慢性淋巴细胞白血病和套细胞淋巴瘤,与Ibrutinib相比,它对其他酪氨酸激酶(如EGFR、JAK3、TEC、ITK 等)的脱靶抑制更少[16-17],具有更好的反应和更少的毒性,特别是心血管毒性[18-19]。然而,泽布替尼单药疗效有限,与其他靶向药物联合可取得更好疗效。
异常HDAC表达发生在血液系统肿瘤中,包括B细胞淋巴瘤[20]。已经有充分的研究证明,组蛋白乙酰化是由组蛋白乙酰转移酶和HDAC 调节,通过调节基因转录、染色质重塑和核结构从而在肿瘤的发生和进展中起关键作用[21-23]。组蛋白乙酰化的失调可导致异常基因表达,从而激活癌基因,灭活肿瘤抑制因子,抑制程序性细胞死亡并介导免疫逃避,最终导致肿瘤进展[24]。已有临床病例报告表明,HDAC和BTK 双重抑制在CD19 靶向CAR-T 治疗失败后的弥漫性大B 细胞淋巴瘤患者中有效[10]。1、2 期临床试验显示,pracinostat联合阿扎胞苷治疗AML以及骨髓增生异常综合征良好的疗效及安全性[25-26]。西达本胺和伊布替尼联合治疗在原发性难治性DLBCL患者中取得完全缓解[26]。然而,协同机制背后的机制仍不清楚。因此,探索泽布替尼与pracinostat是否具有协同效应及其内在机制是我们研究的重点。
本研究表明,HDAC 抑制剂pracinostat 和BTK 抑制剂泽布替尼在体外可抑制弥漫性大B 细胞淋巴瘤细胞株NU-DUL-1(ABC 型)和SU-DHL-6(GCB 型)的增殖,且有浓度和时间依赖性。在泽布替尼和pracinostat联合使用刺激DLBCL细胞时,计算出两药物在NU-DUL-1 和SU-DHL-6 细胞的协同指数分别为19.553 和19.392,均大于10,表明其联合效果显著。在此基础上,我们采用流式细胞术检测泽布替尼和pracinostat 的联合对NU-DUL-1 和SU-DHL-6 细胞凋亡的影响,发现联合组凋亡细胞比例较对照组和单药组明显增加。说明,联合用药具有明显的协同效应,并可诱导细胞凋亡发挥协同作用。
既往文献报道,在BTK 抑制剂的治疗中,GCBDLBCL患者的治疗反应较差,只有5%取得完全或部分缓解。在临床试验中发现,除BCR 依赖性途径的ABC-DLBCL 外,无BCR 突变的肿瘤也对伊布替尼的治疗具有不错的反应,因为67%的伊布替尼应答者具有野生型CD79A 和CD79B[9]。但是,我们发现ABC 和GCB 型的DLBCL 细胞在泽布替尼和pracinostat 联合使用时均存在协同效应,因此我们认为,pracinostat 的加入,可以提高非ABC-DLBCL 患者对泽布替尼治疗的反应。
HDAC 除了可降低组蛋白乙酰化,还有许多非组蛋白的底物,例如肿瘤抑制基因p53、B 细胞淋巴瘤蛋白6(B-cell lymphoma protein 6, BCL-6)、信号转导及转录激活因子3(signal transducer and activator of transcription 3, STAT3)、热 休 克 蛋 白90(heat shock protein, HSP90)、核因子κB(nuclear factor-κB,NF-κB)、输入蛋白、核激素受体等[27]。因此,HDAC抑制剂可以通过作用于组蛋白和非组蛋白底物,阻断基因表达、抑制肿瘤细胞的生长和调节细胞功能[28-29],并参与细胞周期的调节、细胞生长的抑制、细胞凋亡和血管生成[30-33]。相关文献报道,HDAC 抑制剂可以通过沉默BTK 靶向的microRNA 表达,导致BTK 途径的信号传导降低并最终诱导细胞凋亡[34]。除此之外,研究表明髓样分化因子88 (myeloid differentiation primary response gene 88,MYD88)去乙酰化可导致细胞周期停滞和细胞凋亡[35]。Caspase 家族属于半胱氨酸蛋白酶,与细胞凋亡密切相关。Caspase 8 作为促进凋亡启动的蛋白可以裂解caspase-3和caspase-7,从而激活它们[36]。PARP1 是DNA 修复酶,在caspase 依赖性凋亡过程中,PARP1 在其裂解位点被caspase-3和7裂解[37-38]。PARP 剪切被认为是细胞凋亡的一个重要指标,也通常被认为是caspase-3激活的指标。本实验证明泽布替尼与pracinostat联用可以促进凋亡启动蛋白caspase-8和凋亡执行蛋白caspase-3的表达,并且增加PARP1的剪切,诱导细胞凋亡。
综上所述,泽布替尼联合pracinostat 能够协同抑制DLBCL 的NU-DUL-1 细胞和SU-DHL-6 细胞生长,并通 过 激活caspase-3 和caspase-8,增 加PARP1 剪切,诱导细胞凋亡,从而发挥协同抗肿瘤效应。

