肺泡表面活性物质微创给药方式对早产儿呼吸窘迫综合征患儿血气指标及并发症发生率的影响*
束辉玲,丁晓燕,刘琦
(丹阳市妇幼保健院 儿科,江苏 丹阳 212300)
新生儿呼吸窘迫综合征是临床较为常见的儿科疾病,以早产儿最为常见,多由肺表面活性物质(pulmonary surfactant,PS)缺乏所致[1-2]。此外,由于早产儿的发育时间较短,体内脏器、器官等均未发育成熟,极易出现呼吸窘迫综合征等各种疾病,且发病后亦具有较高的病死率,因而该类患儿也是临床管理的重点对象[3]。据相关文献[4]报道,全球范围内每年呼吸窘迫综合征新发患儿高达140 万,而呼吸窘迫综合征发生后可使新生儿于出生72 h 内发生死亡,其病死率更是占所有早产儿死亡率的70%。现阶段PS 是呼吸窘迫综合征患儿最为有效的治疗方案,虽然临床常用的PS气管插管-使用肺表面活性物质-拔管使用持续呼吸道正压通气(intubation-surfactant-extubation,INSURE)给药技术能够避免机械通气,提高插管拔管成功率,但治疗期间易损伤患儿肺组织、气道[5-6]。微创肺表面活性物质给药(less invasive surfactant administration,LISA)技术主要是通过经鼻持续气道正压通气进行给药,且给药期间不需要使用肌松剂和镇静剂,注入PS 后即可快速拔管,LISA 不仅可有效满足局部用药,亦可避免因加压通气和气管插管造成的不良影响[7]。其作为一种侵袭性低且有效的PS 给药技术,现已逐渐受到越来越多的新生儿专家关注[8]。然而该项技术在我国普及不广,且相关报道也相对较少,基于此,本研究将其用于早产儿呼吸窘迫综合征患儿的临床治疗中,观察其对患儿血气指标及并发症发生率的影响,旨为早产儿呼吸窘迫综合征患儿的临床治疗方案制定提供参考。
1 资料与方法
1.1 一般资料
选择2019 年1 月至2022 年12 月在丹阳市妇幼保健院治疗的84 例早产儿呼吸窘迫综合征患儿为研究对象,采用数字随机表法将84 例患儿分为对照组(42 例)和试验组(42 例)。纳入标准:①胎龄范围28~30 周的患儿;②新生儿出生后存在进行性呼吸困难,通过X 线检测符合呼吸窘迫综合征标准[9]的患儿;③PS 给药治疗前未行气管插管的患儿;④需持续机械通气的患儿。排除标准:①伴有呼吸道畸形、肺功能发育不良、气管食管瘘等先天畸形的患儿;②行手术治疗的患儿;③存在严重感染或伴有慢性肺疾病的患儿;④治疗期间自行退出或转院治疗的患儿。对照组男24例,女18 例;平均胎龄(31.32±1.22)周;羊水异常者14 例;胎膜早破18 例;剖宫产25 例。试验组男25 例,女17 例;平均胎龄(31.14±1.28)周;羊水异常者15 例;胎膜早破20 例;剖宫产27 例。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究已通过丹阳市妇幼保健院伦理会批准同意。
1.2 方法
1.2.1 给药方法 ①给药时机:吸入氧浓度>30%;②PS 剂型及用法:200 mg/kg 的猪肺表面活性物质(厂家:意大利凯西制药公司),行10~15 min 复温,并采用5 mL 的注射器将其吸入备用;③试验组吸管型号:采用华润双鹤药业公司提供的CRPS-101 型1.67 mm 吸引导管。
1.2.2 给药过程 ①试验组:40 例患儿使用LISA管,2 例患儿使用5F 胃管。首先准备好已经复温且溶解后的PS,通过喉镜将LISA 管放置于患儿声门下1.5 cm 处,待LISA 管位置确认无误后,取出喉镜,将LISA 管直接固定于患儿上颚,弹丸式注射(bolus injection)注入70~100 mg/kg 的PS 液,总量需≤4 mL,给药期间需行气道正压通气辅助,配合患儿自主呼吸完成PS 弥散;拔出LISA 管,更改为经鼻持续气道正压通气调节患儿呼气末正压,并保持在6 cmH2O(1 cmH2O=0.098 kPa)。②对照组:所有受试患儿均根据其体重选择适宜的气管导管,完成PS 给药,拔出患儿气管插管,并给予气囊加压给氧1~2 min 行PS 弥散。两组患儿在整个治疗过程中均给予心率、脉搏血氧饱和度等监测。
1.3 观察指标
①分别于患儿给药前后监测动脉血气分析值,pH 值在7.35~7.45 间定义为正常,动脉血二氧化碳分压(PaCO2)值在35~45 mmHg(1 mmHg=0.133 kPa)为正常,动脉血氧分压(PaO2)值>50 mmHg 为正常[10];②分别于患儿给药前后检测氧化应激指标,采集患儿空腹静脉血3 mL,以3 000 r/min 的速度离心10 min,分离血清并将其置于-20℃的冰箱内保持待用。采用硫代巴比妥酸法检测丙二醛(micro malondialdehyde,MDA),采用分光光度计法检测超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px);③分别于患儿给药前后检测水通道蛋白(AQP),抽取2 mL 空腹静脉血置于采血管内,于4℃的环境下静置存放10 min,以3 500 r/min 的速度离心15 min,分离血清并将其置于-70℃的冰箱内保持待用。采用酶联免疫吸附法检测患儿水通道蛋白1(AQP-1)和水通道蛋白5(AQP-5)表达。④住院情况:记录患儿总氧疗时间、机械通气时间以及住院时间;⑤并发症:记录患儿气胸、坏死性小肠结肠炎(necrotizing enterocolitis,NEC)、支气管肺发育不良(bronchopulmonary dysplasia,BPD)以及颅内出血(intracerebral hemorrhage,ICH)等发生情况。
1.4 统计学方法
采用SPSS 21.0 软件进行统计学分析,符合正态分布计量资料用均数±标准差()表示,组间比较采用独立样本t检验,计数资料以百分率(%)表示,采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患儿动脉血气指标比较
治疗前,两组患儿PaO2、PaCO2、动脉血氧分压与吸入氧浓度之比(PaO2/FiO2)、pH 值等指标表达水平比较,差异无统计学意义(P>0.05);治疗后,两组患儿pH 值较治疗前差异无统计学意义(P>0.05);而PaO2、PaO2/FiO2指标表达水平较治疗前明显升高,PaCO2指标表达水平明显降低,且试验组PaO2、PaO2/FiO2指标表达水平高于对照组,PaCO2指标表达水低于对照组,差异有统计学意义(P<0.05)。见表1。
表1 两组患儿动脉血气指标比较(n=42,)

表1 两组患儿动脉血气指标比较(n=42,)
2.2 两组患儿氧化应激指标比较
治疗前,两组患儿GSH-Px、MDA、SOD、AQP-1、AQP-5 等指标表达水平比较,差异无统计学意义(P>0.05);治疗后,两组患儿GSH-Px、SOD 等指标表达水平较治疗前明显升高,而MDA、AQP-1、AQP-5 等指标表达水平较治疗前明显降低,且试验组GSH-Px、SOD 等指标表达水平高于对照组,MDA、AQP-1、AQP-5 等指标表达水平低于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组患儿氧化应激指标比较(n=42,)
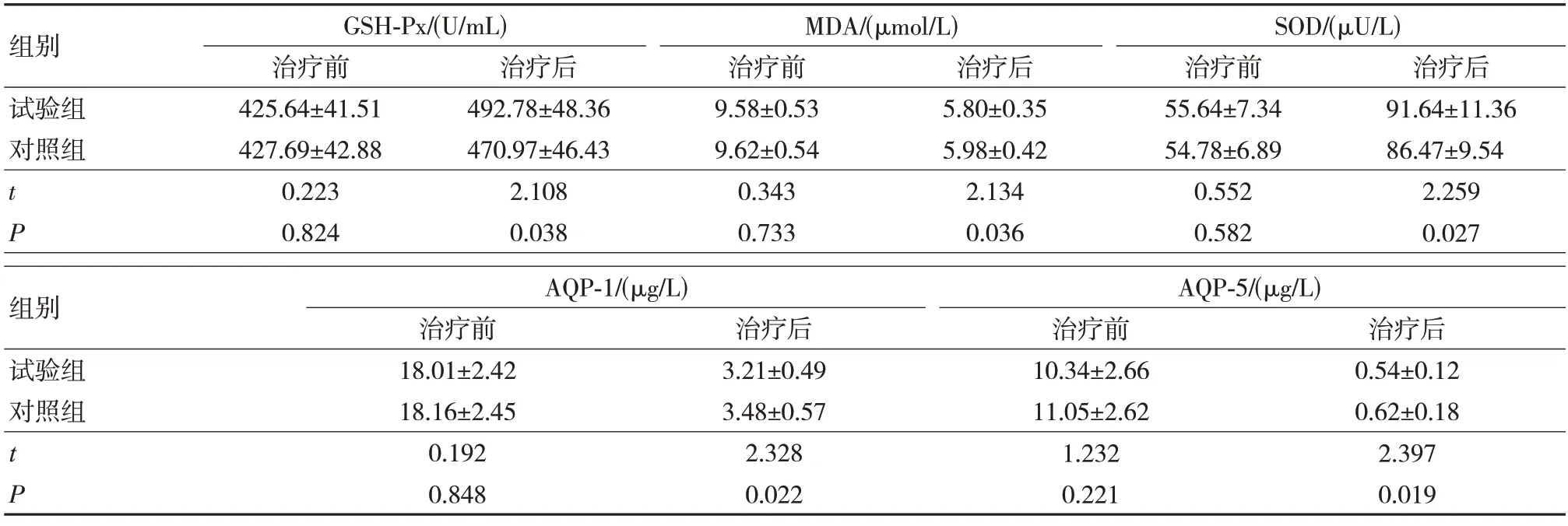
表2 两组患儿氧化应激指标比较(n=42,)
2.3 两组患儿治疗情况比较
试验组患儿总氧疗时间、机械通气时间以及住院时间明显短于对照组,差异有统计学意义(P<0.05)。见表3。
表3 两组患儿治疗情况比较(n=42,)

表3 两组患儿治疗情况比较(n=42,)
2.4 两组患儿并发症发生率比较
试验组患儿NEC 发生率稍高于对照组,而气胸、BPD、ICH 等发生率稍低于对照组,但组间比较,差异无统计学意义(P>0.05)。见表4。

表4 两组患儿并发症发生率比较 [n=42,n(%)]
3 讨论
呼吸窘迫综合征是新生儿存活的关键因素之一,且与神经系统和系统疾病密切相关[11]。呼吸窘迫综合征的主要病因为肺表面活性物质不足,促使肺部发育不成熟,导致患儿肺泡萎缩,体内通气量下降,诱发二氧化碳沉积,继而亦可出现低氧血症[12-13]。正常情况下新生儿气管较为狭窄,阻力相对较大,加以纤毛运动差、肌肉组织以及弹力纤维尚未发育成熟,极易发生呼吸困难,其中尤以早产儿最为明显[14]。酸中毒、缺氧可损害肺血管内皮和肺泡上皮细胞,肺血管通透性增加,损及患儿肺间质致使肺泡水肿,促使肺表面活性物质的产生与释放减少,氧合功能下降,肺部功能损伤[15]。呼吸窘迫综合征患儿多以早产儿为主,加以患儿妊娠周期不足,若未及时治疗极易出现一系列严重并发症,危及患儿生命。因而针对该类患儿来说,及时有效的治疗方案尤为重要[16-17]。既往研究[18]表明,呼吸窘迫综合征发生期间所产的蛋白质可抑制PS 的合成与释放,且该种状态亦具有竞争性和可逆性,当体内PS 含量上升时,这种蛋白质所发挥的作用会随之下降。PS 除了具有保护肺泡功能和肺泡结构外,其含有的蛋白质亦有免疫调节等作用,通过补充外源性PS 具有增强免疫功能、提高抗感染等作用[19]。然而临床常用的传统机械通气是一种有创操作,给药过程中的高氧通气或高压力易损患儿肺组织,继而可增加患儿出现脑损伤、支气管肺发育不良等并发症发生风险,不利于患儿治疗。
INSURE 技术是现阶段于临床应用较为广泛的新型技术,通过INSURE 行气管插管向患儿下部气管内注入PS,可达至肺泡表面,同时亦可有效避免机械通气,有助于促进气体交换量和肺泡表面张力的同时,还能保护早产儿的气道完整性,通过适量补充PS 后,可扩张患儿肺泡,经鼻发挥正压通气可增加肺压,提高肺腔气体容量,改善患儿的呼吸循环系统,降低相关并发症发生率,提高治疗效果[20]。但部分患儿在应用INSURE 技术给药时治疗效果尚未达到预期,需再次进行机械通气。因而,寻找一种安全有效的给药方式就显得尤为重要。而LISA 技术是一种创新的肺表面活性物质运用技术,在喉部的可视情况下,通过LISA 导管给药,且在给药过程中行辅助通气,同时也不需要注入肌松剂和镇静剂,完成PS 给药后即可即刻拔管,对患儿肺部顺应性的效果较好[21]。本研究将INSURE 和LISA 技术分别用于42 例早产儿呼吸窘迫综合征患儿中发现,治疗后,两组患儿PaO2、PaO2/FiO2指标表达水平较治疗前明显升高,PaCO2指标表达水平明显降低,且试验组PaO2、PaO2/FiO2指标表达水平高于对照组,PaCO2指标表达水平低于对照组(P<0.05)。提示,LISA在早产儿呼吸窘迫综合征患儿中对患儿动脉血气指标的改善效果优于INSURE 技术。分析原因可能为,LISA 给药期间,持续气道正压通气可有效维持患儿呼气末正压,确保肺泡不会出现塌陷、肺泡内可有效换气,继而改善了CO2和氧合排出。此外,在操作期间,患儿自主呼吸未因LISA 技术而被打断,患儿自主呼吸也有助于CO2排出。而INSURE 给药期间,给予了气管插管,并于PS 气管内滴注后行球囊加压给氧,继而影响了自主呼吸的同时,气管插管和球囊也不利于CO2排出,虽然给药过程仅持续数分钟,但该过程可能是试验组患儿动脉血气指标得以有效改善的关键因素。
MDA 是临床常用于评估机体组织氧自由基受损可靠指标;SOD 属于一种抗氧化酶,其可有效消除超氧阴离子,缓解氧自由基对身体产生的危害;GSH-Px 可有效清除过氧化脂质,抑制自由基生成,保护组织细胞膜功能及细胞膜结构[22]。本研究结果显示,治疗后,试验组患儿GSH-Px、SOD 高于对照组,MDA 低于对照组。提示,通过LISA 技术给药可有效减少早产儿呼吸窘迫综合征患儿的机体氧化应激情况。相关研究[23]表明,肺微血管通透性增加所致的肺水肿是呼吸窘迫综合征发生的重要病理特征。水通道蛋白(AQPs)可增加细胞膜水通透力,继而为组织细胞提供液体转运途径,其功能改变及含量与呼吸窘迫综合征密切相关。AQP-1 多于肺毛细血管及肺泡上皮细胞内表达,其参与了与肺间质的液体转运,在毛细血管及肺泡结构完成的情况下,可有效缓解肺水肿;AQP-5 则参与肺泡腔内液体的调节及跨膜水分子转运。AQP-1 与AQP-5 二者对肺内液体清除尤为重要。本研究结果显示,试验组患儿AQP-1、AQP-5 明显低于对照组,表明LISA 技术给药在促进肺泡内液体吸收方面的效果更佳。此外,本研究结果显示,试验组患儿总氧疗时间、机械通气时间以及住院时间明显短于对照组,并发症发生率稍低于对照组,但组间比较差异无统计学意义。提示,LISA 技术应用效果确切,同时亦不会增加并发症发生率。
综上所述,LISA 技术给药方式在早产儿呼吸窘迫综合征患儿中可有效改善患儿动脉血气指标、氧化应激指标,缩短患儿住院时间,也不会增加并发症发生风险。此外,本研究为单中心研究,不具有代表性,因此相关结论还需在今后的研究中加以验证。

