滇西槽舌兰内生真菌多样性及其共生真菌对叠鞘石斛种子萌发的效应
李爱花, 王涛, 王苗苗, 邓军育, 刘佳, 亚吉东, 张毓
(1.国家植物园北园,植物迁地保护国家林业与草原局重点实验室,北京市花卉园艺工程技术研究中心,北京100093; 2.中国科学院昆明植物研究所中国西南野生生物种质资源库,昆明 650201)
兰科植物是被子植物的第二大科,由于生物多样性丧失、人类过度采集等原因,许多兰科植物生存状况受到威胁,是全球生物多样性保护的“旗舰”类群。植物内生真菌对植物的生长、适应性、进化及植物群落的结构和多样性产生影响[1-3]。多数兰科植物与真菌共生,其种子萌发和原球茎发育需要依赖共生真菌[4],且大多数兰科植物在成年阶段也会维持这种共生关系[5-6]。高度依赖于特异共生真菌的兰花,往往会因为其潜在生境的可用性和分布限制,导致物种濒危[7]。
滇西槽舌兰[Holcoglossum rupestre(Hand.-Mazz.) Garay]是中国特有物种,仅发现2~3 个居群,位于金沙江干热河谷地带高山栎树上。由于工程建设、全球气候变化、人为破坏等原因,滇西槽舌兰所依存的高山栎林正处在快速消失中,因此,目前滇西槽舌兰被评为极度濒危物种,并被列入国家极小种群植物名录(2002 版)。如果没有抢救性措施,滇西槽舌兰有可能成为长江流域灭绝的兰科植物[8]。因此,亟需对滇西槽舌兰及其生态环境开展保护性研究。了解滇西槽舌兰的内生真菌多样性及其与兰科植物的共生关系,可以为滇西槽舌兰的物种濒危原因提供理论参考,但相关研究较少。Tan等[9]对9个槽舌兰属物种进行了内生真菌的分离和鉴定,共鉴定得到46 株内生真菌,但是滇西槽舌兰中仅鉴定得到5株,且均为非共生真菌。因此,有必要对已知分布地及栽培地滇西槽舌兰的内生真菌进行分离和多样性分析,并进行功能鉴定,为滇西槽舌兰的保育及濒危机制研究奠定理论基础。
1 材料与方法
1.1 研究材料
2021年5—6月,从云南香格里拉、楚雄、昆明盘龙、昆明呈贡4 个生长地收集健康、新鲜、粗壮滇西槽舌兰植株的气生根3~7段,用湿纸巾包裹,放到干净的盒子内,快速运回实验室。
1.2 试剂及仪器
采用PDA 培养基对内生真菌进行培养。配置方法如下:PDA 培养基粉末46.0 g,加入到1.0 L超纯水中,于121 ℃高压蒸汽灭菌20 min,制备固体PDA 培养基。18S rDNA 扩增所用试剂均购自TaKaRa 公司;PCR Purification Kit 购自Promega 公司;PCR 仪为Biometra 公司生产的Tgradient;凝胶成像分析仪为Bio-Rad公司的Gel-Doc2000。
1.3 试验方法
1.3.1 滇西槽舌兰根部内生菌的分离 选用组织块分离法分离内生真菌,流程如下:首先用自来水冲洗干净根段,去除根表面泥土及附属物,用吸水纸吸干水分;然后将根切成2~3 cm 的小段,用75%乙醇消毒30 s,无菌水冲洗1 次,5%(质量体积分数)NaClO 消毒5 min,无菌水冲洗3 次,吸干水分;最后用无菌双面刀片将根段切成1~2 mm的薄片,放到PDA培养基中,每皿放置12小片,密封放置在25 ℃暗培养。及时观察培养皿中菌丝生长状态,待菌丝长出后用接种针挑取菌丝尖端转接到新的PDA 培养基中进一步纯化,待菌落无杂菌,生长均匀后,进行保藏和检测。
1.3.2 内生真菌的鉴定 分离的共生真菌分别进行形态学鉴定[10]和分子鉴定。通过光学显微镜(Olimpus CX31)观察内生真菌的菌丝形态,方法如下: 用透明胶带粘取少量菌丝,置于涂有10%(质量体积分数)KOH 的载玻片上,观察菌丝的直径、分枝、念珠状细胞、孢子、隔膜等特征。
采用通用菌类18S rDNA 鉴定方法[11]进行分子鉴定。样品DNA 提取、PCR 扩增及测序均由北京博友顺生物技术有限公司进行。引物为真菌通用引物组合ITS1/ITS4,由上海生工有限公司合成。PCR 体系包括:处理后的样品(20 ng·μL-1)模板2 μL,dNTP Mixture (2.5 mmol·L-1) 2.5 μL,引物(20 μmol·L-1)各1.5 μL,10×ExTaqBuffer (Mg2+plus ) 5 μL,Ex Taq 酶(5U·μL-1)0.2 μL,ddH2O 补足到50 μL。PCR 程序:94 ℃ 3 min;94 ℃ 1 min,55 ℃ 1 min,72 ℃ 2 min,30 个循环;72 ℃ 5 min。PCR 产物经1.5%(质量体积分数)琼脂糖检测后,回收目的条带,纯化后,用扩增引物进行双向测序。获得的序列在GenBank 中进行BLAST 比对,查找相似性最高的序列信息,并结合菌株的形态学特征,以确定真菌种类。当所测菌株的ITS 序列与NCBI库中片段相似性大于99%,则认为是同一物种;所测菌株ITS 序列与NCBI 库中片段相似性大于95%,则认为是同一属的物种;相似性小于95%,认为是未鉴定物种[12]。
1.3.3 胶膜菌对叠鞘石斛种子共生萌发的作用胶膜菌菌株P2、P24、P35、P47 用无菌打孔器打成直径5 mm左右的圆片;将约八成成熟的叠鞘石斛果实灭菌后,接种到放有纤维网的固体燕麦培养基上,将菌株圆片放到播种的燕麦培养基上,每皿放4 块;同时设置1 个阴性处理(仅燕麦培养基),1 个阳性对照(1/2MS 固体培养基)。每个处理重复5次。
1.4 数据统计与分析
通过Mega 11.0 软件利用Kimura2-parameter模型进行系统分析。使用NJ(neighbour-joining)法[13-14]构建系统树,Bootstrap 设置为500。用分离率(isolation frequency,IF)来衡量特定植物组织样品中内生真菌的丰度以及植物组织样品中多重侵染的频率[14];内生真菌的多样性通过香农多样性指数(H)表示,计算公式如下。
式中,i=1……k,k指滇西槽舌兰的第k个生长地,Pi指第i个生长地滇西槽舌兰内生真菌个体数占总个体数比例。
2 结果与分析
2.1 滇西槽舌兰根部内生真菌的分离
从滇西槽舌兰根部分离得到94 个菌落,香格里拉、楚雄、呈贡、盘龙分别获得22、12、8、52个(表1)。

表1 4个分布地/栽培地滇西槽舌兰根部内生真菌分离结果Table 1 Isolation results of fungal isolates from roots of Holcoglossum rupestre in 4 localities
2.2 滇西槽舌兰根部内生真菌的分子鉴定
分子鉴定结果(表2)显示,从滇西槽舌兰根部共鉴定内生真菌68 株,其中盘龙居群最多,为29 株;香格里拉和楚雄居群次之,分别为18 和12株;呈贡居群最少,为9株。68株内生真菌经初步分子生物学鉴定归属于18个属。 其中27.94%属于镰刀菌属(Fusarium);10.29%属于间座壳属(Diaporthe);8.82%属于胶膜菌属(Tulasnella);8.82%属于角担菌属(Ceratobasidium);8.82%属于交链孢属(Alternaria)(表2)。镰刀菌属真菌在楚雄和呈贡居群的可培养内生真菌中均占50%以上,在香格里拉和盘龙居群中的占比也较高;胶膜菌属真菌仅在盘龙居群分离得到,占比19.35%;角担菌属真菌仅在香格里拉居群分离得到,占比31.58%(图1)。
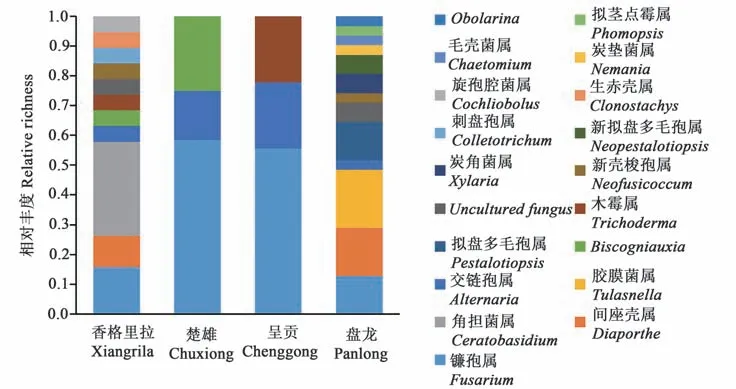
图1 不同地区滇西槽舌兰根部内生真菌的相对丰度Fig. 1 Relative abundance of cultured endomycetes in root of Holcolglossum repestre from different regions
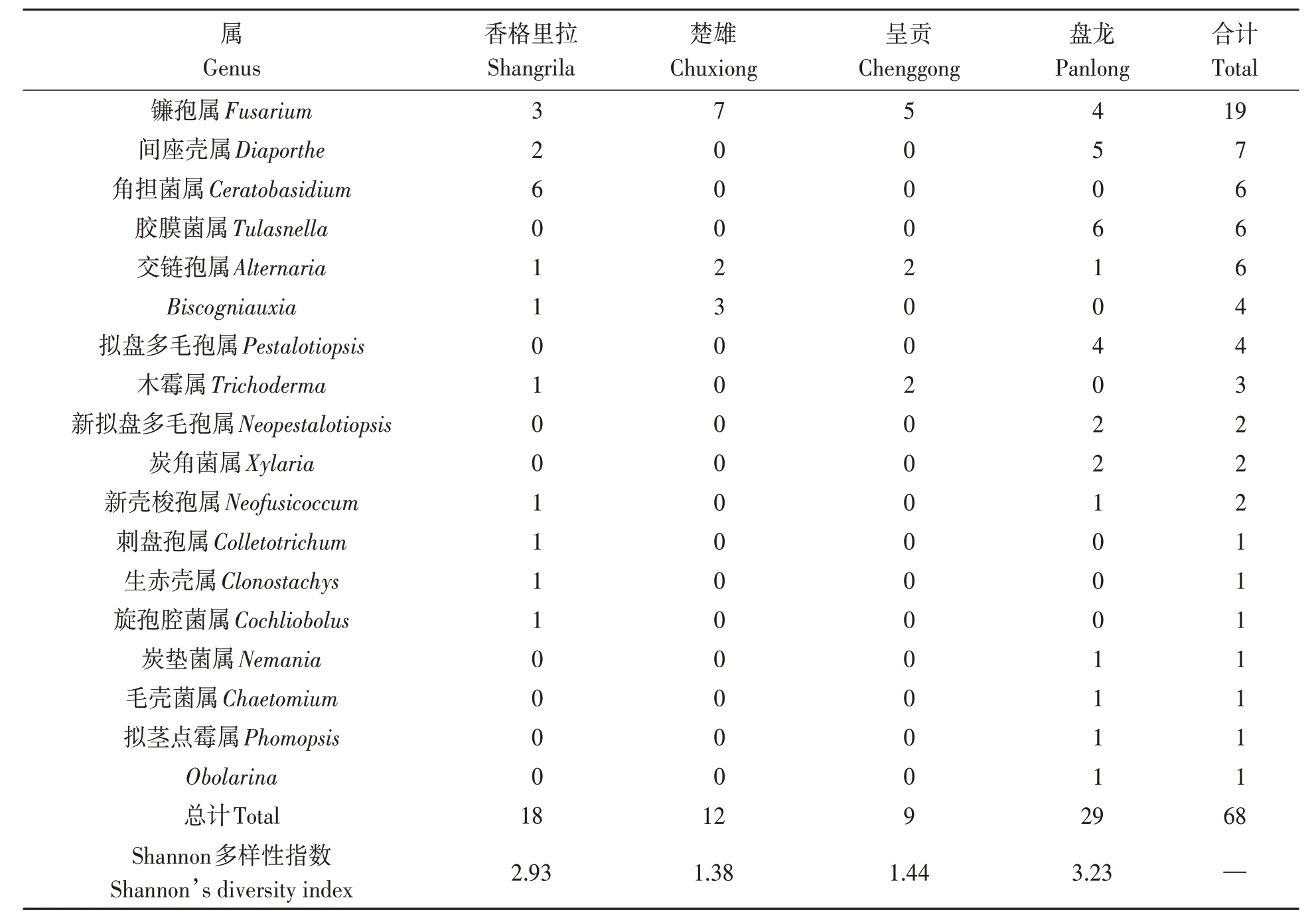
表2 不同地区滇西槽舌兰根部内生真菌的种类及数量Table 2 Fungal taxon and amount in roots of Holcoglossum rupestre from different regions
香格里拉和盘龙居群可培养内生真菌的Shannon 多样性指数较高,分别为2.93 和3.23,不同种群在不同属间分布较均匀;楚雄和盘龙居群的Shannon 多样性指数仅为1.38 和1.44,即分离的内生真菌种类少且分布不均匀,仅分布在3个属。
系统聚类分析(图2)表明,68 株内生真菌属于2 门、3 纲、8 目、12 科(图2)。其中有12 株内生真菌属于担子菌门(Basidiomycota);有56 株内生真菌属于子囊菌门(Ascomycota)。在纲水平,分 别 属 于 伞 菌 纲(Agaricomycetes)、座 囊 菌 纲(Dothideomycetes)和粪壳菌纲(Sordariomycetes)。属于伞菌纲的12 个菌株中,菌株P2、P21 与美孢胶膜菌(Tulasnella calospora)序列的一致性较高,菌株P24、P35、P12、P49 与胶膜菌属(Tulasnella)序列的一致性较高,因此将其鉴定为胶膜菌属;菌株D4、D5、D6、D10、D13、D19 与 角 担 菌 属(Ceratobasidium)具有较高的相似性,因此将其鉴定为角担菌属真菌,这些菌株聚为1 支,属于鸡油菌目(Cantharellales)。
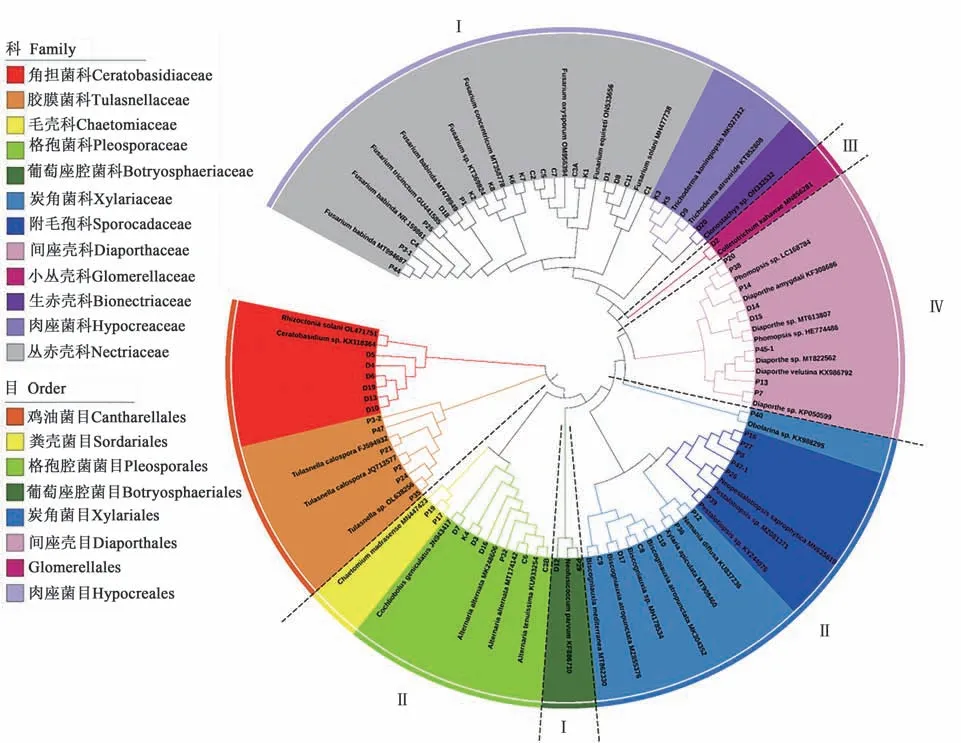
图2 滇西槽舌兰根部内生真菌的系统聚类树Fig. 2 Phylogenetic tree of cultured endomycetes in root of Holcolglossum rupestre
在属于粪壳菌纲的47 株内生菌中,除毛壳菌属(Chaetomium)的菌株P17、P19 外,其他45 株内生菌被聚为4 个分支。其中,属于镰刀菌属、木霉属(Trichoderma)和生赤壳属(Clonostachys)的23个菌株被聚为1 支(Ⅰ),属于肉座菌目(Hypocreales);属于炭角菌属、Obolarina、炭垫菌属(Nemania)、Biscogniauxia、拟 盘 多 毛 孢 属(Pestalotiopsis) 和 新 拟 盘 多 毛 孢 属(Neopestalotiopsis)的13 个菌株被聚为1 支(Ⅱ),属于炭角菌目(Xylariales);菌株D2 单独聚为1 支(Ⅲ),它属于刺盘孢属(Colletotrichum)、小丛壳目(Glomerellales);属于间座壳属和拟茎点霉属(Phomopsis)的8 个菌株被聚为1 支(Ⅳ),属于间座壳目(Diaporthales)。
属于座囊菌纲的9 个菌株被聚为2 个分支。其中,菌株D12 和P29 被聚为1 支(Ⅰ),属于新壳梭孢属;属于交链孢属(Alternaria)和旋孢腔菌属(Cochliobolus)的7 个菌株及属于粪壳菌纲毛壳菌属的P17、P19被聚在1支(Ⅱ)。
2.3 叠鞘石斛种子共生萌发的效应
胶膜菌P2 与叠鞘石斛种子的共生萌发试验显示, P2 对叠鞘石斛种子萌发有促进作用,即共生菌P2能够促进叠鞘石斛种子萌发(图3)。萌发60 d后,对照种子全部处于萌发第1阶段(图3C);与胶膜菌P2 共生的叠鞘石斛种子已长出生长点(图3D),处于典型附生兰种子萌发的第3阶段[15];1/2MS 培养基上萌发的叠鞘石斛部分原球茎也长出生长点,但仍有少量种子仅吸水膨大,处于萌发的第1 阶段(图3E)。与P2 共生菌共生萌发处理的种子86.16%处于种子萌发第2 阶段,13.84%处于种子萌发第3阶段;对照大部分种子萌发至第2阶段(84.09%),仍有15.01%种子胚处于第1 阶段(图3F)。综上所述,胶膜菌菌株P2对叠鞘石斛种子萌发有显著促进作用。
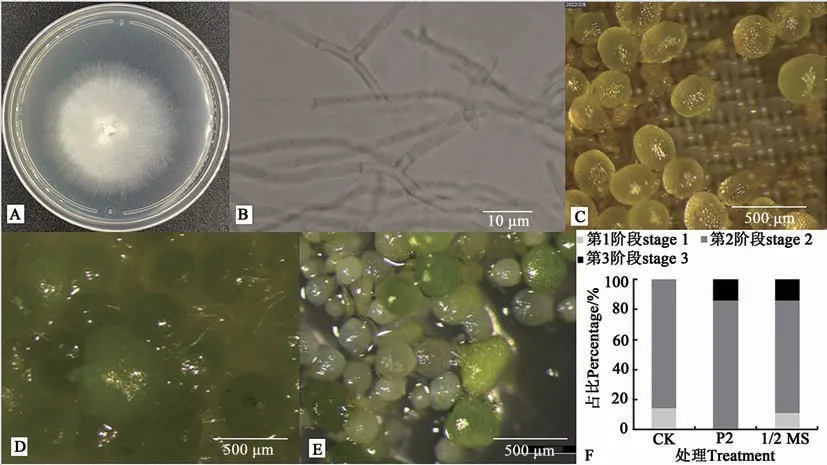
图3 胶膜菌菌株P2与叠鞘石斛种子的共生萌发Fig. 3 Myco-germination of Dendrobium denneanum with mycorrhiza fungus P2
3 讨论
本研究在4 个生长地的滇西槽舌兰根内均分离得到多种内生真菌,且不同生长地分离得到的内生真菌存在差异,镰刀菌属、间座壳属、胶膜菌属、角担菌属、链格孢属是占比较高的真菌类群;且不同分布地的内生真菌在属水平也存在差异。其中,角担菌属、刺盘孢属、生赤壳属和旋孢腔菌属为香格里拉居群的特有菌属;胶膜菌属、拟盘多毛孢属、新拟盘多毛孢属、炭角菌属、炭垫菌属、毛壳菌属、拟茎点霉属、Obolarina为盘龙居群的特有菌属;而楚雄和呈贡居群未检测到特有菌属。这可能与居群所在地(栽培地)的环境有关,同时与采样的广度和强度也有关[16]。
对滇西槽舌兰根部内生真菌进行ITS rDNA序列测定,鉴定其亲缘关系发现,在门水平分离菌株分别属于担子菌门和子囊菌门2 大类;在目水平属于鸡油菌目、肉座菌目、炭角菌目、粪壳菌目、葡萄座腔菌目、格孢腔菌目、Glomerellales、间座壳目8 个目,这几个目也是热带、亚热带附生兰常见的内生真菌类群[11];在属水平,间座壳属、角担菌属、Biscogniauxia、拟盘多毛孢属、木霉属、新拟盘多毛孢属、炭角菌属、新壳梭孢属、旋孢腔菌属、炭垫菌属、毛壳菌属、Obolarina等内生菌属,均为槽舌兰属植物首次报道的内生真菌类群。其中,兰科典型的共生真菌胶膜菌属、角担菌属为首次在滇西槽舌兰中分离得到,且角担菌属还是首次在槽舌兰属植物中分离得到。胶膜菌属中的无性态瘤菌根菌属(Epulorhiza)曾 在 短 距 槽 舌 兰(Holcoglossum flavescens)、舌唇槽舌兰(Holcoglossum subulifolium)、维西槽舌兰(Holcoglossum weixiense)、中华槽舌兰(Holcoglossum sinicum)中分离得到[9]。
Tan 等[9]在9 个槽舌兰属物种中分离得到16个属的内生真菌,其中赤壳属(Cosmospora)、枝孢属(Cladosporium)、拟隐孢壳属(Cryptosporiopsis)、亚格孢壳属(Didymella)、小球腔菌属(Leptosphaeria)、蚁霉属(Myrmecridium)、拟盾壳霉属(Paraconiothyrium)、须壳孢属(Pyrenochaeta)、Stephanonectria在本研究中未检测到;而本研究分离得到的间座壳属、角担菌属、拟盘多毛孢属、木霉属、新拟盘多毛孢属、炭角菌属、新壳梭孢属、旋孢腔菌属、炭垫菌属、毛壳菌属、Obolarina共12个属的内生真菌在Tan 等[9]的研究中未检测到。说明槽舌兰属植物的内生真菌具有较高的物种多样性,且已分离得到的内生真菌与宿主间的专一性较低。
研究表明,植物组织状态、水分、碳氮营养条件等均影响兰科植物根际真菌多样性[17-19]。本研究在香格里拉居群分离得到镰孢菌属、间座壳属、角担菌属等共10个属的菌株,而Tan等[9]于2011年在该地采集的滇西槽舌兰中仅分离得到4 个菌属。其中,仅镰刀菌属是2 个研究中都分离到的菌属,且本研究中该居群分离得到较多前人未报道的菌株类群,包括兰科典型的共生真菌角担菌属。这可能是因为兰科植物内生真菌的多样性会随生长季节的变化而变化,从而满足植株生长发育的营养需求[20]。
Jacquemyn 等[21]认为,亲缘关系较近的兰科物种中的共生真菌相似性较高,即兰科植物与共生真菌间存在一定的专一性。附生兰大多与胶膜菌科、角担菌科、腊壳菌科等担子菌门的真菌类群有较强的专一性[22-24]。在香格里拉的滇西槽舌兰居群分离得到角担菌属、盘龙居群分离得到胶膜菌属,这些是典型的兰科共生真菌类群,而在Tan等[9]研究的滇西槽舌兰中未分离到这类菌群。由此可见,滇西槽舌兰内可培养共生真菌在属水平上具有较低的物种专一性,这可能是由于兰科根部共生真菌对生境具有较高敏感性,进一步表明光合自养型兰科植物具有较低的内生真菌专一性[21]。
胶膜菌是典型的兰科植物共生真菌,它们可显著促进兰科植物种子萌发和幼苗生长[25-26];分离自兜唇石斛(D. aphyllum)和硬叶兰(Cymbidium mannii)的内生真菌能够促进齿瓣石斛(D. devonianum)的种子萌发及圆球茎形成[27]。本研究发现,6 株胶膜菌中,有2 株(P2、P47)能够显著促进叠鞘石斛种子萌发,缩短叠鞘石斛种子的萌发时间,增加种子萌发的一致性,与前人研究结果一致。这可能是因为这2 株共生菌能够提供叠鞘石斛种子萌发过程所需要的营养物质。滇西槽舌兰中分离的共生菌能够促进叠鞘石斛种子萌发,说明菌株P2 和P47 对宿主植物在种水平上不存在专一性,即宿主特异性较低,这在一定程度上支持Hadley[28]关于兰科植物与共生菌不存在专一性的观点。关于兰科植物与共生真菌之间的互作关系,一直以来是兰科植物的研究热点和争论焦点。本研究发现,滇西槽舌兰内生真菌的多样性较高,且内生真菌的宿主植物具有广泛性,由此表明,滇西槽舌兰与内生真菌间的共生关系存在广泛性。

