朝鲜淫羊藿真菌群落结构多样性与药用成分含量相关性研究
陈佳雯,刘捍宁,吴 媛,胡 星,庄 鑫,郭俊杰,肖井雷
长春中医药大学药学院,吉林长春 130117)
朝鲜淫羊藿为小檗科(Berberidaceae)淫羊藿属(EpimediumLinn.)多年生草本植物,植株高15~40 cm,大多生长在海拔400~1 500 m的林下或灌丛中。目前对朝鲜淫羊藿植物仅有少量相关研究,但已证实朝鲜淫羊藿中存在可产黄酮类成分的微生物[1],而药材质量除受产地和采收期等非生物因素影响外,微生物也是影响药材品质的因素之一,可见生物因素对朝鲜淫羊藿次生代谢产物的合成和积累具有一定的影响,因此深入开展朝鲜淫羊藿微生物群落组成相关研究,进一步分析微生物与活性成分之间的关系具有重要的意义。
根际土壤真菌也可产生一些对植物生长具有较大影响的植物激素,如吲哚乙酸[2]。有相关研究已表明根际土壤真菌对宿主植物次生代谢产物的合成和积累也具有一定积极的作用,如接种丛枝菌根真菌对牧豆树根中葫芦巴碱成分和黄花蒿中青蒿素和挥发油成分均有不同程度的提高[3-4],而在刺五加植物中,接种灭活后的角坦菌对刺五加苷E的合成和积累具有一定的促进作用[5]。植物内生真菌通过与植物长期的协同进化,可产生某些与宿主植物相似或相同的代谢物质,如生物碱、萜类、芳香类、多肽类、黄酮类等成分[6],如内生真菌Fusariumsp.可提高大戟的大戟素和大戟醇的含量,促进其萜类成分的合成[7]。目前,已从众多植物中分离得到相关微生物并进行相关试验研究证实其对植物生长具有一定积极的作用,如在菊花中分离得到球毛壳菌,可提高菊花植株的生物量和抗逆性[8];也有部分菌株可调控植物赤霉素、吲哚乙酸等内源性激素的分泌[9],同时也可自身产生植物激素[10]。有学者对刺五加[9]、古侧柏[11]的内生真菌研究发现,内生真菌可促进植物种子萌发。基于以上研究成果,推测被孢霉属的相对丰度在朝鲜淫羊藿生长初期相对丰度最高,对朝鲜淫羊藿药用成分的正向影响最显著;柱隔孢属为朝鲜淫羊藿的致病菌属,随着时间的推移相对丰度减少。为了验证这些假设,该研究采用Illumina MiSeq高通量测序技术,对吉林省临江市的朝鲜淫羊藿叶片中内生菌和根际微生物群落的多样性进行研究,分析潜在的核心微生物菌群,尤其是不同生长时期的差异菌群和相对丰度的变化,以期为朝鲜淫羊藿的仿生态栽培提供了科学依据,也为植物生长发育中根际和内生菌群落的复杂性分析提供了新思路。
1 材料与方法
1.1 试验材料采用“抖落取样法”于2020年5—7月在吉林省临江市地区采集朝鲜淫羊藿根际土壤(MT)和叶片内生真菌(MY),每个采集地选取5个采样点,共10个点5个时期(MY1、MY2、MY3、MY4、MY5、MT1、MT2、MT3、MT4、MT5),每隔15 d采样1次。
1.2 主要仪器与试剂见表1。

表1 仪器与试剂
1.3 试验方法
1.3.1高通量测序分析。
1.3.1.1DNA提取。根际土壤总DNA提取参照OMEGA试剂盒E.Z.N.ATMMag-Bind Soil DNA Kit说明书进行,采用2%琼脂糖凝胶电泳检测DNA完整性,并利用Qubit 3.0 DNA检测试剂盒检测纯度和浓度。
1.3.1.2PCR扩增。以根际土壤和叶片内生真菌总DNA为模板,共进行两轮PCR扩增。第一轮PCR反应体系:正反引物ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2R(5′-GCTGCGTTCTTCATCGATGC-3′)各1 μL,2×Hieff® Robust PCR Master Mix 15 μL,Template DNA 10~20 ng,补ddH2O至30 μL。PCR反应条件:94 ℃ 3 min;94 ℃ 30 s,45 ℃ 20 s,65 ℃ 30 s,5个循环;94 ℃ 20 s,55 ℃ 20 s,72 ℃ 30 s,20个循环;72 ℃ 5 min,10 ℃停止。第二轮PCR反应体系:正反引物TS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2R(5′-GCTGCGTTCTTCATCGATGC-3′)各1 μL,2×Hieff® Robust PCR Master Mix 15 μL,Template DNA 20~30 ng,补ddH2O至30 μL。PCR反应条件:95 ℃ 3 min;94 ℃ 20 s,55 ℃ 20 s,72 ℃ 30 s,5个循环;72 ℃ 5 min,10 ℃停止。扩增产物用2%琼脂糖凝胶电泳检测其片段大小,用DNA Clean Beads对DNA进行纯化,纯化产物用Qubit 3.0荧光定量仪进行浓度测定,之后进行Miseq测序。测序部分由生工生物工程(上海)股份有限公司完成。
1.3.2供试品溶液的制备。取全部过3号筛朝鲜淫羊藿粉末约0.2 g,精密称定,置具塞锥形瓶中,精密加入稀乙醇20 mL,称重,超声(500 W,40 kHz)处理1 h,再称量,用稀乙醇补足减失的量,摇匀,过滤,取续滤液即得。
1.3.3色谱条件。色谱柱为Inertsil® ODS-3(4.6 mm×250 mm,5 μm),流动相为乙腈(B)-水(A),梯度洗脱(0~37 min,24%B;37~47 min,24%~38%B;47~60 min,38%~24%B);流速1 mL/min;检测波长270 nm;柱温30 ℃;进样量10 μL。理论塔板数按淫羊藿苷峰计算不低于1 500[1-2]。
1.3.4线性关系考察。取对照品混合溶液2、4、6、8、10 μL注入仪器,按照“1.3.3”色谱条件进行测定,以进样量(X,μg)为横坐标、峰面积(Y)为纵坐标绘制标准曲线。标准曲线回归方程、决定系数(R2)和线性范围见表2。

表2 4个总黄酮醇苷类成分的回归方程
1.4 数据处理与分析使用Usearch 11.0.667 软件对有效序列按照97%相似性进行OTU聚类,再将每个OTU的代表序列真菌UNITE数据库进行比对,获得代表性序列在各分类水平的物种注释信息,多组间差异分析和制图则采用LefSe 1.1.0软件进行。两组间差异分析则采用STAMP 2.1.3软件进行分析和制图。使用Excel 2016和SPSS 21.0软件对试验数据进行统计,对样品组间的差异采用单因素方差检验分析。
2 结果与分析
2.1 根际土壤与叶片内生真菌类样品OTU聚类和物种注释通过对MT类5组样品高通量测序数据的质量进行质控过滤,共得到有效序列278 515条和4 915个OTU。由图1A可知,5组样品共有OTU数目674个,占全部OTU数目的13.71%;MT1、MT2、MT3、MT4和MT5样品特有OTU数目分别为310、297、145、447和475个。从门到属对5组样品所获得的OTU进行物种注释,除去未分类的,共得到16门57纲154目341科935属真菌。

图1 朝鲜淫羊藿不同生长阶段根际土壤(A)和叶片内生真菌(B)Pan/Core 曲线图Fig.1 A Pan/Core plot of the rhizosphere soil(A)and leaf endophyte fungi(B)at the different growth stages of Epimedium koreanum Nakai
通过对MY类5组样品高通量测序数据的质量进行质控过滤,共得到有效序列253 799条和2 934个OTU。由图1B可知,5组样品共有OTU数目96个,占全部OTU数目的3.27%;MY1、MY2、MY3、MY4和MY5样品特有OTU数目分别为217、104、165、384和548个。从门到属对5组样品所获得的OTU进行物种注释,除去未分类的,共得到12门47纲137目299科753属真菌。
2.2 根际土壤与叶片内生真菌类样品属水平物种组成分析MT 类样品属水平上的物种组成和相对丰度(平均相对丰度>1%)见图2A,除去未分类和其他,5组样品主要由蜡壳耳属(Sebacina)、被孢霉属(Mortierella)、棉革菌属(Tomentella)、粒块菌属(Discosia)和湿伞属(Hygrocybe)等菌属组成。其中蜡壳耳属、被孢霉属和棉革菌属为核心菌属。虽5个时期属水平物种组成具有相似部分,但所占比例受生长阶段不同影响较大,MT1和MT2时期被孢霉属为第一优势菌属,其次蜡壳耳属、湿伞属、Sistotrema、Paraphoma等菌属相对丰度也较高;而MT3和MT5时期蜡壳耳属为第一优势菌属,且该属在MT5时期占比高达64.08%,占有绝对优势,其次相对丰度较高的菌属有被孢霉属和棉革菌属等;MT4时期第一优势菌属为粒块菌属,其次为蜡壳耳属、Hydnobolites和Setoscypha等。其中MT1时期Paraphoma为该时期特有优势菌属,MT2时期特有优势菌属为Sistotrema,MT4时期特有优势菌属为粒块菌属和Setoscypha。被孢霉属和Paraphoma均为MT1时期相对丰度较高且随着生长阶段的加长而逐渐减少;蜡壳耳属随着生长阶段变化其相对丰度变化波动较大,相对丰度以MT5时期最高,高达64.08%;棉革菌属相对丰度则呈先增加后减少趋势,MT2时期占比最高,MT5时期最低。分析结果表明,朝鲜淫羊藿根际土壤真菌群落组成和占比与生长阶段密切相关。
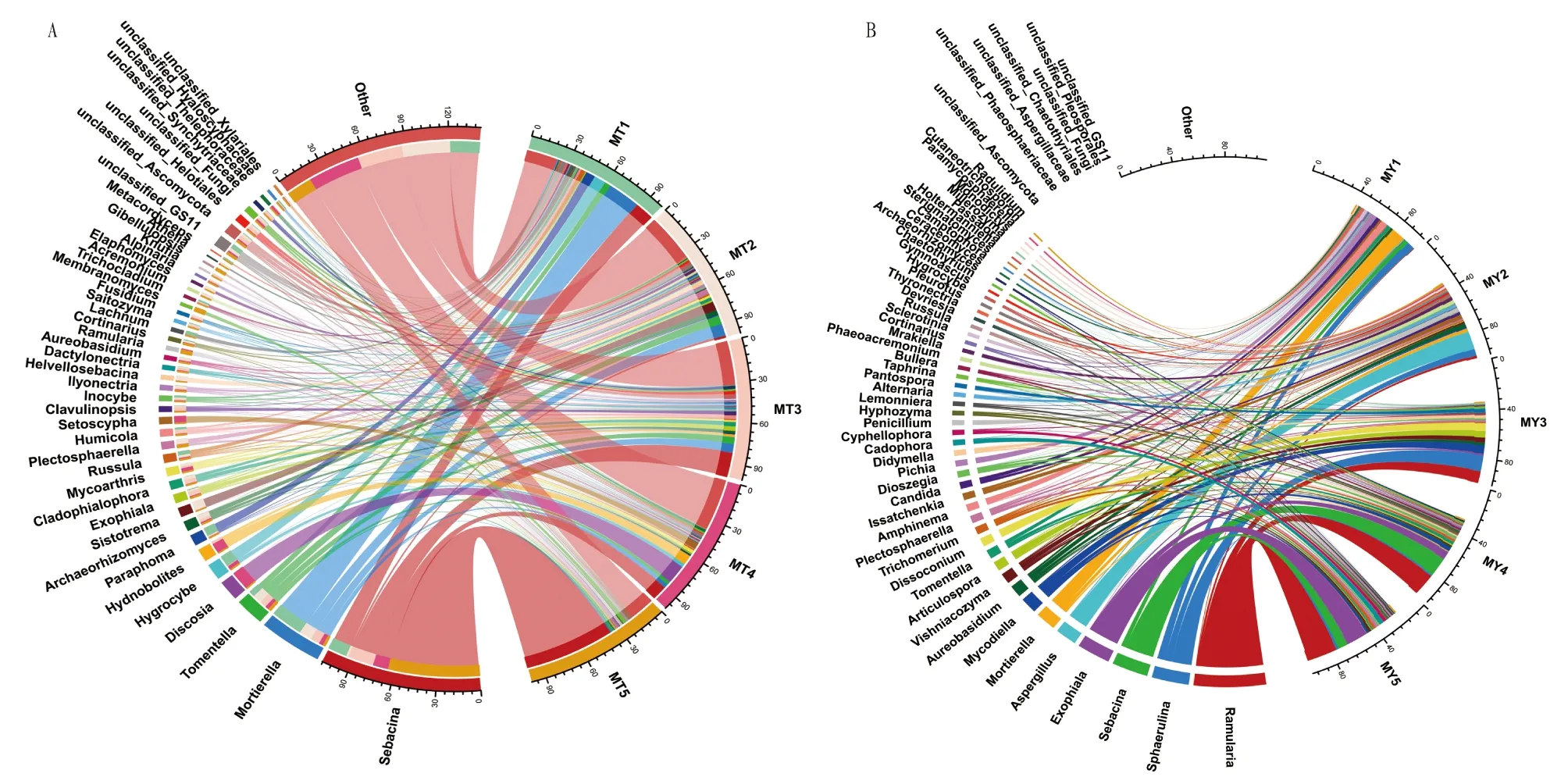
图2 不同生长时期朝鲜淫羊藿根际土壤(A)与叶片内生真菌(B)优势物种分布比例Fig.2 Distribution proportion of dominant species in rhizosphere soil(A)and leaf endophytic fungi(B)of Epimedium koreanum Nakai at different growth stages
MY类样品属水平上的物种组成和相对丰度(平均相对丰度>1%)见图2B,除去未分类和其他,主要由柱隔孢属(Ramularia)、亚球壳属(Sphaerulina)、蜡壳耳属(Sebacina)、外瓶柄霉属(Exophiala)、曲霉属(Aspergillus)、被孢霉属(Mortierella)等菌属组成,5组样品的核心菌属为亚球壳属。MY1时期被孢霉属(11.61%)为第一优势菌属,其次为亚球壳属(6.27%)、Amphinema(5.22%)等;MY2时期则曲霉属(15.22%)为第一优势菌属,其次为亚球壳属(5.60%)、短柄霉属Aureobasidium(3.80%)等;MY3时期亚球壳属(13.34%)为第一优势菌属,其次为柱隔孢属(9.78%)、Dissoconium(6.78%)、Mycodiella(6.72%)等菌属;MY4和MY5时期柱隔孢属为第一优势菌属,其次为蜡壳耳属、外瓶柄霉属等菌属。其中MY1时期Amphinema为该时期特有优势菌属,曲霉属为MY2时期特有优势菌属,Dissoconium和Articulospora为MY3时期特有优势菌属。
2.3 根际土壤与叶片内生真菌类样品组间差异分析由图3A可知,以LDA score>4为标准。MT1时期与其他时期具有显著差异的真菌群落主要为被孢霉属、湿伞属、红菇属等;MT2时期为Plectosphaerella、Archaeorhizomyces;MT3时期则为外瓶柄霉属、Cladophialophora;MT4时期为粒块菌属、Hydnobolites、Setoscypha等;MT5时期为蜡壳菌属、Membranomyces、柱隔孢属等。

图3 不同生长阶段朝鲜淫羊藿根际土壤真菌(A)和叶片内生真菌(B)组间菌属差异分析Fig.3 Analysis of the differences in fungal genera between the rhizosphere soil fungi(A)and leaf endophytic fungi(B)of Epimedium koreanum at different growth stages
由图3B可知,以LDA score>4为标准。MY1时期与其他时期具有显著差异的真菌群落主要为被孢霉属、Amphinema、棉革菌属;MY2时期为曲霉属、伊萨酵母属、短柄霉属;MY3时期则为Mycodiella、Articulospora等;MY4时期为蜡壳耳属、Dioszegia、Hyphozyma、Agaricomycetes等;MY5时期为柱隔孢属、外瓶柄霉属、Cyphellophora、Chaetothyriales等。
如图4所示,柱隔孢属在MY1~MY5时期随着生长阶段的加长,相对丰度逐渐增加。由图5可知,被孢霉属在MT1和MY1时期相对丰度最高。

图4 柱隔孢属的朝鲜淫羊藿不同生长阶段根际土壤真菌ANOVA方差分析Fig.4 Ramularia analysis of variance of ANOVA in rhizosphere soil at different growth stages of Epimedium koreanum Nakai

图5 被孢霉属的朝鲜淫羊藿不同生长阶段根际土壤真菌(A)和叶片内生真菌(B)ANOVA方差分析Fig.5 Mortierella analysis of variance of ANOVA in rhizosphere soil(A)and leaf endophytes(B)at different growth stages of Epimedium koreanum Nakai
2.4 根际土壤真菌、叶片内生真菌与黄酮类成分相关性分析各组样品黄酮类成分测定结果见表3。采用R 3.6.0软件对不同生长阶段朝鲜淫羊藿根际土壤真菌主要菌属与黄酮类成分进行相关性分析,结果表明(表4),被孢霉属与总黄酮和淫羊藿苷呈极显著正相关(P<0.01);Paraphoma与淫羊藿苷呈显著正相关(P<0.05);红菇属与总黄酮呈显著正相关(P<0.05);除上述菌属外,蜡壳耳属、粒块菌属、Hydnobolites、Archaeorhizomyces、Sistotrema、Cladophialophora、Mycoarthris、Setoscypha与黄酮类化学成分呈不同程度的负相关。
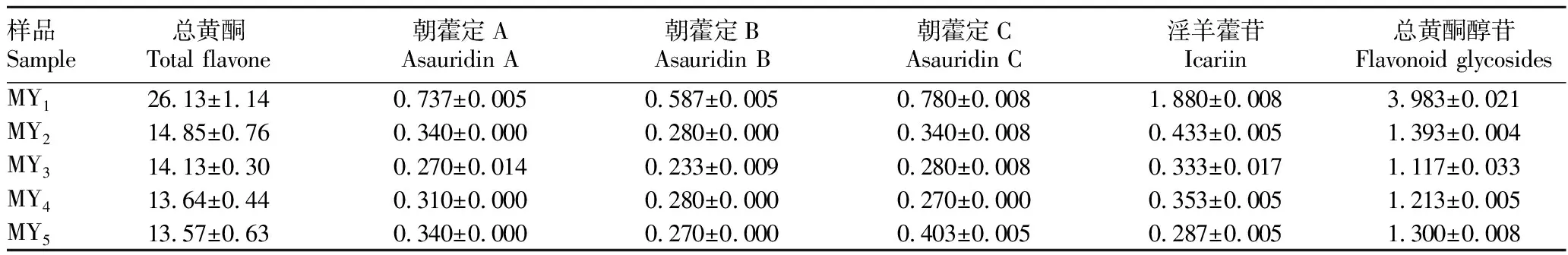
表3 各组样品黄酮类成分测定结果(n=3)
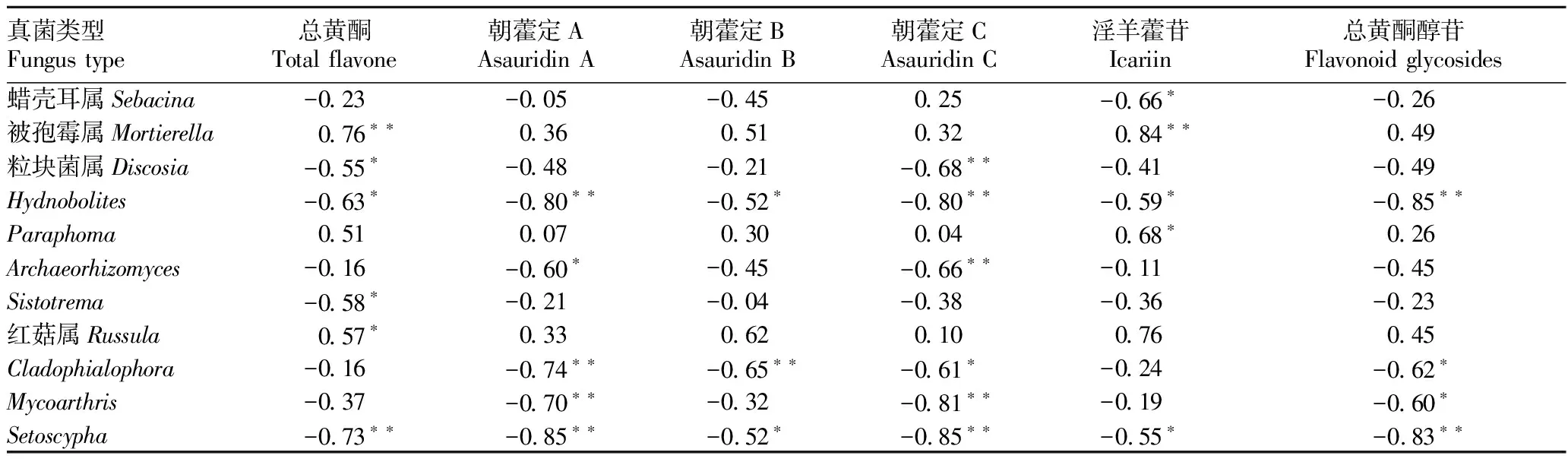
表4 不同生长阶段根际土壤真菌主要菌属与黄酮类成分相关系数
2.5 内生真菌与黄酮类成分相关性分析由表5可知,不同生长阶段朝鲜淫羊藿内生真菌中,被孢霉属与朝藿定A、朝藿定B和总黄酮醇苷呈极显著正相关(P<0.01),与淫羊藿苷呈显著正相关(P<0.05);曲霉属与总黄酮、朝藿定B和总黄酮醇苷呈显著正相关(P<0.05),与淫羊藿苷呈极显著正相关(P<0.01);Aureobasidium与总黄酮呈显著正相关(P<0.05);Amphinema与朝藿定A呈显著正相关(P<0.05),与朝藿定B呈极显著正相关(P<0.01);毕赤氏酵母属与总黄酮和淫羊藿苷呈极显著正相关(P<0.01);其他菌属与黄酮类成分呈不同程度的负相关。
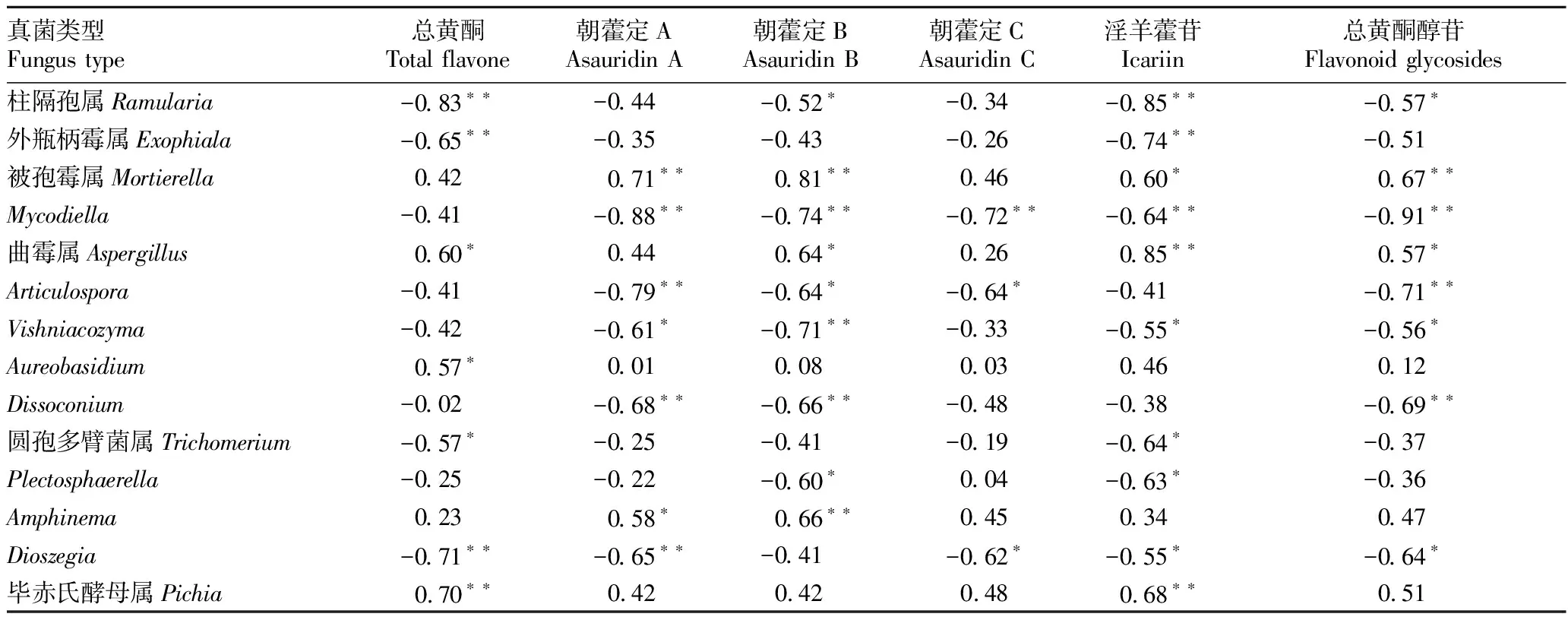
表5 不同生长阶段内生真菌主要菌属与黄酮类成分相关系数
3 讨论
在朝鲜淫羊藿不同生长阶段的根际土壤真菌研究中得出,柱隔孢属与黄酮类成分呈不同程度的负相关,且该菌属随着朝鲜淫羊藿生长阶段的加长,相对丰度逐渐升高。柱隔孢属作为一种季节晚期疾病的病原体,与宿主从营养阶段到生殖阶段的发育变化以及单果衰老期间宿主抗氧化系统的下降有关[12]。柱隔孢属的叶斑病是一个晚期疾病,最初作为一个内生菌,可以保持在无症状状态几周,但经过长时间的潜在发展,它可以开发成为一个积极的坏死性病原体[13]。朝鲜淫羊藿不同生长阶段的根际土壤真菌和叶片内生真菌与药用成分相关性分析表明,被孢霉属与黄酮类成分呈显著正相关(P<0.05)。被孢霉属真菌是一种重要的腐殖生物,生活在多种有机基质上,如土壤、植物碎片和动物粪便[14-16]。 相关研究表明被孢霉属(Mortierella)真菌具有良好的抗真菌、抗肿瘤活性,同时也可产生Brefeldin A代谢物质[17],推测出朝鲜淫羊藿植物中可能是有类似抗真菌菌株存在,抑制了部分植株体内的病原菌,促进了内在化学成分的合成。此外,红菇属、Amphinema、毕赤氏酵母属、曲霉属均不同程度地对朝鲜淫羊藿药用成分有正向作用。 红菇属可能具有复杂土壤有机质的分解能力[18-19],Amphinema可以提高宿主植物其他营养物质的水平和生长[20],毕赤氏酵母是一种很有前途的家禽益生菌[21],曲霉属是现阶段较为公认的具有促进生长作用的菌属之一[22]。这些研究为朝鲜淫羊藿生物肥料开发奠定了基础。
该研究初步显示了朝鲜淫羊藿不同生长阶段的真菌群落的丰富程度,对真菌群落和药用成分进行分析,得出根际土壤真菌和叶片内生真菌在朝鲜淫羊藿生长的不同时期起到了不同的生长代谢作用,对朝鲜淫羊藿的品质变化值得进一步探索。下一步工作重点从以下几个方面进行:①继续深入研究不同省份朝鲜淫羊藿的根际微生物和内生菌资源,探究其根际微生物和内生菌群地理分布规律,为深入探索药材道地性品质奠定基础;②分离朝鲜淫羊藿根际土壤和内生菌菌株,研究菌株对朝鲜淫羊藿的促生作用;③建立生物肥特性菌株筛选体系,评估其对朝鲜淫羊藿生长过程中生物量增加情况,筛选获得农业应用潜质的生防菌株。
4 结论
该研究检测不同生长时期的朝鲜淫羊藿样品,采用第二代高通量测序技术分析朝鲜淫羊藿根际土壤真菌和叶片内生真菌多样性;采用紫外-可见分光光度法和高效液相色谱法对药用成分进行测定。结果表明,朝鲜淫羊藿根际土壤真菌共得到有效序列278 515条和16门57纲154目341科935属真菌;叶片内生真菌共得到有效序列253 799和12门47纲137目299科753属真菌。柱隔孢属可能是阻碍朝鲜淫羊藿生长代谢的病原菌之一;被孢霉属对朝鲜淫羊藿黄酮类成分的正向影响最显著。

