循环肿瘤细胞与三阴性乳腺癌预后及肿瘤状态的关系分析
王 浩, 李南林, 曹海玲
(广东省广州市番禺区中心医院, 1. 病理科, 3. 甲状腺乳腺外科, 广东 广州, 510000;2. 中国人民解放军空军军医大学西京医院 甲乳外科, 陕西 西安, 710032)
乳腺癌(BC)是女性最常见的一种恶性肿瘤,且发病率呈逐年升高趋势[1]。BC包括不同的亚型,通常根据雌激素受体(ER)、孕激素受体(PR)以及人表皮生长因子受体2(HER2)的状态进行分类[2]。ER、PR、HER2均阴性表达的三阴性乳腺癌(TNBC), 由于具有疾病侵袭性高等特点且缺乏特异性治疗靶点,目前治疗难度较大[3]。原发性肿瘤样本可反映特定肿瘤类型的相关特征,也可明确最具侵袭性肿瘤细胞的分子复杂性。基于循环肿瘤细胞(CTC)的研究可提供疾病的全面信息及不同位置肿瘤的特征,帮助识别新的生物标志物和治疗靶点,进而改善癌症患者预后[4]。不同阶段TNBC患者的外周血中均存在CTC[5], CTC簇在TNBC患者中常见且与不良预后相关[6]。除了CTC对TNBC患者的预后价值之外, CTC的表型和分子特征还可以用于实时液体活检。AGELAKI S等[7]发现,早期TNBC患者CTC表型具有异质性,而HER2阳性(HER2+)在疾病演变过程中一直存在。CTC在肿瘤细胞转移过程中发生变化,这些变化主要与上皮间充质转化(EMT)过程、上皮标记物表达减少和可塑性、侵袭性增加有关,可使肿瘤细胞更能抵抗细胞衰老和死亡,从而影响肿瘤的治疗和预后[8]。本研究从32例Ⅲ~Ⅳ期TNBC患者外周血中分离出CTC, 用与癌症侵袭性和细胞可塑性相关的基因进行表征,以期确定新的生物标志物和治疗靶点,为TNBC患者的治疗方案制订和预后监测提供参考依据。
1 对象与方法
1.1 研究对象
选取广州市番禺区中心医院2014—2017年收治的32例TNBC患者作为研究对象。纳入标准: ① 病理诊断符合《中国抗癌协会乳腺癌诊治指南与规范(2015版)》中的TNBC诊断标准者; ② 首次发病或复发者; ③ 血细胞计数、肝肾功能和血脂指标等正常者; ④ 同意参与研究并签署知情同意书者。排除标准: ① 乳腺急性炎症期患者; ② 存在精神疾病或认知功能障碍者; ③ 合并其他恶性肿瘤者; ④ 哺乳期或妊娠期妇女。另选取30名匹配的健康人员作为对照,年龄42~78岁,平均56.1岁。本研究经广州市番禺区中心医院伦理委员会批准,所有受试者签署书面知情同意书。
1.2 方法
1.2.1 CTC检测和分析: 分别采集所有患者和健康人员的外周血各2管(3.2 mL/管)。第1管外周血样先于室温条件下以1 900转/min离心5 min弃上层血浆,再用氯化铵裂解红细胞后以1 900转/min离心5 min去除红细胞碎片,加入磁珠孵育后去除白细胞,将剩余细胞悬液浓缩涂片。干燥后,使用抗人CD45和针对7号染色体着丝粒、8号染色体着丝粒的探针通过CD45免疫染色和荧光原位杂交(FISH)技术检测CTC。CD45阴性, 7号染色体着丝粒或8号染色体着丝粒中任意1个阳性, 4′, 6-二脒基-2-苯基吲哚阳性,则该样品被判定为CTC。第2管外周血样用于分离上皮细胞黏附分子(EpCAM)阳性CTC, 将全血样品于室温下以 600 ×g离心10 min, 去除血浆,将细胞部分与涂有抗EpCAM 抗体(克隆 Ber-EP4)的动态珠孵育并分离,产生磁场。富集步骤后,将与磁珠偶联的CTC重悬于100 μL RNAlater中,并储存于-80 ℃环境直至RNA提取。本研究将每3.2 mL血液中含5个CTC作为CTC阳性阈值,使用Cyttel方法识别和计数CTC, 该方法结合了阴性富集、CD45免疫染色和FISH技术(预实验中已确认技术细节,包括方法的准确性、线性和重现性)。CTC检测使用Cyttel CTC检测试剂盒和Cyttel CTC检测系统,均由莱尔生物医药科技有限公司(莱尔生物)生产。
1.2.2 实时荧光定量聚合酶链反应(RT-qPCR)检测基因表达: ① 使用 Qiagen QIAmp病毒RNA提取试剂盒提取CTC样本的RNA, 使用Takara SuperScriptⅢ反转录试剂盒合成cDNA, 使用TaqMan PreAmp Master Mix试剂盒进行RT-qPCR检测。将CD45作为内参基因,采用2-△△ct法进行相对定量分析。② 使用miRNeasy FFPE提取试剂盒和脱蜡溶液从所有福尔马林固定石蜡包埋组织(FFPE)切片样品(3个10 μm切片)中提取 RNA,使用Takara SuperScriptⅢ反转录试剂盒合成 cDNA, 使用TaqMan PreAmp Master Mix试剂盒进行实时定量PCR检测。将GAPDH作为内参基因,采用2-△△ct法进行相对定量分析。
1.3 统计学分析

2 结 果
2.1 TNBC患者一般资料和临床病理特征分析
32例TNBC患者年龄33~80岁,平均58.5岁; 肿瘤分期为Ⅲ期9例,Ⅳ期23例; 样本状态为初诊24例,复诊8例; 肿瘤转移21例,其中17例为内脏转移,4例同时有内脏转移和骨转移; 肿瘤病理类型为导管原位癌29例、浸润性小叶癌1例、化生性乳腺癌2例,组织学分级为3级22例、2级10例; 有手术史者23例,未接受过任何抗肿瘤治疗者5例; Ki67表达水平低4例、高27例,表达阴性1例; 疾病进展期20例,无进展生存期(PFS)为0.5~45.2个月,平均12.4个月; 生存状态为生存15例、死亡17例,总生存期(OS)为0.5~45.2个月,平均18.4个月。
2.2 TNBC患者CTC计数及其与预后的关系
采用Cyttel技术检测31例患者(另1例患者因出现假阴性情况被剔除)外周血中CTC水平,其中8例检出≥5个CTC, 3例检出CTC簇。本研究未发现CTC计数与其他临床病理特征存在相关性。与3.2 mL血样中CTC计数<5个的23例患者相比, CTC计数≥5个的8例患者PFS、OS均更差,差异有统计学意义(P=0.033、0.006), 表明CTC计数对TNBC患者预后具有评估价值; 3.2 mL血样中CTC计数≥5个的患者中, CTC簇的存在与患者较差的OS有关(P=0.001)。见表1。
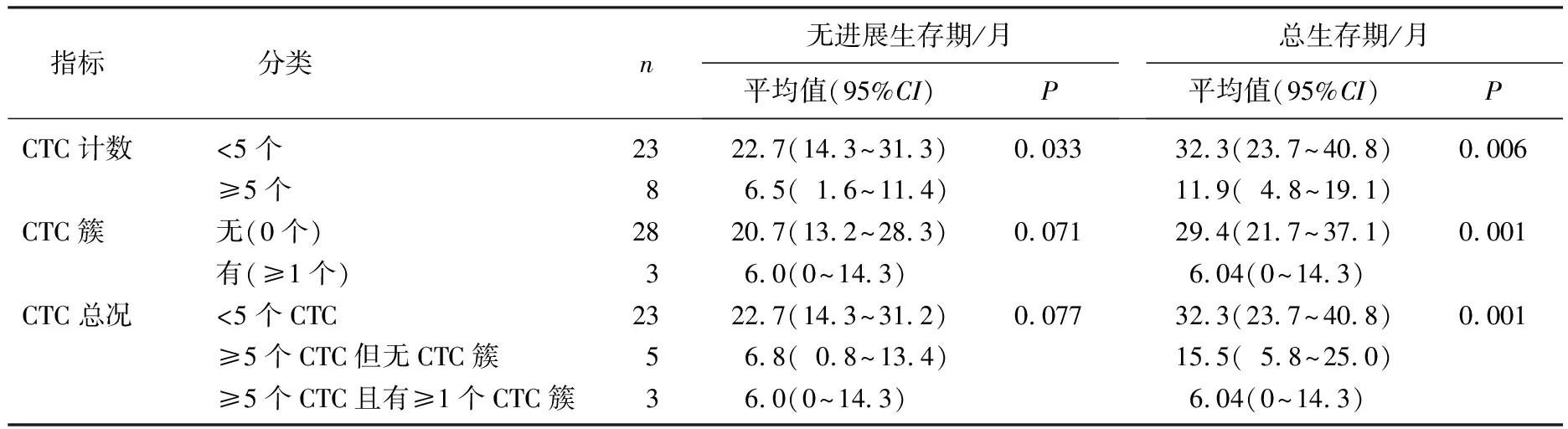
表1 31例TNBC患者CTC水平与预后情况
高水平VIM不仅与高水平的EMT启动子(如TIMP1或SNAIL1)和干细胞标记物(如CD44、ALDH2和CD49F)相关,还与EPCAM、CDH1基因相关。受试者工作特征(ROC)曲线分析结果显示,这些基因的曲线下面积(AUC)均>0.66, 且P<0.05, 可区分患者与健康对照者,证实其对肿瘤细胞转移具有诊断价值,见表2。
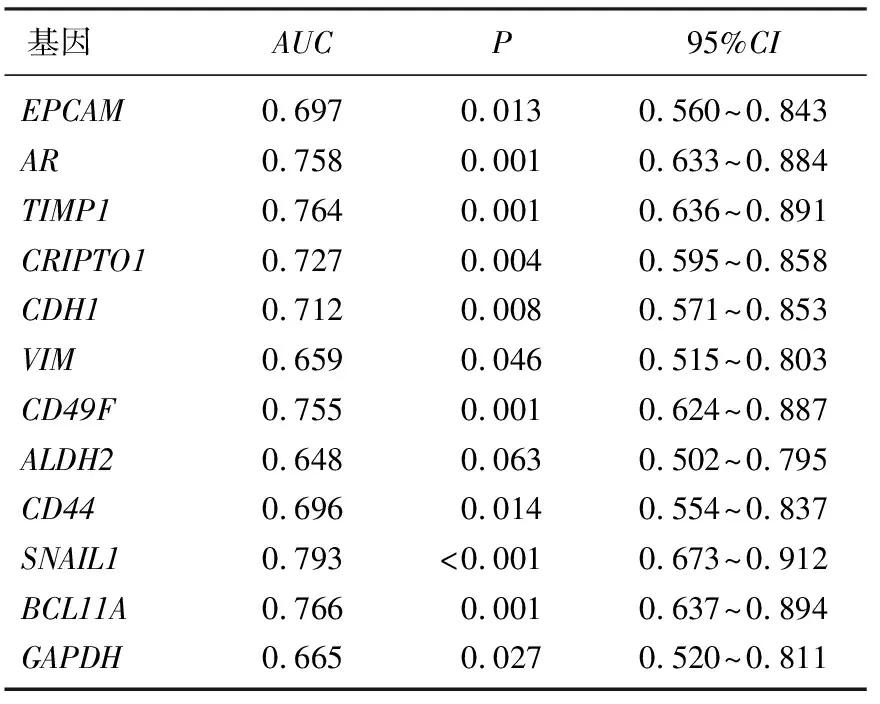
表2 CTC标记物的诊断价值
2.3 TNBC患者CTC具有细胞高可塑性的特征
为了利用Cyttel系统对CTC计数进行补充,本研究于EpCAM阳性CTC免疫分离后通过RT-qPCR法对患者队列中的CTC群体进行表征,将30名健康对照者的外周血样本作为所选基因的非CTC相关表达的参考对照。将GAPDH和CD45作为内参基因进行表达谱分析,包括与EMT、干性表型和BC侵袭性相关的基因。分析所有样本后,本研究发现CTC群体的特点是表达上皮标志物(CDH1、EPCAM), 与分离方法一致; 此外,这些细胞还不同程度表达与间充质和更多恶性特征相关的基因(如VIM、SNAIL1、TIMP1和CRIPTO1等)以及干性标记物(如CD49F、ALDH2、CD44和BCL11A等),见图1。
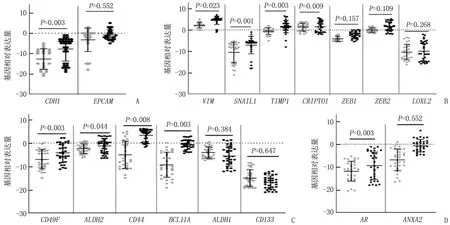
A: 上皮相关基因(CDH1、EPCAM); B: 间充质相关基因(VIM、SNAIL1、TIMP1、CRIPTO1、ZEB1、ZEB2、LOXL2); C: 干细胞特征基因(CD49F、ALDH2、CD44、BCL11A、ALDH1和CD133); D: AR、ANXA2基因。灰色圆点代表健康对照者(n=30)基因表达水平,黑色圆点代表TNBC患者(n=32)基因表达水平。图1 TNBC患者CTC和健康对照者CTC的基因表达谱比较
2.4 CTC表达特征对患者预后的预测价值
以百分位数70作为临界值,将基因表达水平分为高水平和低水平。高水平CD49F与转移肿瘤细胞存在相关性(P=0.024), 而非转移肿瘤细胞显示低水平AR(P=0.035)和TIMP1(P=0.014)。为了确定TNBC患者CTC标志物的预后价值,本研究进行Kaplan-Meier生存分析,结果显示,高水平的CD49F、ALDH2、CD44、GAPDH、TIMP1均与患者较短的OS显著相关(P<0.05), 高水平的CD49F、GAPDH、TIMP1均与患者较短的PFS显著相关(P<0.05), 见表3。Cox回归分析显示,CD49F、TIMP1、GAPDH、ALDH2、CD44高水平患者的死亡风险显著增加,分别是低表达水平患者的5.12、5.12、5.18、3.12、3.70倍;CD49F、TIMP1、GAPDH高水平患者的复发风险也显著增加,分别是低水平患者的3.33、3.86、3.56倍,见表3。
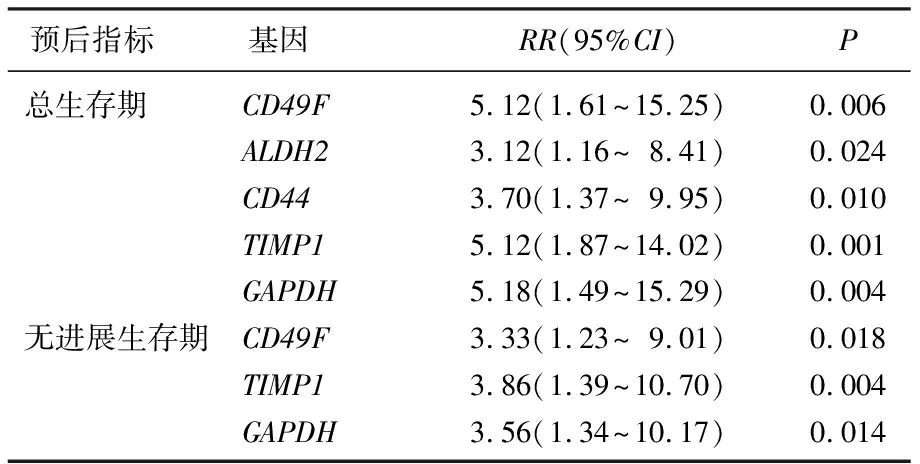
表3 CTC标志物的单变量Cox回归分析
本研究对所有差异表达的标记物进行二元Logistic回归和ROC曲线分析。分析结果显示,TIMP1、SNAIL1、BCL11A三者联合是检测肿瘤细胞转移的最佳组合(AUC为0.861,P<0.001)。模型方程为Ln(odds) =2.02+0.31×TIMP1表达+0.05×SNAIL表达+0.55×BCL11A表达。基于这个模型,本研究能够以0.756的截断值和100%的特异度,识别出60%的患者存在转移性肿瘤细胞。
本研究进一步分析CTC标志物表达水平和CTC细胞计数后发现, CTC计数≥5个的患者具有更高水平的CDH1、EPCAM、TIMP1(P=0.018、0.008、0.025), 表明Cyttel系统识别的CTC表达这3种标志物。为了确定标志物在肿瘤细胞转移过程中的作用,本研究分析了19例患者在诊断或手术时获得的原发肿瘤、转移组织和健康组织样本,并在原发肿瘤和非肿瘤组织的转移灶中发现EPCAM、SNAIL1、CD44、CDH1、TIMP1和BCL11A表达水平显著增高,说明其可能在肿瘤形成和转移过程中发挥重要作用。
3 讨 论
近年来,研究[9-10]证明CTC与不同类型肿瘤的预后有关。CTC具有特殊的分子特征,是转移病灶形成的关键,而TNBC是最具侵袭性的BC亚型,具有高转移率和缺乏有效治疗靶点等特点[11]。因此,对TNBC患者CTC进一步研究,或可为改善预后和明确诊断提供有用信息。
本研究基于Cyttel系统发现患者CTC阳性检出率为25.8%(8/31), 这些患者均已出现转移。ZHANG Y W等[12]使用Cyttel技术分析286例Ⅰ、Ⅱ和Ⅲ期TNBC患者手术前后的CTC水平,发现各期的平均CTC含量分别为23%、37%和 56%。MAGBANUA M J等[13]基于Cyttel系统发现102例Ⅳ期TNBC患者开始化疗前的CTCs检出率(CTCs ≥5个)为 44%, 而开始治疗后15 d时则降至33%。由此表明,目前的技术还不能充分有效地检测CTC。为了更好地探索CTC在TNBC中的潜在价值,本研究应用不同于既往研究[14]的方法深入探讨CTC的分子特征。
CDH1、EPCAM在从TNBC患者样本中分离出的CTC中高表达,说明肿瘤细胞起源于上皮细胞。上皮蛋白的活性在肿瘤细胞定植的最后阶段尤为重要,此时肿瘤细胞必须增殖,以重建新的肿瘤病灶[15]。TNBC患者CTC中VIM、SNAIL1、TIMP1、CRIPTO1、CD49F、ALDH2、CD44和BCL11A等基因表达,表明存在间充质干细胞标记物,可能有助于肿瘤细胞在血液中的存活。研究[16-17]表明,从上皮到间充质特征的转变会诱导上皮起源的肿瘤细胞出现干细胞特性,这些中间表型与侵袭性有关。有研究[18]对CTC群体进行表征,发现这些中间表型的出现对肿瘤细胞的存活和定植有显著影响,与本研究结果一致。在渗入和迁移到血液的过程中,细胞可塑性使得CTC能够克服缺氧环境,避免凋亡和被免疫细胞识别,在极端恶劣的环境下生存[19]。本研究发现,在转移性肿瘤患者CTC中,TIMP1、AR和CD49F表达水平更高,这可能与CTC数量增加有关,且这些基因表达水平增高可能与疾病进展有关。本研究结果显示,表型可塑性更强的EpCAM阳性CTC与肿瘤恶性进展有关,这可为癌症患者提供有效的预后信息。
综上所述, CTC计数及分子特征是获取疾病相关信息的有效途径,可为建立新的TNBC诊断、监测、预后评估方法提供参考依据,这种基于CTC液体活检的方法有可能成为探索TNBC扩散机制的重要工具。此外,本研究在TNBC患者CTC中发现了细胞可塑性,这可能与肿瘤的不良预后和高侵袭性有关。

