炎症反应指标和肿瘤标志物对子宫内膜癌手术患者预后的预测价值
黄 丹, 朱 悦, 崔树娜, 2
(1. 扬州大学医学院, 江苏 扬州, 225000; 2. 扬州大学附属医院 妇产科, 江苏 扬州, 225009)
子宫内膜癌是全球范围内常见的女性生殖系统恶性肿瘤之一,占女性生殖系统恶性肿瘤的20%~30%[1]。早期确诊并干预治疗,对改善子宫内膜癌患者的预后至关重要。肿瘤标志物糖类抗原125(CA125)表达水平在子宫内膜异位症、子宫肌瘤以及妊娠期和月经期妇科良性疾病患者中均有升高[2], 故其并非妇科恶性肿瘤分级的有效评估指标。糖类抗原199(CA199)属于低聚糖肿瘤相关抗原,与细胞有丝分裂有关,在其他恶性肿瘤中的表达水平也较高[3], 因此也不能独立预测子宫内膜癌患者的预后情况。血小板与淋巴细胞比值(PLR)、中性粒细胞与淋巴细胞比值(NLR)可以早期预测肿瘤患者的预后[4-5], 且NLR已被证实与子宫内膜癌[6]、卵巢癌[7]、子宫颈癌[8]、肝癌[9]、食道癌[10]和结直肠癌[11]等疾病的预后有关。本研究探讨炎症生物标记物NLR、PLR和肿瘤标志物CA125、CA199对子宫内膜癌手术患者预后的预测价值,现报告如下。
1 资料与方法
1.1 一般资料
选取2013年1月—2018年6月在扬州大学附属医院接受子宫内膜癌手术的患者作为研究对象。纳入标准: ① 经病理学诊断为子宫内膜癌者; ② 手术治疗前未接受任何辅助治疗者。排除标准: ① 病历中缺失相关临床数据者; ②失访者; ③ 患有血液系统疾病或其他肿瘤者; ④ 患有持续性炎性疾病或急性感染者。本研究经扬州大学附属医院医学伦理委员会审核批准。
1.2 数据收集
① 人口统计学资料: 包括年龄、身高、体质量、是否绝经(绝经年龄); ② 临床指标: 包括手术方法、病理分期、肿瘤分级、CA125水平、CA199水平、淋巴转移情况及合并疾病等; ③ 血液炎症反应标志物: 包括术前血清白蛋白水平,手术前后NLR、PLR水平; ④随访指标: 包括妇科检查结果,血清CA125、CA199水平,经阴道超声检查、胸部X线摄影和磁共振成像检查结果。
1.3 统计学分析
采用[M(P25,P75)]对计量资料进行统计学描述,采用COX比例风险模型对不同临床变量进行单因素和多因素生存分析,采用χ2检验分析炎症反应指标与临床病理学变量之间的关系,采用Kaplan-Meier分析比较术前和术后NLR水平不同患者的总生存率。采用SPSS 22.0软件对数据进行统计学分析,P<0.05为差异有统计学意义。采用R包进行相关性分析。
2 结 果
2.1 人口统计学资料和围术期指标
本研究共检索185例患者的数据,排除54例患者(数据不完整者,血液疾病或其他肿瘤患者,持续性炎症疾病或急性感染患者)后,最终纳入131例患者。
131例患者年龄36~90岁,平均(56.32±8.77)岁; 随访时间20~60个月,平均40个月; 手术年龄≤56岁者70例, >56岁者61例; 体质量指数<24 kg/m2者60例, 24~28 kg/m2者42例,>28 kg/m2者29例; 绝经93例,高血压44例,糖尿病19例,淋巴转移4例,血行转移4例,术后化疗13例,术后放疗51例,行淋巴结清扫术72例; 子宫内膜癌组织学分型Ⅰ型127例, Ⅱ型4例; 肿瘤分级为G1级10例、G2级105例、G3级16例; 国际妇产科协会(FIGO)分期为Ⅰ期117例、Ⅱ期12例、Ⅲ期2例; 手术方式为开腹手术33例、腹腔镜手术94例、开腹与腹腔镜联合手术4例; CA125≤16.11 U/mL 48例, >16.11 U/mL 83例; CA199≤23.62 U/mL 96例, >23.62 U/mL 35例; 术前白蛋白≤42 g/L 29例, >42 g/L 102例; 术前PLR≤128.0者58例, >128.0者73例; 术后PLR≤137.7者56例, >137.7者75例; 术前NLR≤3.58者94例, >3.58者37例; 术后NLR≤3.14者53例, >3.14者78例。随访结束时, 8例患者死亡, 123例患者存活(其中10例患者无病生存)。
2.2 受试者工作特征(ROC)曲线分析
无病生存期的ROC曲线分析显示,术前NLR截断值为3.58, 曲线下面积(AUC)为0.805, 术后NLR截断值为3.14,AUC为0.592。根据风险水平对连续临床变量和非生物分类变量进行评分,根据AUC分析的最佳临界值,对血液炎症指标进行二值化。
2.3 单因素和多因素分析
单因素分析结果显示, FIGO分期、CA199水平、术前NLR水平均分别与总生存期、无病生存期显著相关(P<0.05), 术后放疗、术后NLR水平仅与无病生存期显著相关(P<0.05), 肿瘤分级、组织学分型、淋巴转移、手术方式、术后化疗等因素均与总生存期、无病生存期无相关性(P>0.05), 见表1。多因素分析结果显示,术后放疗、CA199水平与总生存期显著相关(P<0.05), 术前NLR水平、术后NLR水平均分别与总生存期、无病生存期显著相关(P<0.05), 见表2。
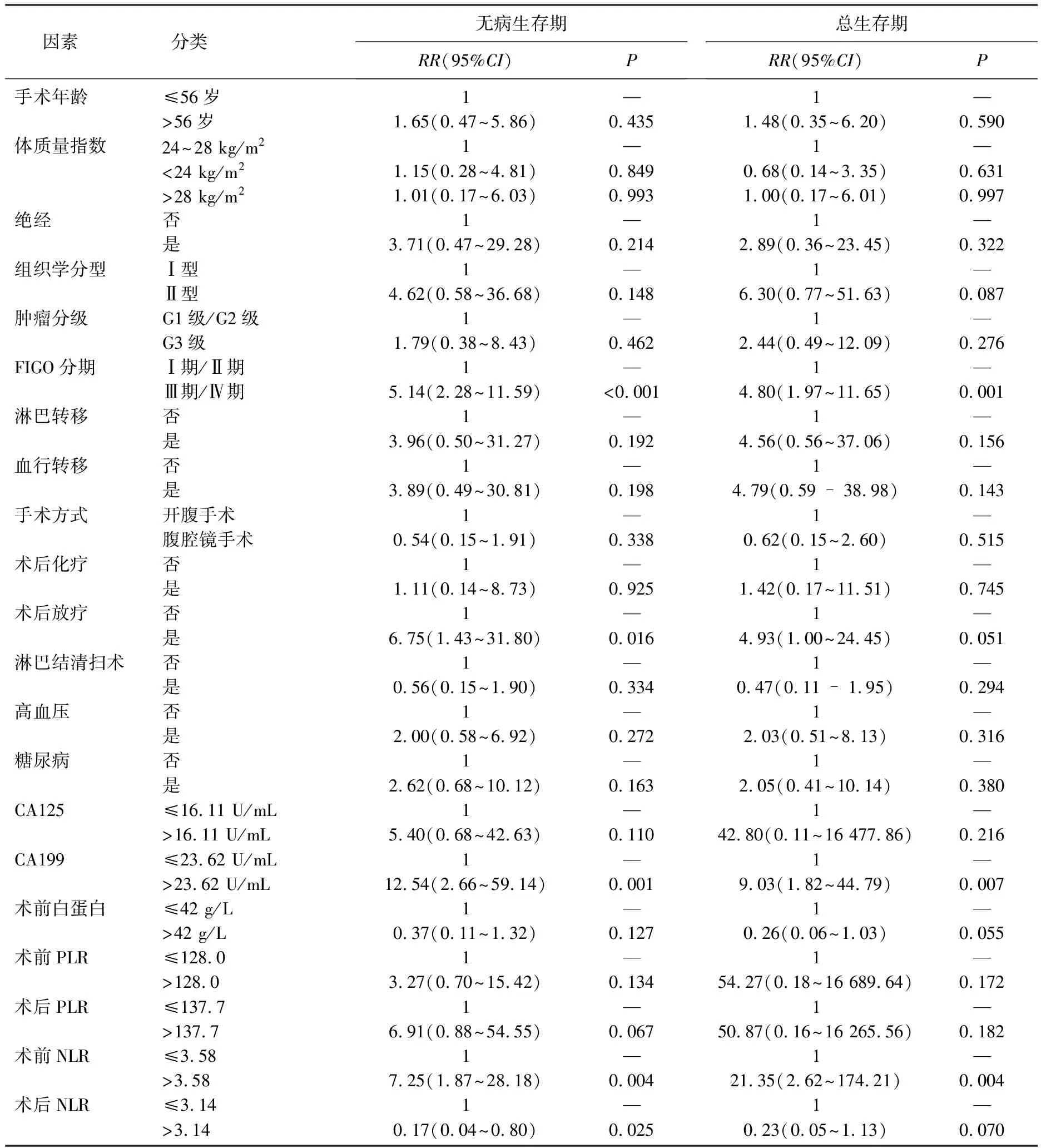
表1 131例患者生存情况的单因素分析

表2 131例患者生存情况的多因素分析
分析不同NLR水平与患者临床特征的相关性发现, CA199水平、术前PLR、术后PLR均与术前NLR显著相关(P<0.05), 但仅术后PLR与术后NLR显著相关(P<0.05), 见表3。
将术前NLR表达水平根据临界值(3.58)分为高水平组和低水平组,将术后NLR表达水平根据临界值(3.14)分为高水平组和低水平组,分别进行Kaplan-Meier生存分析并绘制生存曲线。Kaplan-Meier生存分析结果显示,高水平的术前NLR(χ2=16.871,P<0.001)和高水平的术后NLR(χ2=3.966,P=0.046)均与较低的总生存率显著相关,但与无病生存期无显著相关性,见图1。
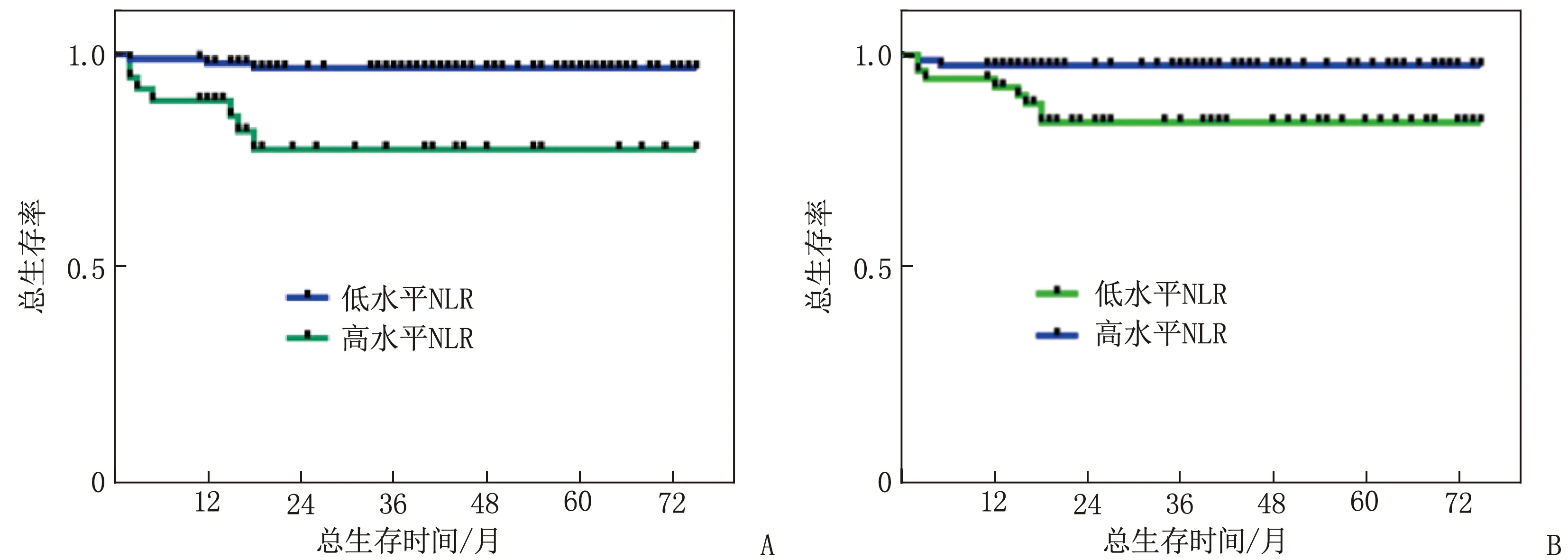
A: 术前NLR; B: 术后NLR。图1 不同NLR水平患者的生存曲线
2.4 相关性分析
通过R包中“char. Correlation”函数实现连续临床参数(共11个参数)之间成对相关性的可视化,并采用皮尔逊相关系数作为默认值,变量之间无显著线性相关性。术前NLR与总生存期显著相关, CA125与CA199显著相关,术后NLR与术后PLR显著相关,术前PLR与术后PLR显著相关,见图2。

右上方面板中的单元格显示任意2个参数的相关系数值(∗∗∗P<0.001, ∗∗P<0.01, ∗P<0.05, ·P<0.10); 左下方面板中的单元格是任意2个参数的双变量散点图,并带有拟合线; 对角线是拟合线的各参数分布的直方图。图2 各临床参数相关性分析的可视化图
3 讨 论
NLR作为全身炎症反应指标,其可用于评估和监测促肿瘤与抗肿瘤免疫之间的动态平衡。持续监测治疗前后外周血中NLR水平不仅可以反映机体免疫力变化,还可以反映肿瘤浸润程度以及恶性肿瘤预后。ROC曲线显示,术前NLR的AUC优于其他血液参数,故术前NLR是预测子宫内膜癌手术患者预后的潜在标志物。本研究结果显示,术前NLR和术后NLR是子宫内膜癌术后患者的独立预后因素,与既往研究[12]结论一致。NLR较高的患者淋巴结受累率较高, FIGO分期较高, PLR较高。TAKAHASHI R等[13]报道,中性粒细胞计数增加与子宫内膜癌患者临床分期晚、宫颈受累、淋巴管生成和辅助治疗增加有关。研究[14]报道, NLR、平均血小板体积和血小板分布宽度对子宫内膜癌前病变和子宫内膜癌具有预测价值。一项研究[15]对639例先前接受过治疗的子宫内膜癌患者进行多变量分析发现,早期或晚期癌症患者的NLR、PLR升高与预后不良相关。
本研究发现, NLR升高与子宫内膜癌患者的肿瘤复发和低生存率有关,这可能是由浸润性肿瘤细胞与宿主炎症反应之间的关系引起的[16]。在上皮性卵巢癌中,中性粒细胞募集已被证明是通过诱导肿瘤细胞与基底膜分离而直接抗肿瘤的[17]。非小细胞肺癌、结直肠癌、肝细胞癌、黑色素瘤和肾透明细胞癌中可观察到更高水平的中性粒细胞,中性粒细胞通过多种途径促进肿瘤进展和转移,包括基质重塑、促进细胞增殖、控制肿瘤细胞黏附、刺激血管生成和抑制T细胞介导的抗肿瘤活性[18]。此外,其他几种抗肿瘤途径可通过抑制中性粒细胞的募集而靶向中性粒细胞,将其转化为抗肿瘤表型[19]。肿瘤坏死因子-α和γ干扰素可同时诱导致癌性中性粒细胞的抗肿瘤表型并激活自然杀伤(NK)细胞[20]。CD4+T细胞和CD8+T细胞是抵抗肿瘤活性的主要效应T细胞, CD4+T细胞产生介导肿瘤消除并促进CD8+T细胞分化和扩增的细胞因子,随后CD8+T细胞通过直接的细胞毒性去除肿瘤细胞[21]。T细胞的抗肿瘤活性已通过针对T细胞检查点(例如PD-1和遗传性T细胞修饰)的多克隆抗体的临床应用得到证明[22]。尽管B细胞在肿瘤进展中起着双重作用,但有研究[23]发现,侵袭性B细胞与多种类型肿瘤的良好临床预后相关。NK细胞表现出抗肿瘤作用,可促进细胞凋亡,通过抗体依赖性细胞介导的细胞毒性和γ干扰素的分泌抑制肿瘤细胞增殖和血管生成而发挥重要的保护作用[24]。总之,升高的NLR可以通过多种方式促进肿瘤进展,进而导致不良预后。
本研究中, CA125、CA199水平与患者不良预后无显著相关性。CA125对妇科恶性肿瘤的临床分期、肿瘤侵袭和肿瘤分级具有重要意义,但其水平升高也可见于不同程度妇科良性疾病(如子宫内膜异位症、子宫肌瘤)患者和妊娠期、月经期女性等[2], 故特异性较低,不建议单独用于肿瘤的早期诊断和筛查。CA199在子宫内膜癌患者中的表达水平明显较高,但其诊断子宫内膜癌的敏感性较低,具有一定假阳性可能,需与其他指标联合应用。本研究还发现,患者较高的生存率与早期手术切除后接受常规放疗显著相关,与既往研究[25]结论相符。本研究尚存在一些局限性: ① 本研究为单中心回顾性研究,所得结果可能无法代表所有子宫内膜癌手术患者; ② NLR、PLR可能受多种混杂因素影响,但在本研究中未得到控制; ③ 本研究样本量相对较少,且仅对患者进行短期随访,未来还应开展大样本量研究并延长随访时间进一步评估患者的长期生存率。
综上所述, NLR是一种基于全血细胞计数的简便、经济且独立的炎症反应指标,术前高NLR和术后高NLR均与子宫内膜癌术后患者较低的总生存率显著相关,或可用于预测子宫内膜癌术后患者的预后。

