不同茶树品种中CsNUDX1基因催化功能、启动子结构及功能分析
杨霁虹,周汉琛,徐玉婕
不同茶树品种中基因催化功能、启动子结构及功能分析
杨霁虹,周汉琛*,徐玉婕
安徽省农业科学院茶叶研究所,安徽 黄山 245000
香叶醇是茶树中重要的萜烯类化合物,在不同茶树品种中的积累存在较大差异。茶树核苷二磷酸水解酶(Nucleoside diphosphate hydrolase,Nudix)基因可促进香叶醇及其糖苷在茶树中的积累。为探究该基因在不同茶树品种中的催化功能及调控差异,分析了7个茶树品种中香叶醇的积累差异及时空表达变化,同时分析了该基因的催化功能及其启动子结构和功能差异。结果显示,表达量与香叶醇含量变化呈显著正相关(0.805);香叶醇在中国变种茶树嫩梢中的含量显著高于阿萨姆变种茶树。农杆菌介导的本氏烟草遗传转化体系表明,不同茶树品种的均能促进香叶醇的生物合成。启动子活性分析显示,云抗10号茶树品种中的启动子活性较弱;结构分析表明,云抗10号茶树品种启动子在转录起始位点–33处有185碱基的序列插入,使得增强元件CAAT-box位于–133处(其他品种CAAT-box均位于–47处)。研究结果表明不同茶树品种中的均能够促进香叶醇的生物合成,但启动子区域遗传多样性使得其表达水平有差异。
茶树;香叶醇;基因;功能分析;启动子分析
研究显示野生型阿萨姆茶树(Ancestralvar.)、栽培型阿萨姆茶树(Cultivatedvar.,CSA)和中国变种茶树(var.,CSS)在遗传进化树上分别属于不同分枝,且目前我国茶树栽培品种遗传背景差异较大,其内源代谢途径中关键酶基因表达及代谢产物积累存在差异[1-3]。Zhang等[4]研究显示,云南、贵州、广东栽培茶树品种多为阿萨姆变种;安徽、浙江及福建北部栽培茶树品种间亲缘关系较近,遗传背景差异较小,区别于福建南部和台湾栽培品种,也区别于江西、湖北、陕西等地区栽培品种,表明了茶树品种丰富的遗传多样性。Takeo[5]分析了33个茶树品种(品系)中香叶醇及芳樟醇的含量,并计算了萜烯指数,发现变种茶树中的萜烯指数最高可达到1;中国种与阿萨姆种杂交品种中萜烯指数分布范围为0.21~0.76;日本地区栽种的变种茶树中萜烯指数为0.12~0.69,表明不同茶树品种中芳樟醇和香叶醇含量存在显著差异。
香叶醇作为茶叶中重要的单萜烯醇,是绿茶和红茶的重要呈香物质,其阈值低(6~75 μg·L-1)[6],且具有浓郁的玫瑰花香和甜香特征。茶树中的香叶醇主要以糖苷形式存在,在加工过程中,由内源糖苷水解酶催化并释放出游离态香叶醇[7-8]。罗勒()[9]、细毛樟()[10]、紫苏()[11]、长春花()[12]等植物中的香叶醇可由香叶醇合成酶(Geraniol synthase,GES)直接催化底物牻牛儿基焦磷酸(Geranyl diphosphate,GPP)生成[13]。Magnard等[14]研究发现,玫瑰中的核苷二磷酸水解酶(Nucleoside diphosphate hydrolase,Nudix)基因可以脱去GPP的单磷酸基团形成牻牛儿基单磷酸(Geranyl monophosphate,GP),再通过另一种磷酸水解酶催化合成香叶醇,这是玫瑰中合成香叶醇的主要途径。在茶树中,Nudix基因家族中定位于细胞质的可以显著促进香叶醇及其糖苷在转基因植物中的积累[15-16]。研究显示,茶树萜类合成酶转基因烟草叶片中可检测到香叶醇的微弱积累,但体外酶活反应中该基因重组蛋白无法催化底物GPP生成香叶醇[17]。
香叶醇作为茶树中重要的单萜类物质,对成品茶香气品质形成具有重要作用。基于茶树资源的遗传多样性,本研究拟通过分析不同茶树品种中香叶醇的积累变化及功能差异,以期探究遗传背景差异下的香叶醇生物合成机制,为后续研究其代谢途径提供理论参考。
1 材料与方法
1.1 材料与试剂
阿萨姆茶树品种佛香3号(FX3)、云抗10号(YK10)、雪芽100(XY100)、紫娟(ZJ),中国种茶树品种舒茶早(SCZ)、中茶108(ZC108)、浙农117(ZN117)均种植于安徽省农业科学院茶叶研究所试验基地,于10月中旬按一芽一叶标准采摘,取样后立即置于液氮中速冻,并于‒80 ℃冰箱保存备用。本氏烟草()生长于温室(白天25 ℃,夜晚23 ℃)中,光照时间为16 h。
AR2000广谱糖苷酶购自上海普迈生物科技有限公司;大肠杆菌DH5购自上海吐露港生物科技有限公司;根癌农杆菌GV3101购自上海唯地生物技术有限公司;RNA提取试剂盒(DP441)购自天根生化科技有限公司;cDNA反转录试剂盒(RR036A)、I限制性内切酶(1093A)、I限制性内切酶(1078A)、QuickCut™d Ⅲ限制性内切酶(1615)、QuickCut™H Ⅰ限制性内切酶(1605)均购自TaKaRa公司;KOD One PCR Master Mix(KMM-101)聚合酶购自TOYOBO公司;平末端克隆试剂盒5 min TOPO-Blunt Cloning Kit(C602-01)、快速克隆试剂盒(ClonExpress®Ⅱ One Step Cloning Kit)和荧光定量分析试剂(Taq Pro Universal SYBR qPCR Master Mix)购自南京诺唯赞生物科技股份有限公司;质粒提取试剂盒(®Plasmid MiniPrep Kit)和胶回收试剂盒(®PCR Purification Kit)购自北京全式金生物技术股份有限公司。
1.2 仪器与设备
ME104电子天平,梅特勒-托利多(上海)有限公司;RCT basic磁力加热搅拌器,德国艾卡公司;GCMS-QP2020 NX气相色谱质谱联用仪,日本Shimadzu公司;50/30 μm DVB/CAR/PDMS萃取头及手动固相微萃取(SPME)进样器,美国Supelco公司;LightCycler 96实时荧光定量PCR仪,瑞士Roche公司;SimpliAmp PCR仪,赛默飞世尔科技有限公司;DYY-6D电泳仪,北京六一生物科技有限公司;GelDoc XR+凝胶成像系统,美国Bio-Rad公司;MQT-60R振荡培养箱,上海旻泉仪器有限公司;Centrifuge 5804R高速冷冻离心机,德国Eppendorf公司。
1.3 试验方法
1.3.1 挥发性化合物吸附方法
参考文献[15]中方法,不同茶树品种的嫩梢和瞬时侵染的本氏烟草叶片用液氮研磨粉碎后,准确称取0.1 g样品,加入2 mL蒸馏水、200 μL 200 mg·mL-1AR2000广谱糖苷酶和1 μL 10 μg·mL-1癸酸乙酯,于37 ℃水浴下反应20 min,然后利用SPME萃取头(50/30 μmol·L-1DVB/CAR/PDMS Stableflex,USA)于65 ℃水浴下吸附30 min,用于GC-MS分析。
1.3.2 GC-MS分析
色谱柱为DB-5MS(30 m×0.25 mm×0.25 μm,Agilent,USA)。具体参数如下:总流量为17 mL·min-1,柱流量为1 mL·min-1,线速率为36.1 cm·s-1,分流比为10∶1,吹扫流量为6 mL·min-1。吸附完成的SPME萃取头立即于250 ℃进样口中解吸附5 min。柱温箱升温程序:40 ℃保留5 min,以3 ℃·min-1速率上升到85 ℃并保留2 min,以3 ℃·min-1速率上升到110 ℃并保留1 min,以5 ℃·min-1速率上升到200 ℃并保留1 min,最后以15 ℃·min-1速率上升到260 ℃并保留3 min。
以癸酸乙酯为内标,以癸酸乙酯峰面积与化合物峰面积之比计算香叶醇含量。试验重复3次。
1.3.3 基因表达分析
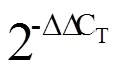
1.3.4 基因、启动子克隆及载体构建
将茶树基因组数据中转录起始位点上游1 500 bp核苷酸序列设为该基因启动子区域,利用南京诺唯赞官网提供的引物设计网站(https://crm.vazyme.com/ce-tool/ simple.html)设计克隆引物(表1)。
以不同茶树品种的cDNA为模板,利用表1中引物(--F和--R)进行全长克隆,1%琼脂糖凝胶电泳回收目的条带,回收后的目的片段利用ClonExpress®ⅡOne Step Cloning Kit试剂盒连接到经Ⅰ、Ⅰ双酶切后的植物表达载体pZP121上,用于过量表达分析(pZP121-)。以不同茶树品种的基因组DNA为模板,利用表1中引物(F和--R)进行启动子克隆,1%琼脂糖凝胶电泳回收目的条带,回收后的目的片段利用ClonExpress®ⅡOne Step Cloning Kit试剂盒连接到经d Ⅲ、H Ⅰ双酶切后的植物表达载体pBI121上,用于-葡萄糖醛酸酶(-glucuronidase,GUS)染色分析(pBI121-)。连接载体后转化大肠杆菌DH5,过夜培养后挑选阳性克隆送至擎科生物科技股份有限公司进行测序。

表1 引物序列
注:加粗字母表示酶切位点;下划线序列表示基因特异性引物
Note: The bold letters indicte the restriction site. The underlined sequences indicate gene-specific primers
1.3.5基因启动子结构分析
利用CLUSTALW(www.genome.jp/ tools- bin/clustalw)和GENEDOC软件比对序列差异,并利用PlantCARE网站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html)在线分析启动子序列的顺式作用元件。
1.3.6 烟草瞬时表达
将测序成功的重组质粒pZP121-和pBI121-用冻融法转化至根癌农杆菌GV3101,PCR鉴定阳性克隆后,避光振荡培养(28 ℃,200 r·min-1,16~24 h)并侵染本氏烟草叶片。具体操作方法如下:GV3101菌液培养至适宜浓度(OD600值约为0.8),3 500 r·min-1离心5 min收集菌体,用缓冲液(5 mg·mL-1-葡萄糖,50 mmol·L-1MES,2 mmol·L-1Na3PO4·12H2O,20 mg·L-1乙酰丁香酮)洗涤2次,然后用缓冲液重悬至OD600为0.6左右;采用一次性无菌注射器将菌液从下表皮缓慢注射入本氏烟草叶片中,设置3个生物学重复[20]。
分别以注射缓冲液和野生型本氏烟草叶片为对照,收取侵染3~4 d的本氏烟草叶片,于–80 ℃冰箱保存。按照1.3.1章节和1.3.2章节方法测其香叶醇的含量。
1.3.7 GUS组织染色分析
GUS染色液由50 mmol·L-1PBS(pH 7.2),0.1% Triton X-100,2 mmol·L-1K4[Fe(CN)6]·3H2O,2 mmol·L-1K3[Fe(CN)6],10 mmol·L-1EDTA,2 mmol·L-15-溴-4-氯-3-吲哚--葡糖苷酸环己胺盐(X-Gluc)组成,将处理后的叶片(侵染3~4 d)立即浸没在染色液中,于37 ℃培养箱中避光孵育12 h,然后利用75%乙醇脱色,用于后续观察。
1.4 数据分析
利用SPSS 20.0软件对不同样品中香叶醇含量及基因表达量进行方差分析,采用Duncan法分析不同样品间的显著性(<0.05)。
2 结果与分析
2.1 不同月份茶树中香叶醇合成酶基因表达分析
基于可促进茶树中香叶基樱草糖苷的积累[15],萜类合成酶转基因本氏烟草叶片中也可检测到香叶醇的积累[17],本研究分析了舒茶早茶树品种不同月份嫩梢中香叶醇的代谢谱与和基因的表达谱。
结果表明,茶树嫩梢中的香叶醇含量在3、4、5月较高,在1、2、7月较低(图1)。qRT-PCR分析表明,和在不同月份茶树嫩梢中的表达模式较为接近,均在3月表达量最高。通过Pearson运算方法分析了不同月份嫩梢中香叶醇含量与、相对表达量间的相关性,结果显示,相对表达量与香叶醇含量的相关系数()为0.805;相对表达量与香叶醇含量也存在显著正相关性(=0.818),表明和与茶树中香叶醇的生物合成密切相关,但由于体外酶活反应中无法催化底物GPP生成香叶醇,本研究不进行讨论。
2.2 香叶醇含量及CsNUDX1-cyto、CsTPS10表达分析
本研究利用HS-SPME-GCMS分析了3个CSS(舒茶早、中茶108、浙农117)和4个CSA茶树品种(佛香3号、云抗10号、雪芽100、紫娟)鲜叶中的香叶醇含量。由图2可知,不同茶树品种鲜叶中的香叶醇含量存在显著差异,舒茶早鲜叶中的香叶醇含量最高(7.65 µg·g-1),其次为中茶108。CSS茶树品种鲜叶中的香叶醇含量均显著高于CSA茶树品种鲜叶,如舒茶早中的香叶醇含量约为雪芽100(0.08 µg·g-1)的95.6倍。
芳樟醇是茶树中另一个重要的单萜化合物,与香叶醇的合成前体物质相同,均为GPP[8]。本研究同时分析了7个茶树品种鲜叶中芳樟醇及其氧化物的含量,结果表明,两类茶树变种鲜叶中的芳樟醇含量无显著性差异,但芳樟醇呋喃型氧化物(芳樟醇氧化物Ⅰ和芳樟醇氧化物Ⅱ)在CSS茶树中的含量显著高于CSA茶树品种。
qRT-PCR分析表明,在中茶108嫩梢中的表达量最高,在浙农117嫩梢中的表达量最低;在雪芽100中的表达量最高,在佛香3号、云抗10号、紫娟及浙农117中的表达量无显著差异。不同月份茶树中香叶醇含量与和表达量呈显著正相关,而不同茶树品种中香叶醇积累与这两个基因表达量的相关性不明显,推测茶树遗传背景多样性使得香叶醇生物合成存在差异调控。
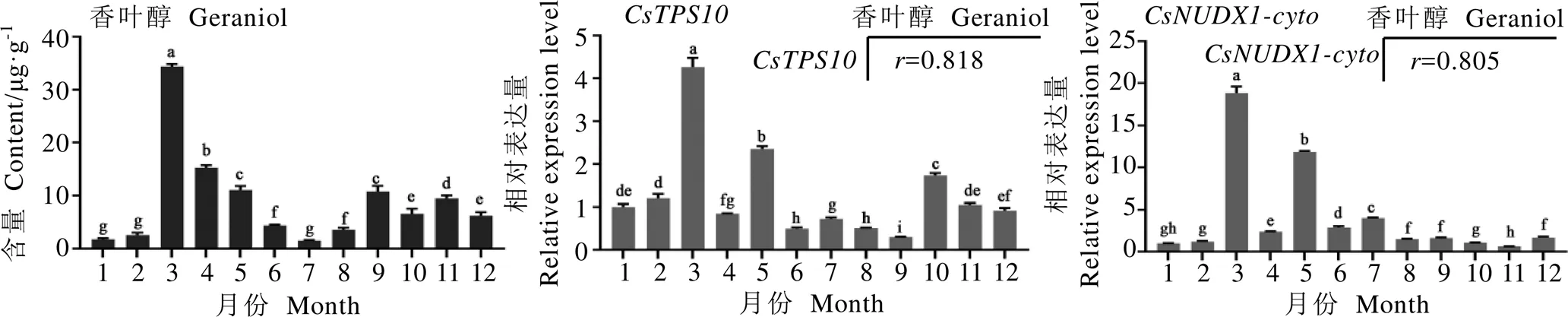
图1 香叶醇含量与CsTPS10、CsNUDX1-cyto表达量的相关性分析
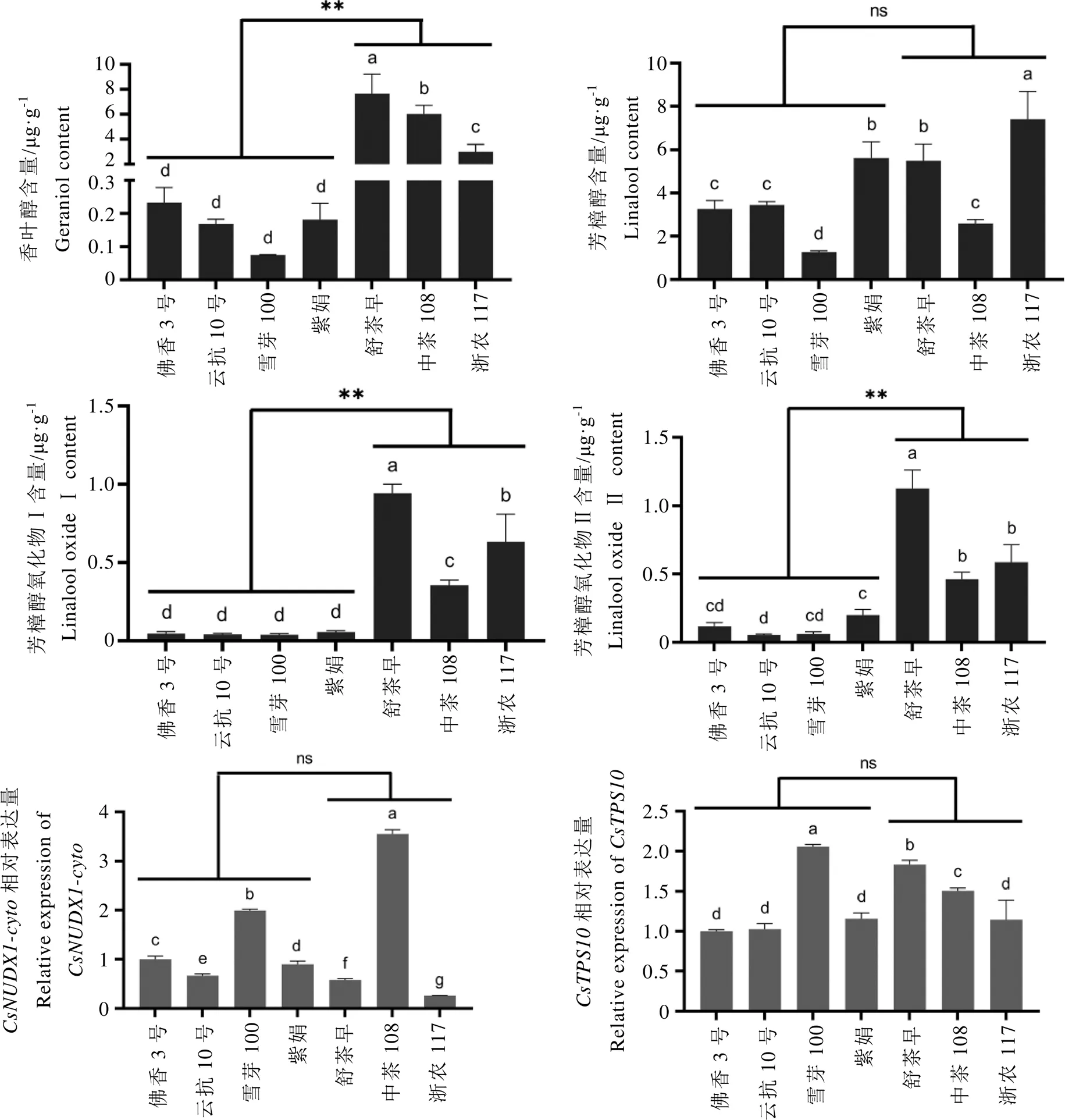
注:不同小写字母表示差异显著(P<0.05)
2.3 CsNUDX1-cyto的功能分析
为探究不同茶树品种中CsNUDX1-cyto催化能力是否存在差异,本研究克隆了7个茶树品种中的,并利用农杆菌介导的遗传转化体系将其瞬时过量表达于本氏烟草叶片中,以检测香叶醇积累差异。以注射缓冲液的本氏烟草叶片(CK)为阴性对照,已鉴定功能的舒茶早为阳性对照,采用HS-SPME-GCMS方法检测了7个处理组叶片中香叶醇的丰度变化。结果表明,与阴性对照及野生型本氏烟草叶片相比,瞬时过量表达7个茶树品种基因均能够显著促进香叶醇的积累;雪芽100的过表达叶片中香叶醇积累量高于阳性对照(图3)。
2.4 CsNUDX1-cyto启动子活性分析
qRT-PCR结果表明(图4),在不同茶树品种中的表达水平存在显著差异,但均能促进香叶醇的积累。基于此,本研究构建了7个品种的proCsNUDX11500-cyto:GUS融合载体转化根癌农杆菌GV3101,使其在烟草叶片中瞬时表达,然后采用X-Gluc染色法分析各启动子的活性。为消除叶片生长发育状态对X-Gluc染色的影响,本研究以ZC108-proCsNUDX11500-cyto:GUS为对照,在同一片叶子两侧分别注射不同表达载体。结果显示,7个茶树品种基因启动子均能正常驱动基因表达。与对照ZC108-proCsNUDX11500-cyto:GUS相比,雪芽100、紫娟、佛香3号、浙农117、舒茶早5个品种的proCsNUDX11500-cyto活性差异较小(GUS染色程度相近),而云抗10号茶树品种的proCsNUDX11500-cyto活性较弱。
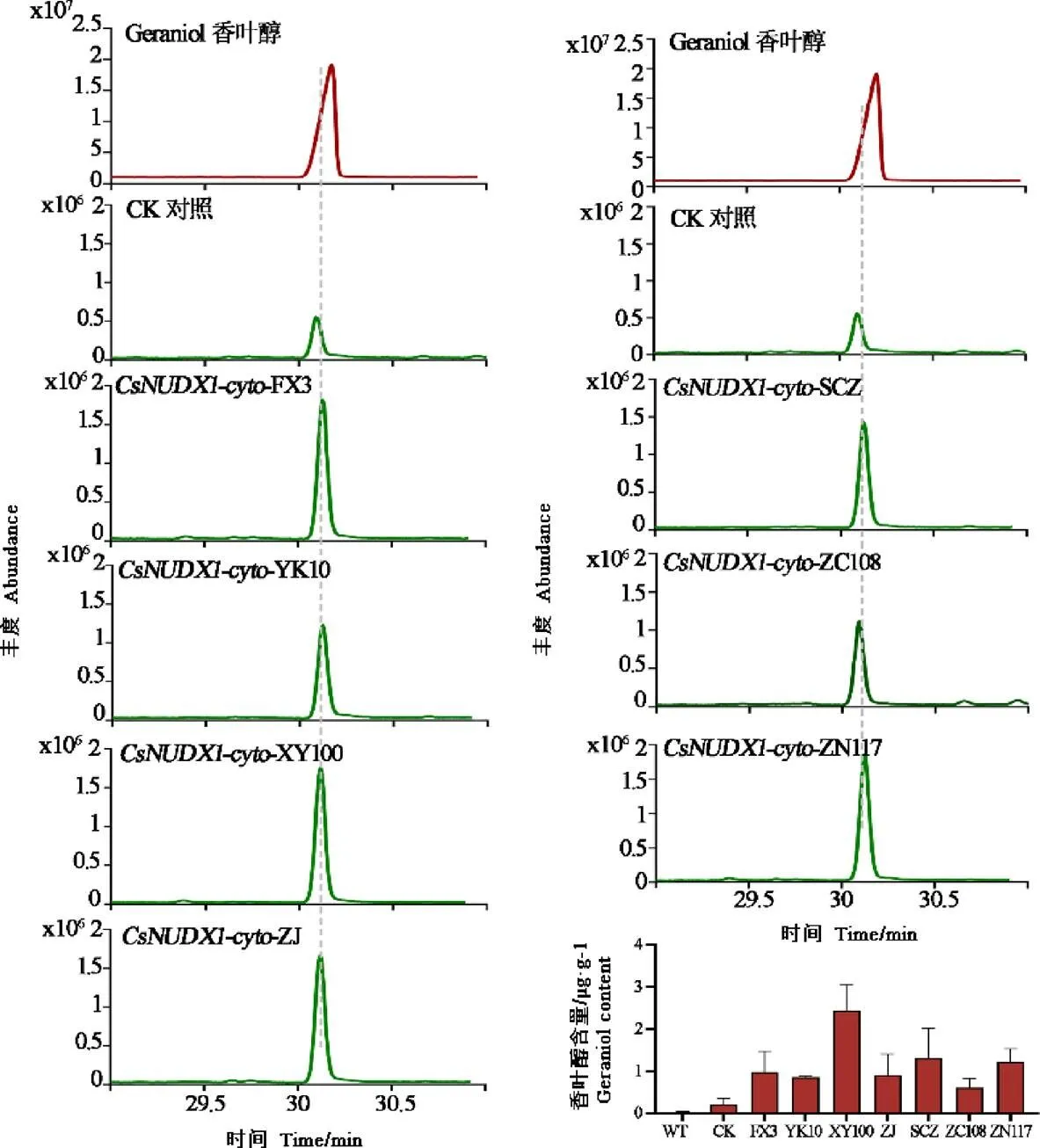
注:WT表示野生型本氏烟草叶片,CK表示对照,FX3、YK10、XY100、ZJ、SCZ、ZC108、ZN117分别表示佛香3号、云抗10号、雪芽100、紫娟、舒茶早、中茶108、浙农117过表达样品
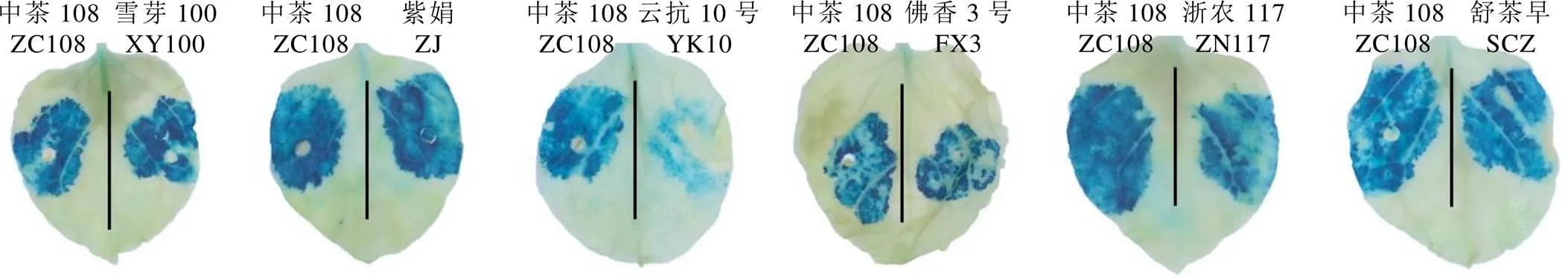
注:以中茶108茶树品种CsNUDX1-cyto启动子为阳性对照,同一片叶子两侧分别注射不同表达载体
2.5 CsNUDX1-cyto启动子结构分析
不同茶树品种基因启动子序列比对结果如图5所示。云抗10号启动子在转录起始位点–33处有185碱基的序列插入,其插入序列中虽存在TATA-box等重要启动元件,但重要增强子元件CAAT-box距离转录起始位点较远(位于–113处),其他品种CAAT-box位于–47处。CAAT-box可控制转录起始频率,研究发现,TATA-box上游存在CAAT-box时,基因的表达会增强[21]。推测云抗10号的启动子活性弱可能与–33处碱基的序列插入有关。
通过Plant CARE对启动子序列进行顺式作用元件分析,除了包含负责基因转录起始准确性及高效性的TATA-BOX和CAAT-BOX,还包含多个非生物逆境调控元件,如光响应元件G-box、Box4、GT1-motif和Box Ⅱ,防御应激响应元件STRE,脱落酸响应元件ABRE、ABRE4,生长素响应元件TGA-element,赤霉素响应元件P-box,乙烯响应元件ERE,茉莉酸甲酯响应元件AAGAA-motif、CTAG-motif、MYC和MYB等。
3 讨论
本研究结果显示,不同月份样品中的和表达量变化与香叶醇积累均呈显著正相关,表明这两个基因与香叶醇生物合成密切相关。不同月份样品中的表达量与香叶醇积累的相关性更显著,但该基因重组蛋白无法催化底物GPP或法尼基焦磷酸(Farnesyl pyrophosphate,FPP)生成任何萜类物质[17]。研究显示,只有通过外源添加底物GPP,过量表达的烟草叶片中才可通过SPME-GC-MS检测到香叶醇的释放。而无论是在重组蛋白活性检测(催化GPP生成GP)还是转基因植株分析中(促进香叶醇及其糖苷的积累)均具有生物学活性[15]。结合本研究结果,表明转录表达受季节、茶树发育状态影响较大,与萜类物质的释放具有相似规律,但该基因生物学活性较弱,推测其在茶树中不是主导香叶醇生物合成的萜类合成酶基因。和表达量在供试的7个茶树品种中有明显差异,其中在中茶108嫩梢中的表达量最高,在浙农117嫩梢中的表达量最低;在雪芽100茶树嫩梢中的表达量最高。HS-SPME-GCMS结果显示,中国变种茶树与阿萨姆变种茶树中的香叶醇积累有显著性差异。与月份相关性分析不同的是,不同茶树品种中和的表达量与香叶醇生物合成量相关性较弱,推测茶树具有遗传多样性,不同茶树品种遗传基础存在差异,且存在调控香叶醇生物合成的机制是多样的,如蛋白水平在不同茶树品种中是否存在差异?在后续研究中可进一步解析。此外,本研究表明,不同茶树品种中的均具有催化底物GPP生成香叶醇的生物学功能。

图5 不同茶树品种CsNUDX1-cyto基因启动子序列比对及结构分析
启动子序列可通过与转录因子结合而控制基因转录与表达[22]。qRT-PCR定量分析显示,品种间表达水平与香叶醇含量变化相关性较弱。启动子活性分析显示,除云抗10号品种中启动子活性较弱外,其他品种间启动子活性差异较小,导致不同茶树品种中香叶醇积累差异的因素较多,如可能存在尚未发现的能够合成香叶醇的萜类合成酶(Terpene synthase,TPS)以及转录因子调控的差异等。Zhou等[23]研究显示,芳樟醇为茶树中重要的单萜类物质,其生物合成前体为GPP,与香叶醇生物合成前体相同,具有相同底物的催化酶存在竞争关系。本研究中芳樟醇含量在两类变种茶树中的差异不明显,而呋喃型芳樟醇氧化物在两类变种茶树中存在显著性差异。Zeng等[24]研究表明,芳樟醇氧化物的积累与茶树叶片面积呈显著负相关,推测是由于阿萨姆变种茶树叶片面积普遍较大,光照抑制了芳樟醇氧化物的合成。
综上所述,和表达水平与香叶醇积累存在相关性;不同茶树品种中香叶醇含量有显著性差异;不同茶树品种中的催化底物能力有差异,但均能促进香叶醇的生物合成。
[1] Wang X C, Feng H, Chang Y X, et al. Population sequencing enhances understanding of tea plant evolution [J]. Nature Communications, 2020, 11(1): 4447. doi: 10.1038/s41467-020-18228-8.
[2] 夏恩华, 韦朝领, 宛晓春. 茶树生物学“十三五”进展及“十四五”发展方向[J]. 中国茶叶, 2021, 43(9): 31-41. Xia E H, Wei C L, Wan X C. Tea plant biology process during the 13thFive-Year Plan period and development direction in the 14thFive-Year Plan period [J]. China Tea, 2021, 43(9): 31-41.
[3] An Y L, Mi X Z, Zhao S Q, et al. Revealing distinctions in genetic diversity and adaptive evolution between two varieties ofby whole-genome resequencing [J]. Frontiers in Plant Science, 2020, 11: 603819. doi: 10.3389/fpls.2020.603819.
[4] Zhang X T, Chen S, Shi L Q, et al. Haplotype-resolved genome assembly provides insights into evolutionary history of the tea plant[J]. Nature Genetics, 2021, 53(8): 1250-1259.
[5] Takeo T. Variation in amounts of linalool and geraniol produced in tea shoots by mechanical injury [J]. Phytochemistry, 1981, 20(9): 2149-2151.
[6] Ho C T, Zheng X, Li S M. Tea aroma formation [J]. Food Science and Human Wellness, 2015, 4(1): 9-27.
[7] 贺志荣, 项威, 徐燕, 等. 茶树挥发性萜类物质及其糖苷化合物生物合成的研究进展[J]. 茶叶科学, 2012, 32(1): 1-8. He Z R, Xiang W, Xu Y, et al. Progress in the research of biosynthesis of volatile terpenoids and their glycosides in tea plant [J]. Journal of Tea Science, 2012, 32(1): 1-8.
[8] 王让剑, 杨军, 孔祥瑞. 茶树挥发性萜类物质研究进展[J]. 茶叶学报, 2018, 59(3): 149-154. Wang R J, Yang J, Kong X R. Research advances in studies on volatile terpenes in tea plants () [J]. Acta Tea Sinica, 2018, 59(3): 149-154.
[9] Iijima Y, Gang D R, Fridman E. Characterization of geraniol synthase from the peltate glands of sweet basil [J]. Plant Physiology, 2004, 134(1): 370-379.
[10] Yang T, Li J, Wang H X, et al. A geraniol-synthase gene from[J]. Phytochemistry, 2005, 66(3): 285-293.
[11] Ito M, Honda G. Geraniol synthases from perilla and their taxonomical significance [J]. Phytochemistry, 2007, 68(4): 446-453.
[12] Kumar K, Kumar S R, Dwivedi V, et al. Precursor feeding studies and molecular characterization ofestablish the limiting role of geraniol in monoterpene indole alkaloid biosynthesis inleaves [J]. Plant Science, 2015, 239: 56-66.
[13] Degenhardt J, Kllner T G, Gershenzon J. Monoterpene and sesquiterpene synthases and the origin of terpene skeletal diversity in plants [J]. Phytochemistry, 2009, 70(15/16): 1621-1637.
[14] Magnard J L, Roccia A, Caissard J C, et al. Biosynthesis of monoterpene scent compounds in roses [J]. Science, 2015, 349(6243): 81-83.
[15] Zhou H, Wang S, Xie H F, et al. Cytosolicis involved in geranyl-primeveroside production in tea [J]. Frontiers in Plant Science, 2022, 13: 833682. doi: 10.3389/fpls.2022.833682.
[16] 周汉琛, 杨霁虹, 徐玉婕, 等. 香叶醇生物合成相关基因的进化分析[J]. 茶叶科学, 2022, 42(5): 638-648. Zhou H C, Yang J H, Xu Y J, et al. Phylogenetic analysis ofgene involved in geraniol biosynthesis [J]. Journal of Tea Science, 2022, 42(5): 638-648.
[17] Qiao D H, Tang M S, Jin L, et al. A monoterpene synthase gene cluster of tea plant () potentially involved in constitutive and herbivore-induced terpene formation [J]. Plant Physiology Biochemistry, 2022, 184: 1-13.
[18] Gohain B, Bandyopadhyay T, Borchetia S, et al. Identification and validation of stable reference genes inspecies [J]. E3 Journal of Biotechnology and Pharmaceutical Research, 2011, 2(1): 9-18.
[19] Wang X C, Hao X Y, Ma C L, et al. Identification of differential gene expression profiles between winter dormant and sprouting axillary buds in tea plant () by suppression subtractive hybridization [J]. Tree Genet & Genomes, 2014, 10: 1149-1159.
[20] 薛迎斌, 宋佳, 李枭艺, 等. 大豆基因克隆、亚细胞定位及功能分析[J]. 华南农业大学学报, 2023, 44(3): 420-429. Xue Y B, Song J, Li X Y, et al. Cloning, subcellular localization and functional analysis ofin soybean [J]. Journal of South China Agricultural University, 2023, 44(3): 420-429.
[21] 杨鹏芳, 段国琴, 胡晓炜, 等. 高等植物启动子研究概述[J]. 分子植物育种, 2018, 16(5): 1482-1493. Yang P F, Duan G Q, Hu X W, et al. Overview of higher plant promoters research [J]. Molecular Plant Breeding, 2018, 16(5): 1482-1493.
[22] 李明月, 李丹, 同拉嘎, 等. 不同类型水稻品种胚乳基因表达特性及启动子序列比较分析[J]. 分子植物育种, 2017, 15(11): 4325-4335. Li M Y, Li D, Tong L G, et al. Expression characteristics and promoter sequences comparison analysis ofgene in endosperms of different rice varieties [J]. Molecular Plant Breeding, 2017, 15(11): 4325-4335.
[23] Zhou Y, Deng R F, Xu X L, et al. Enzyme catalytic efficiencies and relative gene expression levels of ()-linalool synthase and ()-linalool synthase determine the proportion of linalool enantiomers invar.[J]. Journal of Agricultural and Food Chemistry, 2020, 68(37): 10109-10117.
[24] Zeng L T, Xiao Y Y, Zhou X C, et al. Uncovering reasons for differential accumulation of linalool in tea cultivars with different leaf area [J]. Food Chemistry, 2021, 345(9): 128752. doi: 10.1016/j.foodchem.2020.128752.
Catalytic Function, Promoter Structure and Functional Analysis ofin Different Tea Cultivars
YANG Jihong, ZHOU Hanchen*, XU Yujie
Tea Research Institute, Anhui Academy of Agricultural Sciences, Huangshan 245000, China
Geraniol is an important monoterpenoid in tea plants, and its accumulation varies greatly among different tea cultivars. The recent study shows thatis responsible for the production of geraniol and its glycosides in tea plants. In order to explore the differences in the catalytic function and regulation ofin different tea cultivars, this study analyzed the differences in the accumulation of geraniol and expression patterns of, and analyzed the differences in the catalytic function, promoter structure and function ofin seven tea cultivars. The result shows thatexpression was positively correlated with geraniol content (=0.805). The content of geranyl in fresh leaves ofvar.(CSS) was significantly higher than that in.var.(CSA) cultivars.-mediated genetic transformation system shows thatof different tea cultivars could promote the biosynthesis of geraniol. Analysis of promoter activity shows thatpromoter had the weakest activity in ‘Yunkang 10’, and the structural analysis shows that the promoter ofin ‘Yunkang 10’ had an 185 base sequence insertion at the transcription start site –33, making the enhancing element CAAT-box located at –133 (CAAT-boxes in other cultivars were located at –47). The results of this study indicate thatin different tea cultivars could promote geraniol biosynthesis, but the genetic diversity of the promoter region results in differences in its expression level.
tea plant, geraniol,gene, function analysis, promoter analysis
S571.1;Q52
A
1000-369X(2023)05-621-10
2023-08-03
2023-09-07
国家自然科学基金(32002096)、安徽省农业科学院青年英才计划项目(QNYC-202119)
杨霁虹,女,研究实习员,主要从事茶树生物化学及分子生物学方面研究。*通信作者:tuesday1011@163.com

