烟草NtWRKY71基因克隆与表达分析
康怡乐,王亚楠,陈辉,王晨,王林,罗朝鹏,杨军,曹培健,谢小东
烟草基因克隆与表达分析
康怡乐,王亚楠,陈辉,王晨,王林,罗朝鹏,杨军,曹培健,谢小东*
中国烟草总公司郑州烟草研究院,郑州高新技术产业开发区枫杨街2号 450001
【背景和目的】WRKY转录因子作为一类植物特有蛋白,不仅参与植物抗病、抗逆等防御反应,而且在植物分枝发育过程中发挥重要作用。为鉴定烟草分枝发育相关的WRKY转录因子。【方法】以拟南芥分枝发育相关转录因子AtWRKY71序列为参考,在烟草基因组中进行鉴定和克隆。利用生物信息学方法分析烟草NtWRKY71理化性质和进化关系。通过qPCR和芯片表达谱分析了时空表达特征和激素诱导表达模式,利用本氏烟草瞬时表达系统进行亚细胞定位分析。【结果】烟草基因的蛋白编码序列为930 bp,编码一个由309个氨基酸组成的WRKY蛋白。烟草NtWRKY71含有保守的WRKY蛋白结构域。进化分析显示NtWRKY71与野生烟草WRKY71、土豆WRKY71以及拟南芥WRKY71进化关系较近。基因表达分析表明,在雄蕊、雌蕊以及根中大量表达;另外,受赤霉素、生长素和水杨酸的诱导上调表达。亚细胞定位实验表明,NtWRKY71定位在细胞核中。【结论】烟草为拟南芥分枝调控基因的同源基因,其表达受到多种激素的调控。研究结果为深入解析在烟草分枝发育中的功能奠定了基础。
烟草;;克隆;基因表达;亚细胞定位
WRKY转录因子是近年来研究较为广泛的一类植物所特有的转录因子,不仅在植物防御病菌入侵的免疫反应过程中起着重要作用[1-3],而且在植物干旱[4-5]、低温[6]、开花[7]以及腋生分生组织发育[8-9]等过程中发挥重要的调控作用。WRKY转录因子N端含有高度保守的氨基酸序列WRKYGQK,C端有一个锌指结构Cys(2)-His(2)或Cys(2)-HisCys,这些保守结构域可促进WRKY转录因子与靶基因启动子中的顺式作用元件W盒(TTGACT/C)相结合[10-12]。根据转录因子所含WRKY结构域的个数和锌指结构的特征,一般将WRKY转录因子分为3类:第1类含有两个WRKY结构域,第2类含有一个WRKY结构域,这两类WRKY转录因子都含有相同的锌指结构:C-X4-5-C- X22-23-H-X1-H[13-14]。第3类含有一个WRKY结构域和锌指结构C-X6-7-C-X23-33-H-X1-C[15]。
WRKY转录因子的功能已在植物中得到了广泛的研究。第一个编码WRKY蛋白的基因是从甘薯中克隆得到[16],随后的研究发现,基因均存在于烟草[13]、水稻[1]、小麦[17]、拟南芥和欧芹[10]等多种植物中。研究发现水稻和在水稻抵抗病原体中起重要作用,过表达会增强植物敏感性,敲除会增强对水稻黄单胞菌的抗性。过表达增强植物抗性,抑制会对水稻黄单胞菌更敏感[18]。小麦正调控幼苗对条锈病菌(,Pst)的抗性[19]。过表达拟南芥显著增强了植株对细菌性病原体的易感性,进一步研究发现负调控水杨酸(Salicylic acid,SA)介导的信号通路,还在SA与茉莉酸(Jasmonic acid,JA)的信号互作中发挥重要调节作用[20]。玉米通过调节应激相关基因的活性,提高拟南芥的抗旱性[21]。过表达棉花可以提高拟南芥的抗盐和抗旱能力,而的沉默会提高棉花对非生物胁迫的敏感度[22];另外,盐、乙二醇(Ethylene glycol,PEG)、脱落酸(Abscisic acid,ABA)可以诱导表达。研究发现拟南芥基因在抗病毒方面发挥作用,过表达可以增强拟南芥对黄瓜花叶病毒(,CMV)的抗性,而敲除会使拟南芥对CMV更敏感[23]。烟草和受ABA胁迫时表达量上升,受SA胁迫时表达量上升,这提示3个WRKY可能参与植物病原诱导的防御反应[13]。
是从拟南芥中克隆的一个调控腋生分生组织发育和腋芽活性的WRKY转录因子,通过融合抑制子沉默技术(Chimeric Repressor Silencing Technology)将表达抑制后,植株分枝减少,而过表达基因则促进腋生分生组织发育。进一步研究发现通过调控生长素的分布进而影响植株分枝发育[8]。目前,有关在其他植物中的同源基因尚未被研究。烟草是重要的农作物和模式植物,对烟草腋芽发育的调控研究具有重要的应用价值和理论意义。本研究利用烟草基因组数据,通过鉴定、克隆和表达的方法,分析烟草分枝发育相关WRKY类转录因子基因。
1 材料与方法
1.1 烟草材料和试剂
烟草()K326种植于国家烟草基因研究中心的人工气候温室,培养条件为光照16 h,28℃,黑暗 8 h,25℃。采集生长28 d左右真叶期幼苗,洗去培养基,将幼苗浸泡在无菌水中培养7 d,使其适应环境,再用各种激素分别处理幼苗。激素处理为:10 μmol/L脱落酸(Abscisic acid,ABA),10 μmol/L赤霉素(Gibberellin,GA),10 μmol/L 3-吲哚乙酸(Indole-3-acetic acid,IAA)和10 μmol/L水杨酸(Salicylic acid,SA);以1% 的二甲基亚砜(Dimethyl Sulphoxide,DMSO,体积比)为对照(CK),各激素和对照处理6 h后采样。采集盛花期烟草的根、茎、叶片、叶脉、花瓣、花萼、雌蕊、雄蕊、顶芽、腋芽,以及幼苗期、旺长期、成熟期的根用于表达模式分析,所有样品经液氮速冻,置于-80℃冰箱保存。
克隆载体pEASY-T1 Simple Cloning Vector购自北京全式金生物技术有限公司,pCambia2301-GFP载体由本实验保存;感受态细胞大肠杆菌DH5α购自北京全式金生物技术有限公司,农杆菌感受态细胞LB4404购自北京密码子生物科技有限公司。
GenePure Plus多糖多酚植物RNA快速提取试剂盒购自北京密码子生物科技有限公司,重组反应试剂盒购自诺唯赞生物科技有限公司,反转录酶PrimeScript RT reagent Kit with gDNA Eraser购自北京宝日医生物技术有限公司,荧光定量PCR酶PerfectStart Green qPCR SuperMix和胶回收试剂盒购自北京全式金生物技术有限公司,引物的合成和DNA测序由北京六合华大基因科技股份有限公司完成。
1.2 烟草总RNA提取和cDNA的合成
将备用材料在液氮中充分研磨,按照RNA提取试剂盒(RE121,北京密码子生物科技有限公司)说明书进行RNA的提取,并用Nanodrop 2000和琼脂糖凝胶电泳检测RNA样品的浓度和质量。参考反转录试剂盒(RR047,Takara)说明书进行cDNA的合成,反应体系如下:RNA 2 μL,5×gDNA Eraser Buffer 2.0 μL,gDNA Eraser 1.0 μL,加ddH2O到10 μL,混匀后42℃反应2 min;再加入反转录酶 1.0 μL,反转录引物 Mix 1.0 μL,5×PrimeScript 缓冲液加4.0 μL,ddH2O 4.0 μL,37℃保温15 min后85℃ 反应5 s,获得cDNA。
1.3 NtWRKY71基因表达分析
根据目的基因序列设计qPCR(荧光定量PCR))引物,qrt-NtWRKY71-F: 5'-CCGCAACTCTTCGTGGA AAT-3', qrt-NtWRKY71-R: 5' –TGGCTCTCGTTTGTG GATCA-3'; 内参基因引物GAPDH-F: 5'-TGGGTGTC AACGAGAAGGAA-3', GAPDH-R: 5'-TCTGGGTGGC AGTAAGGGA-3'。反应体系为2×qPCR SuperMix 7.5 μL,ddH2O 4.5 μL,模板 cDNA 2.0 μL,上游引物0.5 μL,下游引物0.5 μL。PCR程序为:95℃预变性3 min,95℃变性10 s,60℃退火和延伸30 s,40个循环,循环结束后,从65℃缓慢升温至95℃,每次采集3次荧光信号。依据Ct值,采用2-ΔΔCT法计算相对表达量。
本实验室前期已构建了烟草全基因组水平的基因芯片表达图谱,该图谱涵盖了烟草全生育期不同组织/器官的表达数据。利用该数据检索烟草的表达数据,分析在烟草种子、幼苗期、团颗期、旺长期、现蕾期、盛花期、打顶期以及成熟期不同组织器官的表达特征。
1.4 PCR扩增和基因的克隆
以cDNA为模板,采用50 μL体系进行扩增:cDNA 2 μL,NtWRKY71-F 1 μL,NtWRKY71-R 1 μL,2×TransStart GoldPfu PCR SuperMix 25 μL,ddH2O 21 μL。扩增程序为:94℃预变性3 min,94℃变性20 s,58℃退火20 s,72℃延伸30 s,35个循环,循环结束后72℃ 10 min彻底延伸。NtWRKY71-F:5'-ATGTCTGATAATAACCCTTTTT-3'; NtWRKY71-R:5'-TCATGGCTCTCGTTTGTGGATC-3'。
PCR产物用1%的琼脂糖凝胶电泳分离目的条带,用胶回收试剂盒(EP101-01型号,北京全式金生物技术有限公司)回收目的片段。PCR产物连接载体后转化DH5α感受态细胞,37℃培养18~20 h,对菌板进行菌落PCR,用通用引物M13对菌板进行菌落PCR鉴定阳性菌,筛选阳性克隆并测序。
1.5 生物信息分析
利用在线软件Expasy(https://web.expasy.org/ protparam/)进行蛋白质理化性质分析;利用分析软件GenScript(https://www.genscript.com/)进行亚细胞定位分析;利用软件NetPhos 3.1(https://services.healthtech. dtu.dk/service.php?NetPhos)预测NtWRKY71的磷酸化位点;利用软件SOPMA(https://npsa-prabi.ibcp.fr/)预测NtWRKY71蛋白的二级结构;使用在线分析软件phyre2(http://www.sbg. bio.ic.ac.uk/phyre2/)预测NtWRKY71的三级结构。
1.6 多序列对比和系统发育树的构建
利用ClustalX软件对烟草、拟南芥、水稻、马铃薯、番茄、辣椒、葡萄、杨树等物种的WRKY氨基酸序列开展了多序列比对分析,分析结果再利用MEGA 10软件中N-J(Neighbor-Joining)法构建系统发育树,bootstrap值为1000次。
1.7 亚细胞定位分析
根据烟草基因编码序列设计引物(去除终止密码子),以含有基因的T载体质粒为模板进行PCR扩增,切胶回收后,用H I酶切载体pCambia2301-GFP线性化,酶切产物纯化后与上述PCR产物进行重组反应。反应体系如下:线性化载体4 μL、序列 1 μL、5×CE II Buffer 2 μL、Exnase II 1 μL、加ddH2O至10 μL。重组产物转化大肠杆菌DH5α细胞,挑取经PCR验证的阳性转化子摇菌培养提取质粒,转入农杆菌LB4404。用无针头的1 mL注射器吸取农杆菌液,从旺长期本氏烟的叶片下表皮(背面)压迫注射;将注射完成的烟草植株弱光培养48h后制作玻片,在激光共聚焦显微镜下观察、拍照;以空载体转化的农杆菌作为对照重复上述操作。
2 结果与分析
2.1 烟草NtWRKY71基因的鉴定与克隆
从拟南芥数据库TAIR(https://www.arabidopsis. org/)中下载了的基因序列和蛋白质序列,在中国烟草基因组数据库中利用BLAST程序进行了同源性比对搜索,分析表明栽培烟草基因组中为拟南芥的同源基因,将其命名为。基于中国烟草数据库中的蛋白编码序列,设计特异性扩增引物,以K326叶片的 cDNA为模板进行PCR扩增,获得了1000 bp左右大小PCR产物(图1)。进一步利用TA克隆法对PCR产物进行了克隆与测序。测序结果显示烟草基因的蛋白编码序列930(base paire),编码一个由309个氨基酸组成的蛋白。
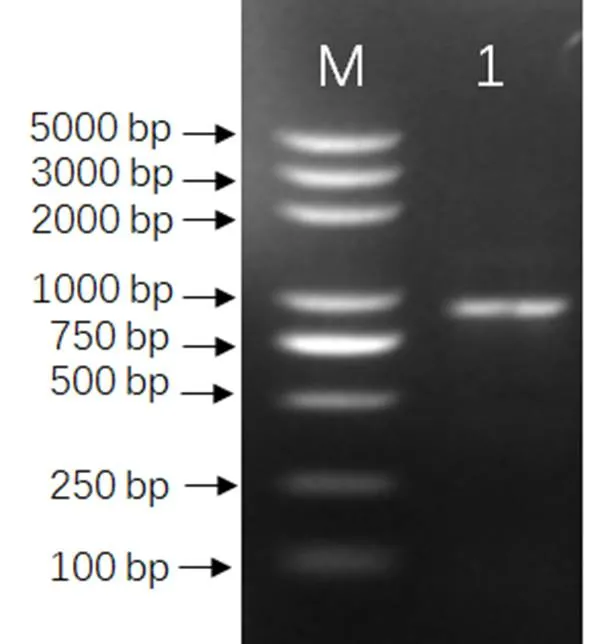
注:M: 5000 DNA Marker;1: NtWRKY71基因条带。
2.2 烟草NtWRKY71生物信息学分析
为进一步分析烟草NtWRKY71蛋白质序列结构域特征,对烟草、番茄、拟南芥、水稻、大豆和马铃薯的WRKY蛋白质序列进行比对分析(图2)。烟草NtWRKY71与其他植物WRKY蛋白的N末端均含有WRKY蛋白的标志片段WRKYGQK,C末端为锌指结构CX4CX23HXH。因此,烟草与番茄、拟南芥、马铃薯等植物WRKY蛋白的结构域高度保守。
对烟草NtWRKY71蛋白的理化分析显示,该蛋白的分子式是C1497H2318N416O491S15,分子量是34.48 kDa,等电点为6.18,有36个带负电荷的氨基酸残基和33个带正电荷的氨基酸残基。NtWRKY71平均总亲水性系数为-0.855,预测该蛋白为疏水性蛋白。对NtWRKY71蛋白的磷酸化位点预测结果显示,该蛋白预测含有44个磷酸化位点,其中丝氨酸磷酸位点28个,苏氨酸磷酸位点10个,酪氨酸磷酸位点6个(图3)。对NtWRKY71进行亚细胞定位预测结果显示,烟草NtWRKY71蛋白定位在细胞核内。

图3 NtWRKY71蛋白磷酸化位点预测
蛋白二级结构预测显示,烟草NtWRKY71蛋白的二级结构中α螺旋占20.45%,延伸链8.77%,β转角2.27%,无规则卷曲68.51%,这说明无规则卷曲和α螺旋是NtWRKY71蛋白的主要结构部位(图4A)。进一步利用phyre2软件预测烟草NtWRKY71蛋白三级结构(图4B),其结构域主要由4个β-折叠组成,符合WRKY转录因子家族的结构特征。

注:(A)NtWRKY71蛋白二级结构预测:红色代表延伸链,蓝色代表α螺旋,紫色代表无规则卷曲;(B)NtWRKY71蛋白三级结构预测。
2.3 烟草NtWRKY71进化分析
为了解NtWRKY71与其他植物WRKY家族成员的进化关系,利用MEGA 10构建了不同植物WRKY蛋白的进化树。结果如图5所示,进化树将植物WRKY蛋白分为上、下两个大的分枝,烟草NtWRKY71位于上部分枝,与野生烟草(渐狭叶烟草)和林烟草进化关系较近,与NsWRKY71、NaWRKY71为直系同源基因。烟草NtWRKY71与同属茄科的番茄SlWRKY30和马铃薯StWRKY71也有着较近的进化距离。拟南芥AtWRKY71在调控侧枝发育过程中发挥了作用,烟草是拟南芥的同源基因,同处于进化树的上部分,推测烟草NtWRKY71可能具有与AtWRKY71相类似功能,在烟草腋芽生长发育过程中发挥重要作用。番茄SlWRKY31和土豆StWRKY8,与拟南芥AtWRKY1、AtWRKY30、水稻OsWRKY89、OsWRKY94处于进化树的下部分,与烟草NtWRKY71的进化关系较远。
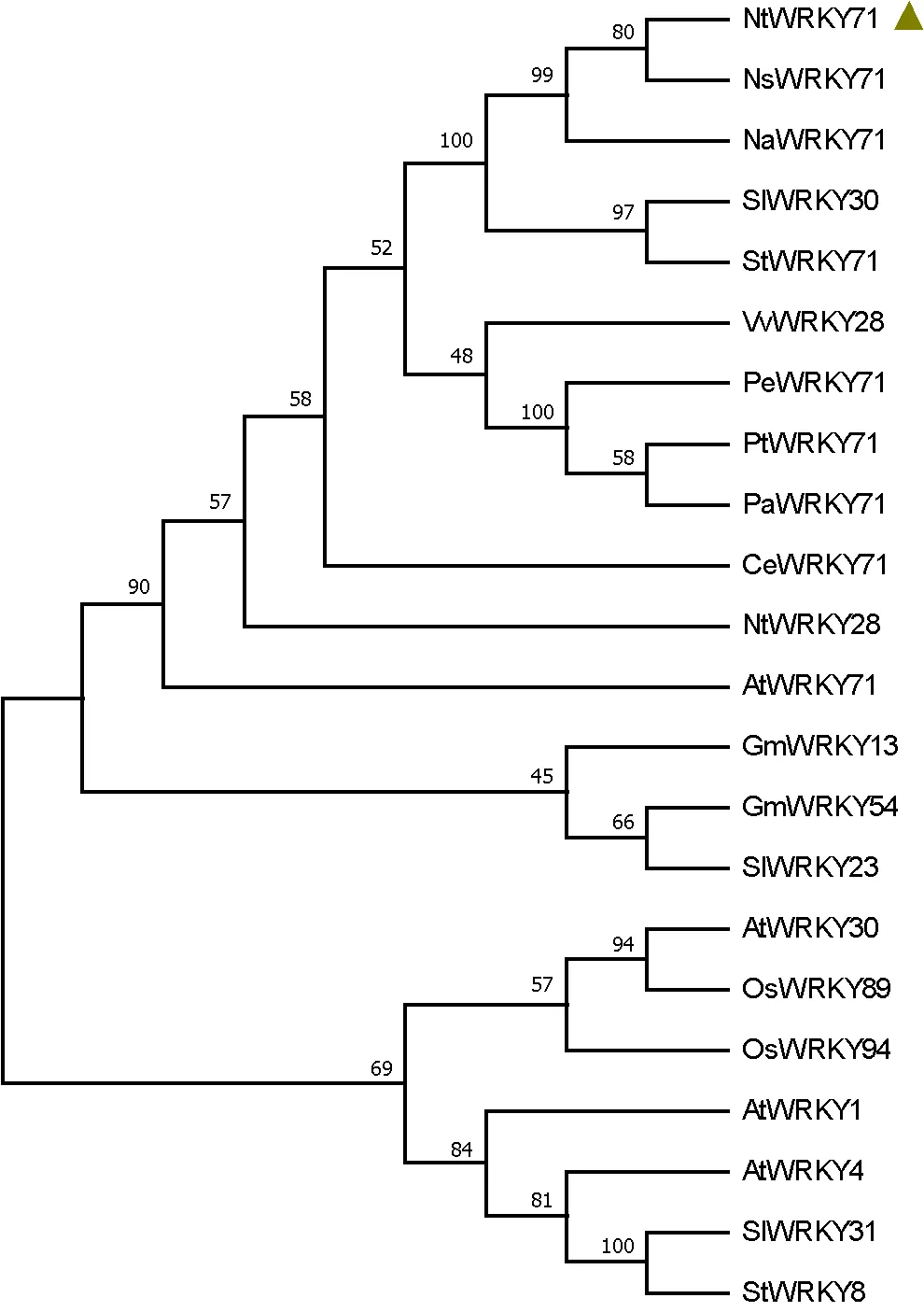
注:Nt(Nicotiana tabacum),烟草;Ns(Nicotiana sylvestris),林烟草;Vv(Vitis vinifera),葡萄;Sl(Solanum lycopersicum),番茄;Pe(Populus euphratica),胡杨;Pt(Populus trichocarpa),杨树;St(Solanum tuberosum),马铃薯;At(Arabidopsis thaliana),拟南芥;Os(Oryza sativa Japonica Group),水稻;Ce(Coffea eugenioides),咖啡;Na(Nicotiana attenuata),野生烟草;Gm(Glycine max),大豆;Pa(Populus alba),银白杨。
2.4 烟草NtWRKY71基因表达模式分析
利用qPCR分析在烟草组织器官中的表达模式,结果如图6所示,烟草在雌蕊中表达量最高,在雄蕊、花瓣、腋芽和根中也具有较高的表达量。在茎、叶片和叶脉中表达量较低,而在顶芽中表达量最低。
利用烟草全生育期不同组织器官的芯片表达谱数据分析烟草时空表达特征,结果如图7所示,在幼苗期、团颗期、旺长期以及现蕾期的须根和侧根中大量表达。在盛花期的花冠、雄蕊以及雌蕊中表达量最高,在须根和侧根中也具有较高的表达量,在茎、叶脉以及叶片中表达量相对较低,该表达模式与qPCR分析结果基本一致。在打顶期,在根、茎、叶中的表达量并无明显差别,而腋芽中的表达量相对较低。另外,烟草在种子中也表达。
植物WRKY转录因子家族蛋白调控诸多生物学过程,其转录水平的表达受到不同激素的调控。为了研究烟草不同激素的响应模式,利用外源ABA、GA、IAA、SA处理幼苗烟草,通过qPCR分析了响应不同激素的表达情况。结果如图7所示,与对照组相比,烟草表达量受到赤霉素、生长素以及水杨酸的诱导。其中,赤霉素和生长素的诱导最为显著,分别是对照的3.5倍和3倍。分析结果表明,ABA对烟草表达影响并不明显。
2.5 烟草NtWRKY71亚细胞定位
为进一步探究烟草在细胞中的分布,构建了烟草pCambia2301-NtWRKY71-GFP融合表达载体,分别将携带pCambia2301-NtWRKY71-GFP与pCambia2301-GFP质粒的农杆菌转化至本氏烟草中,弱光培养48h后,在激光共聚焦显微镜下观察荧光信号。观察结果显示(图8),转pCambia2301-GFP质粒的荧光分布在整个细胞中,而转pCambia2301- NtWRKY71-GFP质粒的荧光仅在细胞核中,这与前面对亚细胞定位预测结果相一致,表明烟草定位在细胞核中。

图8 烟草NtWRKY71亚细胞定位
3 讨论
是从普通烟草中克隆的拟南芥分枝调控基因的同源基因。对烟草表达模式的qPCR和芯片表达分析均显示,其在花器官中表达量最高。除花器官以外,在盛花期的腋芽和根中也具有较高的表达量,而芯片表达数据分析显示,相较于根,在打顶期腋芽中表达量相对较低,这可能与不同生育期腋芽发育状态下的表达活性有关。植物WRKY转录因子参与多种生物或非生物响应过程[24],生长素是调控植物分枝的最主要激素之一,研究发现生长素运输蛋白,生长素信号途径基因、和参与了拟南芥调控分枝的过程[8]。对烟草的激素响应模式分析发现,生长素信号可以明显诱导的基因表达。有研究发现,赤霉素也参与调控了植物分枝过程,赤霉素可与细胞分裂素相互作用,共同促进小桐子分枝生长[25],qPCR实验结果表明,烟草同样受到赤霉素的诱导,而与抗逆相关的脱落酸几乎不影响的基因表达。烟草抗逆相关和的表达量在脱落酸处理后表达量上升[13],这表明烟草、的功能存在差异。
拟南芥AtWRKY71是调控植物腋生分枝组织起始发育的重要的蛋白,烟草NtWRKY71与拟南芥NtWRKY71在氨基酸水平存在保守的结构位点,具有较近的进化关系。与野生烟草、土豆、番茄等茄科属植物的WRKY之间也同样有着较近进化关系,但上述植物目前只公布了基因数据,并没有相关基因功能的报道。拟南芥的过表达会导致分枝大量增加,对其转录活性的抑制却能够抑制分枝发育。研究还发现,将与进化关系较近的,,,过表达后,同样能够增加植株分枝[8],表明拟南芥基因家族中存在特异调控分枝的一类WRKY转录因子成员,且存在功能冗余现象。鉴于拟南芥中存在多个功能冗余的WRKY家族成员,烟草基因组也有可能存在多个WRKY成员协同参与分枝的可能,在功能上存在一定的冗余性。后续可深入研究烟草的功能及其分子机制,进一步解析植物WRKY转录因子调控分枝的遗传网络。
4 结论
本研究从普通烟草中克隆到一个基因,为拟南芥分枝调控基因的同源基因。烟草基因的CDS全长为930 bp,编码309个氨基酸。烟草NtWRKY71蛋白功能结构域与拟南芥AtWRKY71高度保守,且进化关系较近。qPCR与芯片表达分析表明,烟草在根系、花器官以及腋芽中表达量较高,且受生长素和赤霉素的显著诱导。为核定位蛋白,可能通过调控基因表达发挥转录因子的转录调控作用。本研究为深入研究基因调控分枝发育的分子机制奠定了基础。
[1] ZHANG Yuanji, WANG Liangjiang. The WRKY transcription factor superfamily: its origin in eukaryotes and expansion in plants[J]. BMC Evolutionary Biology, 2005, 5(1):1-12.
[2] Eulgem Thomas. Regulation of thedefense transcriptome[J]. Trends in Plant Science, 2005, 10(2): 71-78.
[3] Birkenbihl R P, Liu S, Somssich I E, Transcriptional events defifining plant immune responses[J]. Current Opinion in Plant Biology,2017, 38 (8):1-9.
[4] El-Esawi M A, Al-Ghamdi A A, Ali H M, et al. Overexpression oftranscription factor enhances heat and drought stress tolerance in wheat (L.)[J]. Genes, 2019, 10(2): 163.
[5] Taciane F, Vivian E V, Leomar G W,et al. Can WRKY transcription factors help plants to overcome environmental challenges?[J]. Genetics and Molecular Biology, 2018,41(3):533-544.
[6] CAI Hanyang, YANG Sheng, YAN Yan, et al.CaWRKY6 transcriptionally activates CaWRKY40, regulatesresistance, and confers high-temperature and high-humidity tolerance in pepper[J]. Journal of Experimental Botany, 2015, 66(11): 3163-3174.
[7] 于延冲. 拟南芥转录因子WRKY71对花和分枝发育的调控机制研究[D]. 山东:山东大学,2011.
YU Yanchong. The molecular mechanism of WRKY71 transcription factor in regulating flower and branch developmentof[D]. Shan’dong:Shandong University, 2011.
[8] GUO Dongshu, ZHANG Jinzhe, WANG Xinlei, et al.The WRKY transcription factor WRKY71/EXB1 controls shoot branching by transcriptionally regulating RAX genes in[J]. Plant Cell, 2015, 27(11):3112-3127.
[9] GUO Dongshu, QIN Genji. EXB1/WRKY71 transcription factor regulates both shoot branching and responses to abiotic stresses[J].Plant Signaling & Behavior, 2016,11(3):e1150404.
[10] Eulgem T, Rushton P J, Robatzek S, et al.The WRKY superfamily of plant transcription factors[J]. Trends in Plant Science, 2000(5):199-206.
[11] Yamasaki K, Kigawa T, Seki M, et al. DNA-binding domains of plant-specific transcription factors: structure, function, and evolution[J]. Trends in Plant Science, 2013(18): 267-276.
[12] JIANG Jingjing, MA Shenghui, YE Nenghui, et al. WRKY transcription factors in plant responses to stresses[J]. Journal of Integrative Plant Biology,2017,59(02):86-101.
[13] 熊海军,张兴坦,吴向伟,等. 栽培烟草抗逆相关WRKY转录因子的表达特征分析[J]. 中国烟草学报,2014, 20(6): 144-149.
XIONG Haijun, ZHANG Xingtan, WU Xiangwei, et al. Expression analysis of WRKY transcription factors related to stress response in cultivated tobacco[J].Acta Tabacaria Sinica, 2014, 20(6): 144-149.
[14] Christian A R, Liu Y, Shen Q J. The WRKY gene family in rice ()[J]. Journal of Integrative Plant Biology, 2007, 49(6): 827-842.
[15] XIE Zhen, ZHANG Zhonglin, ZOU Xiaolu, et al. Annotations and functional analyses of the rice WRKY gene superfamily reveal positive and negative regulators of abscisic acid signaling in aleurone cells[J]. Plant Physiology, 2005, 137(1): 176-189.
[16] Ishiguro S, Nakamura K. Characterization of a cDNA encoding a novel DNA-binding protein, SPF1, that recognizes SP8 sequences in the 5' upstream regions of genes coding for sporamin and beta-amylase from sweet potato[J]. Molecular and General Genetics MGG, 1994, 244(6): 563-571.
[17] SUN Chuanxin, Palmqvist S, Olsson H, et al. A novel WRKY transcription factor, SUSIBA2, participates in sugar signaling in barley by binding to the sugar-responsive elements of the iso1 promoter[J]. Plant Cell, 2003, 15(9): 2076-2092.
[18] TAO Zeng, LIU Hongbo, QIU Deyun, et al. A pair of allelic WRKY genes play opposite roles in rice-bacteria interactions[J]. Plant Physiology, 2009, 151(2): 936-948.
[19] WANG Junjuan, TAO Fei, An Fei, et al. Wheat transcription factor TaWRKY70 is positively involved in high-temperature seedling plant resistance tof. sp. tritici[J]. Molecular Plant Pathology, 2017, 18(5): 649-661.
[20] LAI Zhibing, VINOD KM, ZHENG Zuyu, et al. Roles ofWRKY3 and WRKY4 transcription factors in plant responses to pathogens[J]. BMC Plant Biology, 2008, 8(1): 68-80.
[21] WANG Changtao, RU Jingna, LIU Yongwei, et al. The maize WRKY transcription factorconfers drought resistance in transgenic[J]. International Journal of Molecular Sciences, 2018, 19(9):2580-2595.
[22] Ullah A, SUN Heng, Hakim X, et al. A novel cotton WRKY gene, GhWRKY6-like, improves salt tolerance by activating the ABA signaling pathway and scavenging of reactive oxygen species[J]. Physiologia Plantarum, 2018, 162(4): 439-454.
[23] ZOU Lijuan, YANG Feng, MA Yonghong, et al. Transcription factor WRKY30 mediates resistance to Cucumber mosaic virus ins[J]. Biochemical and Biophysical Research Communications, 2019, 517(1): 118-124.
[24] Bakshi M, Oelmüller R. WRKY transcription factors: Jack of many trades in plants[J]. Plant Signaling & Behavior, 2014, 9(2):e27700.
[25] NI Jun, ZHAO Meili, CHEN Maosheng, et al. Comparative transcriptome analysis of axillary buds in response to the shoot branching regulators gibberellin A3 and 6-benzyladenine in[J]. Scientific Reports, 2017, 7(1):11417-11428.
Cloning and expression analysis ofof
KANG Yile, WANG Yanan, CHEN Hui, WANG Chen, WANG Lin, LUO Zhaopeng,YANG Jun, CAO Peijian, XIE Xiaodong*
Zhengzhou Tobacco Research Institute of CNTC, Zhengzhou 450001, China
As a class of plant-specific proteins, WRKY transcription factors not only participate in plant defense reactions such as disease resistance and stress resistance, but also play an important role in plant branching development. To identify the WRKY transcription factor associated with tobacco branching development, thewas cloned and used as the reference sequence to identify its homologous sequence in the tobacco genome. The physicochemical properties and evolutionary relationships ofin tobacco were analyzed by bioinformatics methods. The spatiotemporal expression features, hormone-induced expression patterns were analyzed by qPCR and microarray expression profile data. Subcellular localization analysis was performed using the tobacco transient expression system. The protein coding sequence of tobaccois 930 base pairs, which encodes a WRKY protein consisting of 309 amino acids. Tobacco NtWRKY71 contains a conserved WRKY domain. Evolutionary analysis showed that NtWRKY71 was closely related to wild tobacco WRKY71, potato WRKY71 and Arabidopsis WRKY71. Gene expression analysis showed thatwas highly expressed in stamens, pistils and roots. In addition, the expression ofwas up-regulated by GA, auxin and salicylic acid. Subcellular localization experiments showed that NtWRKY71 was localized in the nucleus. Tobaccois a homolog of thebranching regulatory gene, whose expression is regulated by multiple hormones. These results provide a theoretical basis for a thorough analysis of the function ofin tobacco branching development.
clone; gene expression; subcellular localization
Corresponding author. Email:xiexd@cqu.edu.cn
国家烟草专卖局重大科技专项“烟草腋芽发育关键基因、miRNA挖掘与功能研究”(No. 110202001020 [JY-03]);河南省科技攻关项目“烟草腋芽特异表达基因的鉴定与功能研究”(No. 202102110147)
康怡乐(1999—),硕士研究生,主要从事烟草基因功能研究,Email:kangyl1234@126.com
谢小东(1984—),高级工程师,从事烟草分子生物学研究,Email:xiexd@cqu.edu.cn
2021-08-31;
2023-02-20
康怡乐,王亚楠,陈辉,等. 烟草NtWRKY71基因克隆与表达分析[J]. 中国烟草学报,2023,29(5). KANG Yile, WANG Yanan, CHEN Hui, et al. Cloning and expression analysis of NtWRKY71 of Nicotiana tabacum[J]. Acta Tabacaria Sinica, 2023,29(5). doi:10.16472/j.chinatobacco.2022.T0242

