RSRC1 通过靶向调控PTEN/PI3K/AKT 通路抑制食管鳞状细胞癌的增殖和转移
周家田 尚观胜 张聪 蒋德熊 袁冬冬 汤登尧 周江
食管癌是世界上最常见的消化道恶性肿瘤之一,该病被列为第七大最常见的癌症和第六大癌症死亡原因[1]。食管鳞状细胞癌(ESCC)是目前食管癌主要组织学类型,病死率在全球所有肿瘤中排名第四,总体5 年生存率仅为15%~25%[2-4]。由于大多数患者确诊时已处于中晚期,导致ESCC患者的预后不理想,5 年总生存率较差[5-7]。因此,探索ESCC 发生转移的潜在机制,对ESCC 早期诊断和治疗的新型生物标志物具有重要意义。
富含精氨酸和丝氨酸的卷曲螺旋1(RSRC1)也称SRrp53,编码富含精氨酸和丝氨酸家族的蛋白质,在细胞功能中发挥重要作用[8-9]。RSRC1 被报道在胶质母细胞瘤、胃癌等癌症中低表达,发挥肿瘤抑制因子的作用[8,10]。如Teplyuk 等[10]研究表明在胶质母细胞瘤中,RSRC1 是微小RNA(miR)-10b的靶基因,miR-10b 通过调节RSRC1 的表达促进体内胶质母细胞瘤的恶性进展。RSRC1 还被证明可以通过调节磷酸酶及张力蛋白同源物(PTEN)表达来抑制胃癌细胞的增殖和迁移[10]。最近,一些研究表明 RSRC1 基因多态性与癌症发病风险有关。如Tang 等[11]发现RSRC1 基因多态性与神经母细胞瘤易感性有关,该研究证实了携带RSRC1rs6441201A等位基因的参与者与神经母细胞瘤风险增加密切相关 。目前关于RSRC1 在肿瘤进展中的作用研究较少,且尚未有研究报道RSRC1 在ESCC 细胞发展中发挥的作用。因此,本研究将进一步探究RSRC1对ESCC 细胞增殖和转移的影响及其作用机制。本研究拟探讨RSRC1 在ESCC 细胞增殖和转移中的作用,揭示RSRC1 抑制ESCC 细胞增殖和转移的新作用机制,现将结果报道如下。
材料与方法
一、生信分析
从TCGA 数据库下载ESCC mRN 表达矩阵(normal:11,tumor:81),利用edgeR 包进行差异分析。本研究所有实验设置3 个重复。
1.细胞培养及转染
人ESCC 细胞系(TE-1,Eca-109,EC9706)和正常食管上皮细胞系Het-1A,培养在含10% FB 的RPMI-1640(Corning,美国)中,于37 ℃和5% CO2的潮湿培养箱中培养。使用Lipofectamine 2000(Invitrogen,美国)进行细胞转染,并根据试剂盒操作说明书将blank、NC 和si-RSRC1 转染到ESCC细胞。
2.qRT-PCR
通过TRIzol 试剂 (Merck,德国) 从ESCC 中提取总RNA。根据试剂盒说明,利用Hifair®Ⅱ1st Strand cDNA Synthesis SuperMix for qPCR(Yeasen,中国)将总RNA 反转录。使用 Hieff®qPCR SYBR Green Master Mix(Yeasen,中国)在ABI 12K 荧光实时定量PCR(qRT-PCR) 仪(ThermoFisher,美国)上进行qRT-PCR。基于Eca-109 细胞构建了以下细胞分组:blank 组;NC 组;si-RSRC1 组,使用2-ΔΔCt方法计算相对RSRC1 表达水平,并将GAPDH 用作内源性对照。引物序列见表1。
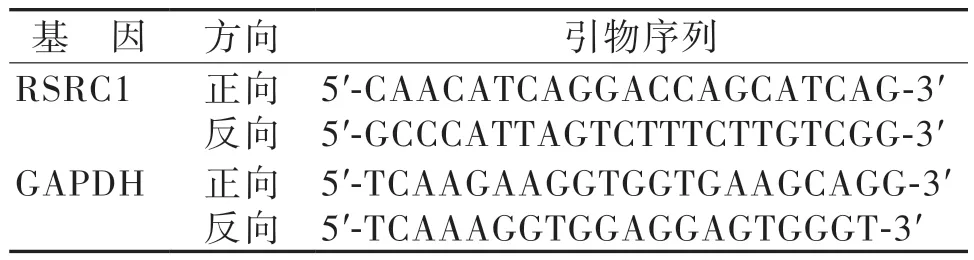
表1 qRT-PCR 引物
3.蛋白免疫印迹法
通过RIPAlysis buffer(Beyotime,中国)从培养的细胞中提取总蛋白质。使用BCA 蛋白质测定试剂盒(Beyotime,中国) 检测蛋白质浓度。对于蛋白质印迹分析,细胞裂解物通过SDS-PAGE 电泳,随后转移到 PVDF。然后将膜在室温下在脱脂牛奶中封闭约1 h,然后在4 ℃下与一抗过夜。用PBST 洗涤3 次,每次10 min 后,将膜与二抗在室温下再孵育1 h。使用ECL 底物试剂盒以及凝胶成像系统ChemiDoc ™XRS+(Bio-rad,美国)检测蛋白表达。
4.细胞活力测定
取慢病毒感染培养的 Eca-109 细胞接种到96孔板中。孵育0、24、48、72、96 h 后。向每孔中加入20 μL 的CCK-8 溶液,置于5% CO2、37 ℃培养箱培养4 h。全功能微孔板检测仪(PerkinElmer/envision,中国)检测450 nm 处的吸光度。
5.迁移和侵袭检测
细胞迁移的检测:Eca-109 细胞(每孔1×105)重悬于无血清培养基,并接种于到上室,同时在下室加入10%的FBS(Thermo Fisher Scientific,美国)细胞培养基。培养24 h 后,用4%多聚甲醇固定细胞,0.1%结晶紫进行细胞染色。在显微镜下观察成像情况并用Image J 软件进行分析。细胞侵袭的检测:在Transwell 实验装置(Corning,美国)的上室涂50 μL 基质凝胶(BD Biosciences,美国),其余步骤与细胞迁移步骤一致。
二、统计学处理
采用 SPSS 21.0 进行统计分析,计量资料采用Shapiro-Wilk 进行正态性检验,服从正态分布的资料以表示,2 组间比较采用t 检验,重复测量资料采用重复测量方差分析,P < 0.05 为差异有统计学意义。
结 果
一、RSRC1 在ESCC 中下调表达
qRT-PCR 结果显示,与正常食管上皮细胞Het-1A 组相比,RSRC1 在人ESCC 细胞系(TE-1,Eca-109,EC9706)中的表达均下降(P 均< 0.05)。见图1。因此,我们选择了RSRC1 表达量相对较高的Eca-109 细胞进行进一步研究。
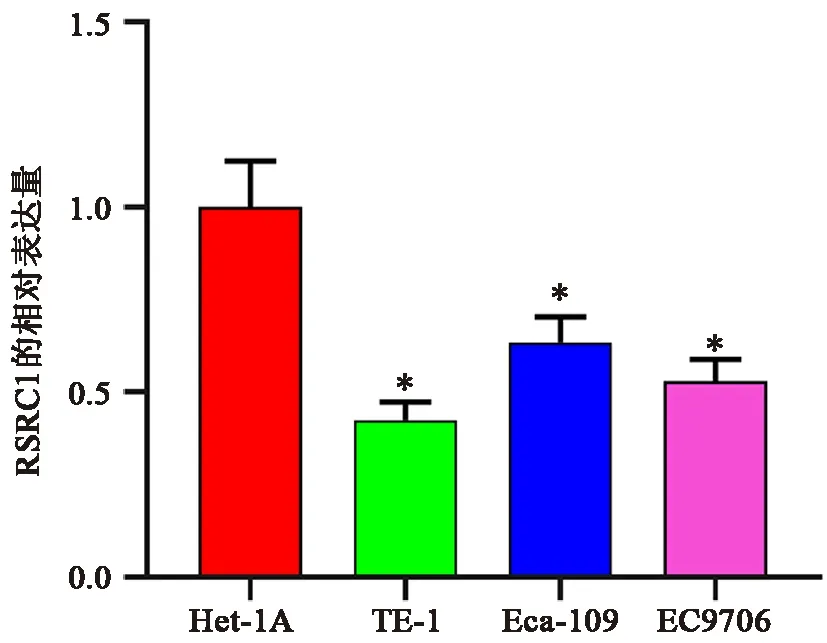
图1 RSRC1 在ESCC 中的表达
二、RSRC1 抑制ESCC 细胞的增殖和转移
与NC 组相比,敲低RSRC1 的Eca-109 细胞中RSRC1 的mRNA 和蛋白表达水平均降低(P 均<0.01),见图2A 和图2B。随后,通过CCK-8 检测各组细胞活力,结果表明与NC 组相比,敲低RSRC1 明显促进了Eca-109 的细胞活力,见图2C。最后,通过Transwell 实验检测各组细胞的迁移和侵袭能力,结果显示与NC 组相比,敲低RSRC1明显增加了Eca-109 中的迁移和侵袭细胞数量,见图2D 和图2E。
三、RSRC1 可以调控PTEN/PI3K/AKT 信号通路
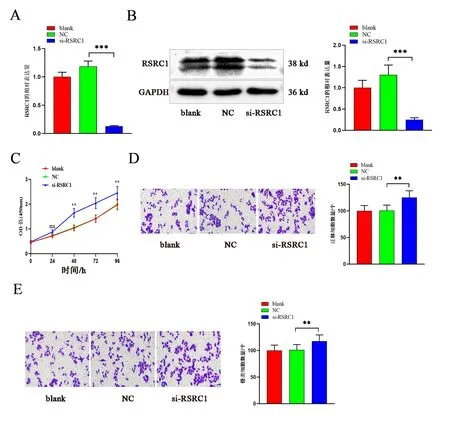
图2 RSRC1 抑制 ESCC 细胞的增殖和转移
生信分析结果表明PTEN 在ESCC 组织中明显低表达,见图3A。以PTEN/PI3K/AKT 信号通路为研究对象,基于Eca-109 细胞构建了以下细胞分组:blank 组;NC 组;si-RSRC1 组,然后通过蛋白免疫印迹法检测各组细胞中PTEN/PI3K/AKT 信号通路相关因子的表达,结果显示敲低RSRC1 明显抑制了p-PTEN 的蛋白表达,而敲低RSRC1 明显促进了p-PI3K、p-AKT 的蛋白表达,见图3B。
讨 论
ESCC 是一种常见的人类恶性肿瘤,晚期ESCC患者的5 年总生存率相对较低[12]。ESCC 的发病机制尚未完全明晰,这使得难以发现晚期 ESCC 的有效治疗方法。因此,进一步探索ESCC 病理生理学的分子机制对于开发 ESCC 的新疗法非常重要。在本研究中,我们通过分子实验首次证明RCRC1在ESCC 细胞中低表达,可能是ESCC 中潜在的肿瘤抑制因子。先前研究发现,RSRC1 通过调节转录因子雌激素受体β 的SUMO 化来抑制雌激素受体β 转录活性。此外,RSRC1 在肿瘤发展中起重要作用。Tang 等[11]研究发现RSRC1 基因多态性增加了儿童对神经母细胞瘤的易感性。Yu 等[8]研究发现RSRC1 可以抑制胃癌细胞的增殖和迁移。然而,RSRC1 在ESCC 发展中的作用尚未阐明。本研究通过CCK-8 检测各组细胞活力,结果表明与对照相比,敲低RSRC1 明显促进了Eca-109 的细胞活力;通过Transwell 实验检测各组细胞的迁移和侵袭能力,结果显示与对照相比,敲低RSRC1明显增加了Eca-109 中的迁移和侵袭细胞数量,首次发现RSRC1 能够抑制ESCC 细胞的增殖和迁移,这与前人研究结果一致,这一结果丰富了我们对ESCC 发病机制的进一步认识,并提示靶向RSRC1可能是治疗ESCC 的新策略。
有学者认为PTEN 是一种肿瘤抑制基因,可以通过直接抑制PI3K/AKT 信号通路来抑制癌症进展[13]。PTEN 是一种调节细胞生长及存活的脂质和蛋白磷酸酶,被充分证明为关键的肿瘤抑制因子,可以在多种癌症(包括ESCC)中发挥肿瘤抑制作用[14-16]。Kuo 等[17]研究发现芝麻素能够通过促进 PTEN 表达抑制宫颈癌细胞增殖。Zhang 等[18]研究发现miR-155 通过下调PTEN 促进ESCC 的迁移和侵袭。更重要的是,PTEN 是PI3K/AKT 信号通路的负调节因子[19]。据报道,miR-93-5p 可通过抑制PTEN 的表达激活PI3K/AKT 信号通路促进人视网膜母细胞瘤的进展[20]。蛇床子素通过激活PTEN抑制PI3K/AKT 信号通路诱导ESCC 细胞的凋亡[21]。为了确定RSRC1 抑制ESCC 细胞增殖和转移的分子机制,我们通过查阅文献得到RSRC1 通过促进PTEN 表达抑制肿瘤进展,推测RSRC1 和PTEN 呈正相关,本研究通过生信分析发现PTEN 在ESCC组织中表达下调,进一步通过蛋白免疫印迹法检测各组细胞中PTEN/PI3K/AKT 信号通路相关因子的表达,结果显示敲低RSRC1 明显抑制了p-PTEN的蛋白表达,而敲低RSRC1 明显促进了p-PI3K、p-AKT 的蛋白表达,进一步研究发现RSRC1 可以通过调节PTEN/ PI3K/AKT 信号通路抑制ESCC 细胞的增殖和迁移,这与前人的研究结果一致。
本研究证明RSRC1 是ESCC 中潜在的肿瘤抑制基因,并且能够抑制ESCC 细胞增殖和转移以及调节PTEN/PI3K/AKT 信号通路。因此,RSRC1可能是ESCC 的潜在诊断生物标志物,可以作为ESCC 治疗的新靶点,并在未来的药物开发中起到作用。然而,我们的研究还存在不足,缺少RSRC1 在体内的研究,以及这种类型的调控是否与mRNA 替代剪接有关。这也是我们未来研究的重要方向,我们将在细胞、分子以及动物实验对这一课题进行进一步的探究。
综上所述,RSRC1 可能通过调节PTEN/PI3K/AKT 信号通路抑制ESCC 细胞增殖和转移,为丰富ESCC 的发病机制提供了新的方向,为RSRC1可以作为ESCC 治疗的潜在靶点提供理论支持。

