茉莉酸甲酯对水稻纹枯病的诱导抗性及防御酶活性影响的研究
黄俊宝,陈立才,曹中盛,孙滨峰,李艳大
(江西省农业科学院 农业工程研究所/江西省农业信息化工程技术研究中心,江西 南昌 330200)
水稻纹枯病是由立枯丝核菌(Rhizoctonia solaniKühn)引起的一种世界性土传真菌病害,随着矮秆多蘖品种的密植、高肥、高产栽培技术的推广和管理方式的改变,纹枯病的发生日趋严重,严重时产量损失超30%,严重威胁着我国水稻生产的安全[1]。当前,水稻抗纹枯病育种至今未发现对其免疫的资源材料,缺少高抗品种[2],其防治措施仍以高效、快速、简便的化学防治为主[3],但不合理使用化学农药所导致的环境污染、农药残留、抗药性问题日益突出[4-5]。近年来,比较热门的纹枯病生物防治虽然具有安全、无残留、无抗药性、环境兼容性好等优点[6],且已筛选到具有明显防治效果的生防菌[5-9],但其防效较慢,防治技术要求高,易受环境因素的影响,且难以应对突发性病虫害[10],因而其实际应用受到限制。因此,寻找更适宜的防治方法来控制水稻纹枯病显得更为迫切。
植物诱导抗病性是植物抵御病害侵染的重要机制[11],利用激发子可激活作物自身免疫系统,诱导作物产生系统、持久和广谱的抗病性,为作物病害的绿色防治提供了新思路。茉莉酸类物质(Jasmonates, JAs)是植物诱导抗病研究领域应用较广的一种高酶活性激发子[12]。研究表明,外源MeJA能提高植物过氧化物酶(Peroxidase,POD)、过氧化氢酶(Catalase, CAT)、超氧化物歧化酶(Superoxide Dismutase, SOD)、苯丙氨酸解氨酶(Phenylalnaine Ammonialyase, PAL)、多酚氧化酶(Polyphenoloxidase, PPO)、抗坏血酸过氧化物酶(Ascorbate Peroxidase, APX)等防御酶活性,显著地减轻了巴西烟草病毒病[13]、稻瘟病[14]、水稻白叶枯病[15]、辣椒青枯病[16]等作物病害的发生,但关于MeJA诱导水稻抗纹枯病效应的研究较少。为进一步探索MeJA诱导水稻抗纹枯病的效应,本研究拟以菌丝生长速率法测定MeJA对水稻纹枯病菌丝的抑菌效果,以外源MeJA喷施处理水稻幼苗的方式测定水稻纹枯病病情指数,筛选出具有较好诱抗效果的MeJA浓度,并测定适宜浓度的MeJA喷施诱导处理对水稻防御酶活性的影响,以期为绿色防控水稻纹枯病提供技术支撑。
1 材料与方法
1.1 供试材料
供试水稻品种:中嘉早17,其种子经消毒催芽后播种于塑料盆中,培养至4叶1心期。
水稻纹枯病菌:AG1-IA菌丝融合群,由江西农业大学植物病理实验室提供。
PDA培养基:称取去皮马铃薯200 g切成小块,加蒸馏水1000 mL煮沸20~30 min,用纱布过滤后补加蒸馏水至1000 mL,加入葡萄糖20 g,琼脂粉20 g,加热溶化后分装,121 ℃高压灭菌20 min。
茉莉酸甲酯:购自美国Merck公司,以少量二甲基亚砜(Dimethyl Sulfoxide,DMSO)溶解,再用含0.1% Tween-80的蒸馏水配成10.00 mmol/L溶液备用。
1.2 试验方法
1.2.1 MeJA对水稻纹枯病菌丝生长的影响 采用菌丝生长速率法测定MeJA对水稻纹枯病菌丝生长的影响。MeJA设置7个浓度,分别为0、0.01、0.05、0.10、0.50、1.00、2.00 mmol/L,其中对照添加含0.1% Tween-80的等量无菌水。将预培养48 h的病菌菌丝块(直径0.5 cm)移至含不同浓度MeJA的PDA平板中央,于25 ℃下培养,每个处理重复3次。48 h后用十字交叉法测定每个处理的菌落直径,以3个重复的算术平均值为菌落直径的测定结果,抑制率计算公式:抑制率(%)=[1-(处理菌落直径-菌块直径)/(对照菌落直径-菌块直径)]×100%[17]。
1.2.2 MeJA对水稻幼苗抗纹枯病的诱导效应 参照Park等[18]的方法,将纹枯病菌转接至PDA培养基正中央,置于25 ℃下培养48 h后,无菌条件下在菌落边缘打孔,获取直径5 cm的菌块备用。将浓度为0、0.01、0.05、0.10、0.50、1.00、2.00 mmol/L MeJA喷雾至4叶1心期的水稻幼苗上,使植株的全部叶片湿润滴液为止,对照(CK)为含0.1% Tween-80的无菌蒸馏水。处理12 h后,用无菌镊子夹取直径为5 cm菌块接种在水稻叶鞘内侧,每株接种一块,每个处理10株,重复3次,接种后立即用保鲜膜包裹,喷水保湿处理24 h。出现典型症状后,立即取下保鲜膜,保温保湿处理7 d左右进行病情指数调查[19]:病情指数=∑(各级病株数×各级代表值)/(调查总株数×最高级代表值)×100;诱抗效果(%)=(对照组病情指数-处理组病情指数)/对照组病情指数×100%。
1.2.3 MeJA对水稻幼苗防御酶活性的影响 水稻长到4叶1心期时,设置4种方式处理:CK为对照;T-R:接种纹枯病菌丝块;T-MeJA:用0.10 mmol/L MeJA喷雾处理;T-MeJA+R:用0.10 mmol/L MeJA喷雾处理12 h后,转接纹枯病菌保湿处理。方法同1.2.2。每种处理方式3次重复。分别在处理0、24、48、72、96 h后,取水稻叶片2.00 g于液氮中冷冻保存,用于测定POD、CAT、SOD、PAL和PPO酶的酶活性。
POD、PAL、PPO酶活性测定参照Qin等[20]的方法,CAT、SOD酶活性测定参照陈利锋等[21]的方法。
1.3 数据分析
应用Excel 2019软件进行数据整理和图表绘制,应用SPSS 25.0软件中Duncan’s新复极差法进行处理之间的差异显著性分析。
2 结果与分析
2.1 MeJA对水稻纹枯病菌菌丝生长的影响
由表1可知,将水稻纹枯病菌菌丝块置于在含不同浓度MeJA的PDA平板上,菌丝生长情况在数值上虽略有不同,但无明显差异,说明在0.01~2.00 mmol/L浓度范围内的MeJA对水稻纹枯病菌菌丝生长无直接抑制作用。
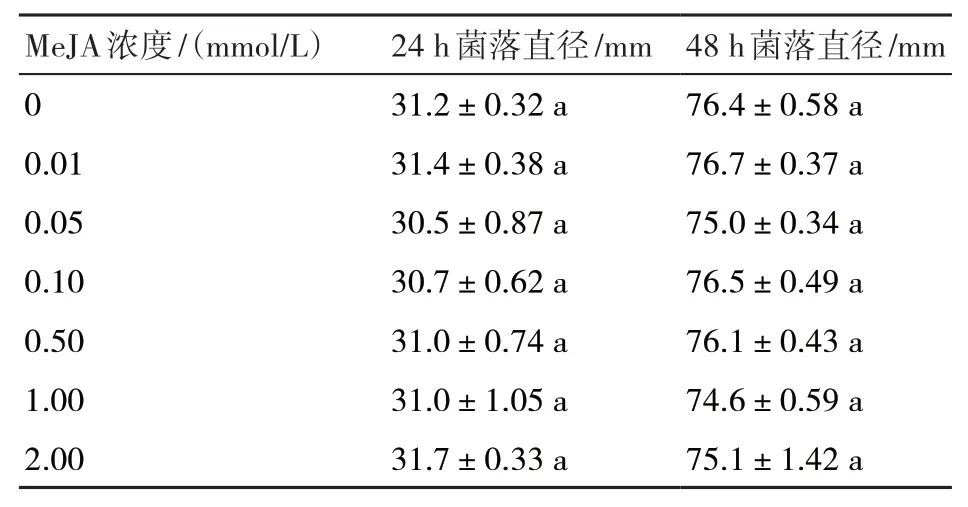
表1 不同浓度MeJA对水稻纹枯病菌菌丝生长的影响
2.2 MeJA对水稻幼苗抗纹枯病的诱导效应
使用0.01~2.00 mmol/L MeJA诱导处理均能降低水稻纹枯病病情指数,尤以0.10 mmol/L MeJA处理后的纹枯病病情指数最低,为22.96,此时诱抗效果为51.56%;0.05 mmol/L MeJA的诱抗效果次之,为43.75%,但2种浓度MeJA的诱抗效果差异不显著。此后,诱抗效果随着MeJA浓度的增加而下降,当浓度升高至2.00 mmol/L时,诱抗效果仅为7.81%,说明MeJA能诱导水稻对纹枯病产生抗性作用,且具有浓度效应(图1)。
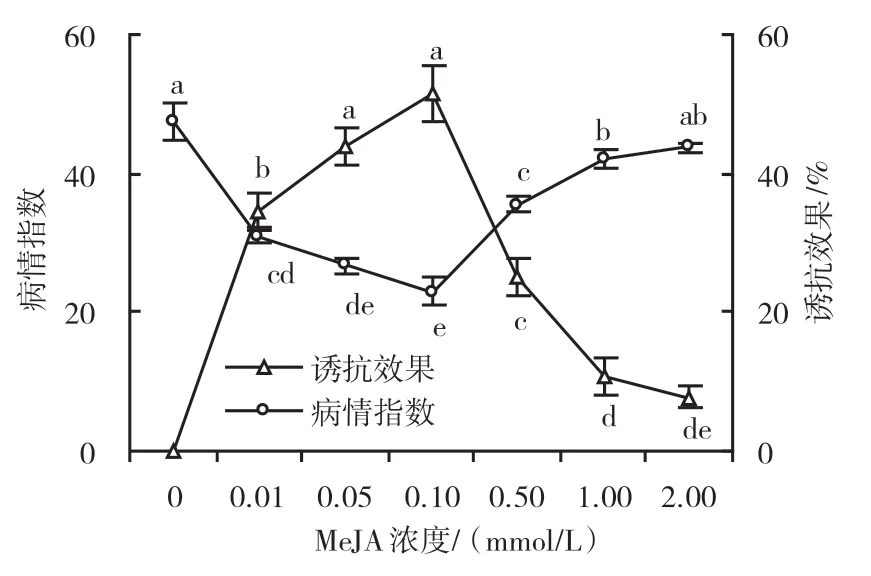
图1 不同浓度MeJA对纹枯病的诱抗效果
2.3 MeJA对水稻防御酶活性的影响
2.3.1 过氧化物酶(POD)酶活性 如图2所示,CK的叶片POD酶活性随着处理时间的推移而逐渐升高,但24 h后叶片POD酶活性变化差异不显著;T-R、T-MeJA、T-MeJA+R这3种处理方式均能显著提高水稻叶片的POD酶活性;T-R处理在24 h达到峰值,比CK提高了8%,此后POD酶活性变化差异不显著;T-MeJA、T-MeJA+R对POD酶活性的影响要远高于T-R处理,这3种处理方式均在48 h达到峰值,分别比CK提高了42%、32%和7%,3种处理对POD酶活性的影响差异显著,此后其酶活性变化呈下降趋势,但72 h后的POD酶活性变化趋于平缓;在48 h时,不同处理对POD酶活性的影响差异显著,T-MeJA和T-MeJA+R处理对POD酶活性的影响显著高于T-R处理;在96 h时,各处理后的POD酶活性仍显著高于处理前,说明外界刺激诱导效应的可持续时间超过96 h。

图2 不同处理对水稻叶片POD酶活性的影响
2.3.2 多酚氧化酶(PPO)酶活性 由图3可知,与CK相比,T-MeJA、T-R和T-MeJA+R等3种处理均能显著提升叶片PPO酶活性,叶片PPO酶活性随着时间的推移而呈现明显的先升后降的变化趋势,CK的叶片PPO酶活性随着时间的推移而逐渐升高,但48 h后的叶片PPO酶活性变化无显著差异;T-MeJA+R处理的叶片PPO酶活性在24 h达到峰值,比CK增加了70%,此后随着时间的推移而缓慢下降;T-R和T-MeJA处理的叶片PPO酶活性在48 h达到峰值,分别比CK增加了54%和64%,72 h后的叶片PPO酶活性变化趋于平缓。从整体上看,T-R处理接种纹枯病对叶片PPO酶活性的诱导效应不低于T-MeJA喷雾处理。各处理后的叶片PPO酶活性与处理前的差异显著,说明外界刺激诱导效应的可持续时间超过96 h。
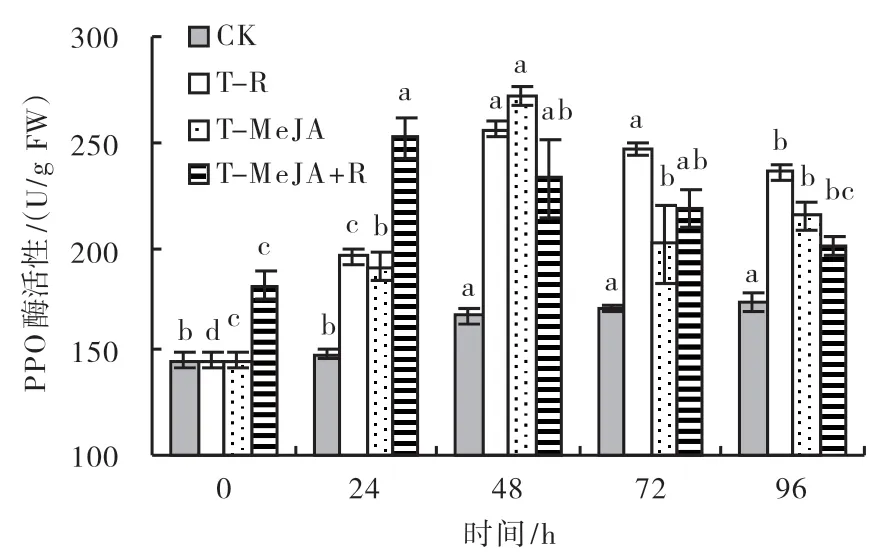
图3 不同处理对水稻叶片PPO酶活性的影响
2.3.3 苯丙氨酸解氨酶(PAL)酶活性 由图4可知,CK的叶片PAL酶活性在48 h后达到峰值,此后酶活性变化差异不显著;T-R、T-MeJA、T-MeJA+R等3种处理方式均能显著提高水稻叶片PAL酶活性,叶片中PAL酶活性在48 h达到峰值后随着时间的推移而呈下降的趋势,T-R、T-MeJA、T-MeJA+R处理的叶片PAL酶活性峰值时分别比CK提高12%、27%和46%;48 h后T-R处理的叶片PAL酶活性变化差异不显著,而T-MeJA与T-MeJA+R处理48 h后的叶片PAL酶活性呈明显的下降趋势;T-R处理方式对叶片PAL酶活性的诱导效应明显低于T-MeJA、T-MeJA+R。各处理的叶片PLA酶活性在不同时段内保持相似的变化趋势,在24~72 h之间,不同处理对叶片PAL酶活性的影响存在显著差异,以T-MeJA+R的诱导效果最强,T-MeJA次之,T-R则最弱,外界刺激诱导效应的可持续时间超过96 h。
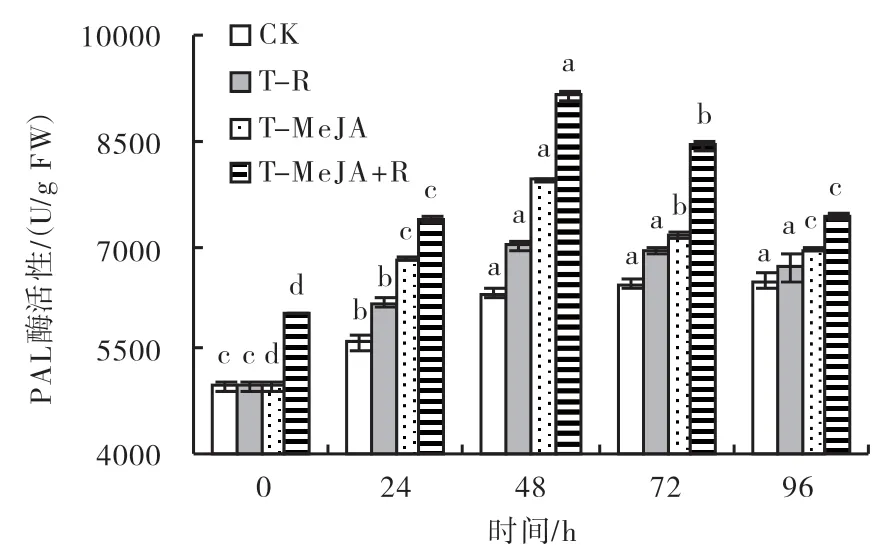
图4 不同处理对水稻叶片PAL酶活性的影响
2.3.4 过氧化氢酶(CAT)酶活性 由图5可知,CK的叶片CAT酶活性随着时间的变化而略有提高,但差异不显著;T-R、T-MeJA、T-MeJA+R等3种处理方式均能显著提高水稻叶片CAT酶活性,叶片中的CAT酶活性均呈先升后降的变化趋势,CAT酶活性在48 h达到峰值,T-R、T-MeJA、T-MeJA+R处理的叶片CAT酶活性分别比CK提高39%、61%和78%,3种处理方式对叶片CAT酶活性的影响差异显著;72 h时,T-MeJA+R处理的叶片CAT酶活性明显降低,T-R和T-MeJA处理的叶片CAT酶活性的下降趋势较为平缓。T-R处理后接种纹枯病对叶片CAT酶活性的诱导效应低于T-MeJA、T-MeJA+R处理。在96 h后,T-R、T-MeJA、T-MeJA+R各处理的叶片CAT酶活性分别比CK提高20%、40%和29%,3种处理方式对叶片CAT酶活性的影响也存在显著差异,外界刺激诱导效应的可持续时间超过96 h。
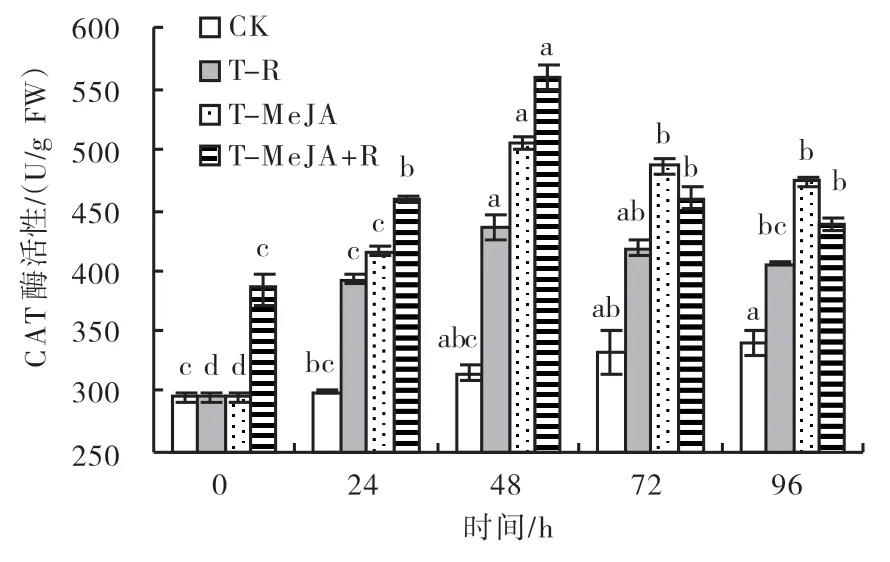
图5 不同处理对水稻叶片CAT酶活性的影响
2.3.5 超氧化物歧化酶(SOD)酶活性 由图6可知,CK叶片的SOD酶活性随时间波动变化,T-R、T-MeJA与T-MeJA+R这3种处理方式均能显著提高水稻叶片中SOD酶活性,叶片中SOD酶活性均呈先升后降的变化趋势,在48 h达到峰值,T-R、T-MeJA、T-MeJA+R这3种处理的叶片SOD酶活性分别比CK提高了34%、56%和69%,3种处理方式对叶片SOD酶活性的影响差异显著;T-R处理接种纹枯病对叶片SOD酶活性的诱导效应明显低于T-MeJA、T-MeJA+R,T-R、T-MeJA+R处理在72和96 h时的叶片SOD酶活性变化无显著差异,但仍高于CK,说明外界刺激诱导效应的可持续时间超过96 h。
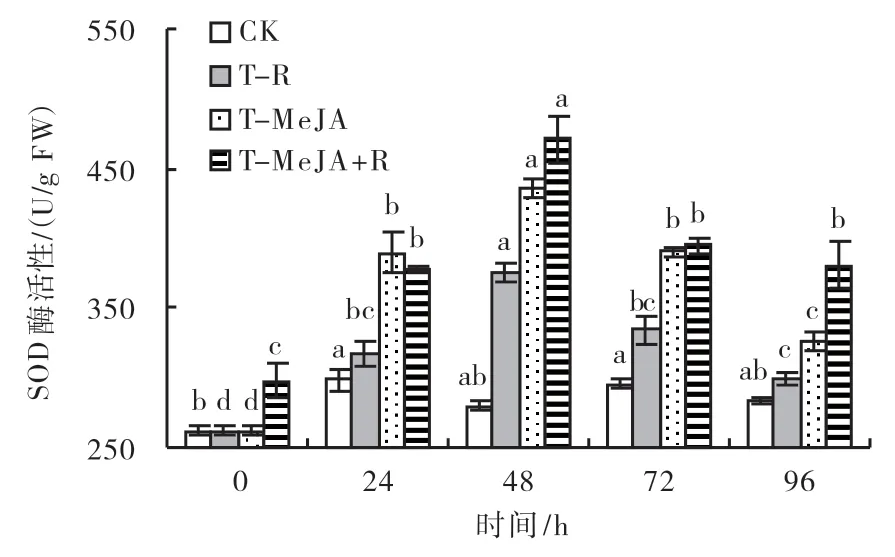
图6 不同处理对水稻叶片SOD酶活性的影响
3 结论与讨论
JAs是植物抗病信号调控网络中的重要信号分子[22],能激发植株体内处于蛰伏状态的防御系统,可诱导水稻对稻瘟病[14,23]、白叶枯病[15,24]、细菌性条斑病[25]的抗性。目前的研究表明:茉莉酸(JA)、水杨酸(SA)和乙烯(ET)3种信号途径均参与调控水稻纹枯病的抗性[3,26-30]。本研究结果显示,0.01~2.00 mmol/L MeJA对水稻纹枯病菌的菌丝生长无直接的抑制作用,但0.10 mmol/L MeJA喷雾处理可显著降低水稻幼苗纹枯病病情指数,表明一定浓度的MeJA能诱导水稻对纹枯病产生抗性。
水稻幼苗接种纹枯病菌、用MeJA诱导处理后均能显著提高幼苗叶片中POD、PPO、PAL、CAT和SOD酶活性。吴样孙等[31]用3个对纹枯病抗性不同的品种接种水稻纹枯病,PAL、PPO、POD的酶活性水平均比未接种的对照高。钟庆燕[32]用JA处理的水稻植株PAL、POD和β-1,3-葡聚糖酶活性显著增加。向妙莲等[24]用MeJA处理水稻植株后的叶片POD、CAT、SOD和PPO酶活性均有不同程度的提高,这与本研究结果一致,表明施用外源MeJA与接种纹枯病菌均能引起水稻相关防御酶活性显著升高,以此增强水稻幼苗自身防御能力,从而提高水稻幼苗对纹枯病的抗性。钟庆燕[32]用JA处理对叶片PPO酶活性却无明显的诱导作用,这可能与所用水稻的品种抗性差异有关。对同一时间内不同处理之间的差异显著性分析可知,用MeJA诱导处理或诱导处理后再接种纹枯病菌,对POD、PAL、SOD、CAT酶活性诱导效应均显著高于单独接种纹枯病,但单独接种纹枯病对叶片PPO酶活性的影响效应要高于MeJA诱导或MeJA诱导后接种纹枯病;MeJA诱导再接种纹枯病对PAL、SOD、CAT酶活性的诱导效应明显高于MeJA诱导处理,而2种处理方式在叶片POD和PPO酶活性诱导效应方面的差异不显著。
本研究发现,MeJA对室内苗期水稻纹枯病最佳诱抗效果达51.56%,诱抗持续时间超过96 h,说明MeJA诱导水稻抗纹枯病应用于实际生产的前景较好,但用相同浓度MeJA处理大田环境下苗期的水稻纹枯病抗性诱导效果却不明显。MeJA诱导水稻自身产生的纹枯病抗性较弱,且田间环境复杂多变,众多因素可以影响其信号转导,或许是田间效应不明显的主要原因。为形成具有实际生产应用价值的水稻纹枯病绿色防控产品,还需在水稻-纹枯病互作机制及其抗性调控网络的基础上,对MeJA田间应用的条件及其效果开展进一步的研究。

