饲用秸秆纤维素分解菌的分离与培养
汪 茜,周泉佚
(定西市种草饲料站,甘肃 定西 743000)
纤维素是地球上最丰富的天然有机物,也是一种极其丰富的可再生资源,广泛存在于自然界中,占植物界总碳含量的50%以上。我国的秸秆资源非常丰富,据统计,我国每年秸秆产量超过8亿t,占世界秸秆总产量的1/5[1]。但这些丰富的秸秆资源利用率非常低,主要原因是秸秆中含有大量的纤维素、木质素以及半纤维素等难以降解的成分,而且纤维素除了反刍动物可以利用部分外,猪、鸡等单胃动物都无法利用。利用化学方式处理和加工秸秆是比较普遍的做法,主要是通过酸性或者碱性的化学物质对秸秆进行处理。酸碱处理对分解玉米秸秆纤维素具有一定效果,但处理后的玉米秸秆需进行冲洗或者中和酸碱后才能饲喂或者发酵,不仅浪费了水资源,而且产生的废液也会造成环境污染。除了用酸碱处理秸秆外,生产中使用较多的化学处理方法还有氨化法,氨化后的秸秆木质纤维素被破坏,营养价值提高,但也有研究表明用尿素氨化后的秸秆残氮量较低[2],而且在生产中应用氨化法成本较高。因此,用生物方法分解秸秆纤维素已成为饲料工业研究和发展的方向之一。
目前,纤维素的利用方法主要包括传统方法和酶解方法。传统方法主要指堆肥、青贮等发酵方式[3-4]。酶解法虽然应用不广泛,但却是目前最成熟的生物降解方法,它利用某些微生物产生的纤维素酶将秸秆中的纤维素水解成纤维素二糖或葡萄糖[5-7],使纤维素进一步分解,增加可溶性糖的含量,使其更容易被家畜消化。秸秆分解过程中需要多种酶,其中纤维素酶对促进秸秆降解起着重要作用,但是自然环境中的秸秆纤维素分解菌较少,其在土壤中产生的纤维素酶活性较低,无法完全降解自然环境中的秸秆纤维素,因此添加外源秸秆分解菌成为促进秸秆纤维素降解的有效途径[8]。本研究旨在从自然腐殖土样中筛选出分解秸秆能力强且可以应用于秸秆发酵的菌株,从而为饲用秸秆中纤维素的降解提供一定理论依据。
1 材料与方法
1.1 试验材料
土壤取样:在枯枝落叶腐烂较严重处采集腐殖土,地点位于甘肃农业大学草业学院实验基地,使用土钻从地表0~20 cm处采集土壤样品,取回的土样放置于阴凉处风干,备用。
1.2 培养基
初选平板培养基为羧甲基纤维素钠培养基[9]:羧甲基纤维素钠(CMC-Na)10 g,Na2HPO42.5 g,KH2PO41.5 g,蛋白2.5 g,酵母膏0.5 g,琼脂18 g,去离子水1 000 mL。pH值为7.0~7.4。
复选平板培养基为马铃薯葡萄糖琼脂培养基(PDA):去皮马铃薯200 g,葡萄糖20 g,琼脂18 g,去离子水1 000 mL。
以上培养基均在121 ℃高温灭菌25 min后使用。
1.3 试验方法
1.3.1 菌株的分离与筛选 首先,配制羧甲基纤维素钠培养基,将其倒入培养皿中,使用前倒置1 d。将采集的腐殖土样称量10 g,倒入装有90 mL无菌水的三角瓶中,密封后将三角瓶置于摇床上振荡15 min,静置;将1 mL上清液加入装有9 mL无菌水的1号试管中,混合均匀后,将1号试管中的溶液吸取1 mL加入装有9 mL无菌水的2号试管中,依次处理3号试管,得到稀释土壤样品的浓度为10-2、10-3、10-4。将上述土壤样品稀释液均匀涂布于培养基上,每个梯度设置5个重复。接种完成后将所有培养皿倒置,并在25 ℃的培养箱中培养7 d。7 d后,将质量浓度为1 mg/mL的刚果红(CR)溶液覆盖在长出菌落的培养基上,15 min后将CR溶液倒出,再继续加入质量浓度为1 mol/L的NaCl溶液,15 min后再将NaCl溶液倒出,此时产生纤维素酶的菌落周围将会出现一个透明圈[10-13]。
菌株的初步筛选采用刚果红染色法[14]。染色结束后,在纤维素分解菌分解的位置会形成透明的水解圈,通过测量菌落直径以及透明圈直径,从而计算水解圈R(D/d),对纤维素分解菌的分解能力进行初步筛选判断。
水解圈R=透明圈直径(D)/菌落直径(d)(1)
式中,R值表示透明圈直径与菌落直径的比值,一般来讲,纤维素分解菌的降解能力与R值呈正相关关系。R值作为纤维素降解能力的参数之一,可用于初步筛选菌株是否具有降解纤维素的能力。
1.3.2 菌株的纯化 将筛选出的菌株转接到装有马铃薯葡萄糖琼脂培养基的培养皿中,继续培养7 d,重复多次进行纯化,将得到的纯菌株进行编号并保存[15]。
2 结果与分析
2.1 土样初筛结果
利用羧甲基纤维素固体培养基从腐殖土中初步分离出纤维素分解菌,经过多代分离纯化和筛选比较,得到2株具有纤维素分解能力的菌株,分别标记为F-1和F-2,2个菌株在羧甲基纤维素钠培养基上的生长速率见表1。
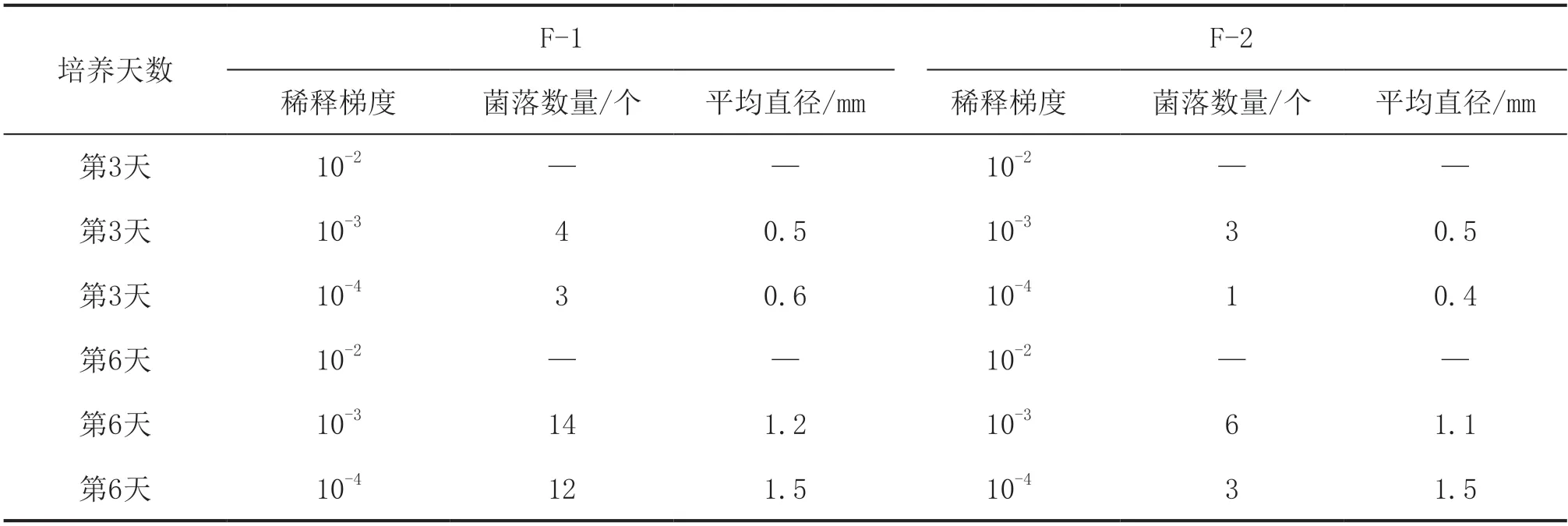
表1 菌株在羧甲基纤维素钠培养基上的生长速率
从表1可以看出,F-1和F-2在羧甲基纤维素钠培养基上都能较好地生长。土样稀释液浓度为10-3时,F-1和F-2在培养第3天时的菌落数量和菌落平均直径差别不明显,土样稀释液浓度为10-4时,F-1在培养第3天时的菌落数量比F-2多,且菌落平均直径比F-2大。从培养第6天的菌落数量来看,无论土样稀释液浓度为10-3还是10-4,2种菌株的菌落数量均发生明显变化,F-1的菌落数量明显多于F-2,但2种菌株的菌落平均直径大致相同。
2.2 刚果红染色结果
刚果红染色法基本原理是刚果红可以与培养基中的纤维素形成红色复合物,但当纤维素酶将纤维素分解后,刚果红与纤维素的复合物就无法形成,会在培养基中出现以纤维素分解菌为中心的透明圈,因此是否产生透明圈可以作为纤维素分解菌的一个初筛标准。将刚果红染液倒入含有纤维素的培养基中,再用NaCl漂洗,可以洗去结合不牢的刚果红,从而留下大大小小的透明圈。刚果红染色法处理后3个梯度的菌落及透明圈见图1。
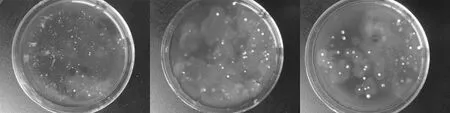
图1 不同梯度的菌落透明圈
通过刚果红染色发现,在稀释浓度为10-3和10-4的平板培养皿中,可观察到一些菌落周围有清晰的透明圈。具有清晰透明圈的菌株有2种,分别挑取这2种菌落转接于马铃薯葡萄糖琼脂培养基上进行进一步纯化。由于稀释浓度10-2过大,无法准确观察到菌落周围的透明圈,所以不作比较。结果表明,以腐殖土为材料的土壤稀释液中可提取出2株纤维素分解菌,2株菌株在不同稀释浓度下的菌落直径及菌落周围透明圈的直径比较见表2。

表2 不同稀释浓度下的菌落直径及菌落周围透明圈直径
在用刚果红染色法处理过的培养基上可以看到清晰的透明圈,通过测量不同梯度下2株菌株的菌落直径以及菌落周围的透明圈直径,可以计算出不同梯度下透明圈与菌落直径的比值,从而初步判断2株菌株对纤维素的分解能力。结果显示,在稀释浓度为10-3和10-4时,F-2的透明圈直径均比F-1的大,而且F-2的透明圈直径与菌落直径的比值也比F-1的大。综合可知,在稀释梯度为10-3和10-4时,F-2菌株对纤维素的分解能力要略强于F-1的分解能力。通过对2株菌株的比较,可以筛选出透明圈直径大、透明圈直径与菌落直径比值大的菌株。稀释梯度为10-2时,由于土壤样品的稀释浓度太大,培养出的菌落太多而连成片,不易分离和观察,因此该稀释梯度下的结果不作为考量。
3 讨论
试验结果表明通过培养基分离,纯化土壤中的纤维素分解菌的方法是可行的,得到的2株纤维素分解菌分解纤维素的能力都较强。稀释浓度为10-3时,F-1和F-2的透明圈直径与菌落直径的比值分别为8.06和10.30;稀释浓度为10-4时,F-1和F-2的比值分别为5.22和6.10。2种菌株的纤维素分解能力不同,在不同稀释浓度下F-2的分解能力均比F-1的强。
纤维素分解菌主要通过纤维素酶降解纤维素,但由于时间所限,纤维素酶的活力并未测定,因此对于纤维素分解菌对纤维素的分解能力只能通过试验中测得的2种菌株的生长速率以及透明圈直径与菌落直径的比值进行初步判断。此外,由于采集的腐殖土土样过于单一,所以得到的具有分解纤维素能力的菌株并不多,且由于对土壤样品的稀释浓度把握不准确,导致稀释浓度过大,部分菌落连成片地生长,对菌落分离、纯化产生了一定影响,干扰了试验的准确性。
分解纤维素微生物的分离纯化方法有很多,但多以羧甲基纤维素固体培养基分离为主[16-17]。近年来的研究表明,羧甲基纤维素固体培养基和赫奇逊滤纸条液体培养基在分离纤维素分解菌的过程中应用较多,但2种培养基分离出的菌株及种类存在较大差异,因此一般在试验中将2种培养基筛选方法结合应用[18]。本研究中,分离纤维素分解菌时,仅使用了羧甲基纤维素固体培养基,导致纤维素分解菌类型较少,因此在后续纤维素分解菌分离试验中应将这2种培养基分离方法结合起来,以进一步提高分离效率及准确性。
4 结论
通过对腐殖土样中的菌种进行培养、分离及多次转接纯化,并利用刚果红染色法复筛,得到了2株具有纤维素降解能力的菌株;通过透明圈直径与菌落直径比值初步分析2株菌株的纤维素降解能力,发现本试验中筛选到的F-2可以作为降解秸秆纤维素的待培养菌种资源,但其对秸秆纤维素的降解效果还需进一步研究。

