百草妇炎清栓对大鼠细菌性阴道炎的改善作用及机制 Δ
王棋 ,王鹏娇 ,孙小东 ,张敏 ,袁敏艳 ,孟小夏 ,赵燕妮 ,张硕 ,高秀丽 #(1.贵州医科大学药学院/药用植物功能与应用国家重点实验室,贵阳 550025;2.贵州医科大学微生物与生化制药工程中心,贵阳 550025;3.贵州医科大学实验动物中心,贵阳 550025)
细菌性阴道炎(bacterial vaginitis,BV)是一种妇科常见传染性疾病,因寄居于阴道的乳酸杆菌减少,而加德纳菌等厌氧菌增多,阴道内生态平衡系统受到破坏而引起[1]。BV患者若未接受及时治疗,其局部免疫功能将会下降,进而继发宫颈炎、盆腔炎等其他妇科疾病,严重影响患者的生活质量。目前,抗菌药物是临床治疗BV的主要选择,但该类药物会同时杀灭共生菌,导致菌群失调,还会因过度使用而致使病原体耐药[2]。因此,寻找有效且副作用小的替代疗法很有必要。百草妇炎清栓由苦参、百部、蛇床子、仙鹤草、紫珠叶、白矾、冰片、樟脑、硼酸组成,是基于我国传统苗医药发展而成的一种中药栓剂,民间用药历史悠久[3]。临床实践显示,百草妇炎清栓用于BV的疗效显著[4],但其具体作用机制尚不明确。
革兰氏阴性菌是妇科炎症感染的主要致病菌,其细胞壁主要成分脂多糖(lipopolysaccharide,LPS)是诱发炎症的关键因素[5]。Toll样受体(Toll-like receptor,TLR)为Ⅰ型跨膜蛋白家族受体,在非特异性或先天免疫性疾病发病过程中起关键作用[6]。研究指出,TLR2和TLR4可分别通过识别革兰氏阳性菌细胞壁主要成分肽聚糖和革兰氏阴性菌细胞壁主要成分LPS来调控下游细胞因子的合成和分泌,激活炎症相关靶基因的表达[7];同时,所有的TLR可共同激活核因子κB(nuclear factor-κB,NF-κB)通路,而NF-κB活化水平的升高会进一步导致促炎性细胞因子释放的增加,从而造成相关组织损伤[8—9]。可见,TLR/NF-κB通路与BV等妇科炎症性疾病有着密切关联[10]。本研究拟通过建立大肠埃希菌感染的BV大鼠模型,探究百草妇炎清栓对大鼠BV的改善作用,并基于TLR/NF-κB通路初步探讨其潜在作用机制,以期为该药的临床应用提供实验依据。
1 材料
1.1 主要仪器
本研究所用主要仪器包括DNP-9162型电热恒温培养箱(上海精宏实验设备有限公司),Varioskan LUX型多功能酶标仪、HM325型病理切片机(美国Thermo Fisher Scientific公司),BX43型正置光学显微镜(日本Olympus公司),JB-L5型包埋机(武汉俊杰电子有限公司),DYY-6C型电泳仪(北京六一仪器厂),MSX2型成像系统(广州市明美光电技术有限公司)等。
1.2 主要药品与试剂
百草妇炎清栓[国药准字Z20026597,批号为06210401,规格为每粒重4 g(不包括棉棒重,相当于饮片2 g)]购自贵州长生药业有限责任公司;甲硝唑阴道泡腾片(阳性对照,国药准字H20067252,批号220403,规格0.2 g)购自湖北东信药业有限公司;苯甲酸雌二醇注射液(批号211126,规格2 mL∶4 mg)购自上海全宇生物技术(驻马店)动物药业有限公司;白细胞介素13(interleukin-13,IL-13)试剂盒(货号F2961-B)购自上海泛柯实业有限公司;IL-1β、IL-2、免疫球蛋白A(immunoglobulin A,IgA)试剂盒(货号分别为ERC007、ERC001、IGA-2)均购自欣博盛生物科技有限公司;兔TLR4、NF-κB多克隆抗体(货号分别为19811-1-AP、14220-1-AP)均购自美国Proteintech公司;兔TLR2多克隆抗体(货号A20608)购自武汉爱博泰克生物科技有限公司;小鼠甘油醛-3-磷酸脱氢酶(GAPDH)单克隆抗体(货号T0004)购自美国Affinity公司;辣根过氧化物酶标记的山羊抗兔、山羊抗鼠IgG二抗(货号分别为PMK-014-090、PM-014-091)均购自武汉普美克生物技术有限公司;BCA蛋白检测试剂盒(货号PC0020)购自北京索莱宝科技有限公司。
1.3 实验动物
SPF级雌性SD大鼠,体重180~200 g,购自贵州医科大学动物中心,动物使用许可证号为SYXK(黔)2018-0001。所有大鼠均饲养于温度(22±2)℃、相对湿度(60±5)%、光照12 h/黑暗12 h的动物房内。本研究方案经贵州医科大学实验动物伦理委员会批准(编号2000351),并按照实验动物福利和动物实验伦理的相关要求进行。
1.4 细菌
大肠埃希菌(货号BNCC133264)购自商城北纳创联生物科技有限公司。
2 方法
2.1 分组、造模与给药
将雌性SD大鼠随机分为正常组,模型组,甲硝唑组,百草妇炎清栓低、中、高剂量组,每组8只。参考文献方法[11—12]复制BV模型:所有大鼠均适应性喂养1周,除正常组外其余各组大鼠均皮下注射苯甲酸雌二醇注射液0.2 g,每天1次,持续6 d,使大鼠处于假发情状态;随后,将大肠埃希菌悬液用空白培养基稀释至2×108~3×108cfu/mL(cfu即菌落形成单位),取20 μL注入大鼠阴道,每天1次,持续6 d。每天观察大鼠阴道口外观,当出现明显充血红肿,伴有大量白色黏性分泌物,且分泌物检查结果示菌株生长旺盛,即表明大鼠阴道环境已被破坏,BV模型复制成功[12]。
参考百草妇炎清栓的成人日剂量(4 g),经人与大鼠给药剂量换算后确定其低、中、高剂量组的剂量分别为0.18、0.36、0.72 g/kg(对应给药体积分别为0.16、0.32、0.64 mL/kg),栓剂于37 ℃水浴中静置,至流体状态后使用注射器经阴道给药;甲硝唑阴道泡腾片的成人日剂量为0.4 g,经人与大鼠给药剂量换算后确定其剂量为0.03 g/kg,直接经阴道给药;正常组和模型组大鼠经阴道给予生理盐水0.32 mL/kg,每天1次,持续6 d。
2.2 指标检测
2.2.1 大鼠阴道外观评分
参考李福元等[13]建立的阴道外观评分标准(表1),于末次给药24 h后对各组大鼠阴道口红肿情况和分泌物情况进行评分,所得评分越高,表明大鼠的阴道炎症越严重。

表1 大鼠阴道外观评分标准
2.2.2 大鼠阴道pH检测
末次给药24 h后,将pH试纸插入大鼠阴道口,待与阴道分泌物充分接触后迅速取出,与标准比色卡比对并记录其阴道pH。
2.2.3 大鼠阴道灌洗液中细胞因子检测
测完pH后,所有大鼠均禁食、禁水过夜。次日,用生理盐水100 μL清洗大鼠阴道3次,收集阴道灌洗液于-80 ℃保存,备用。取上述灌洗液,于室温(24±2)℃下放置30 min,在4 ℃下以3 000 r/min离心10 min,吸取上清液,采用双抗体夹心法以酶标仪检测其IL-1β、IL-2、IL-13、IgA水平,严格按照相应试剂盒说明书方法操作。
2.2.4 大鼠子宫及附件形态观察
收集完阴道灌洗液后,所有大鼠用2%戊巴比妥钠(腹腔注射)麻醉,剖开腹腔,取出子宫及附件,进行形态观察并拍照。
2.2.5 大鼠阴道组织病理学观察
取各组大鼠阴道组织,部分组织置于4 ℃的4%多聚甲醛中固定,剩余组织于-80 ℃下冻存,备用。取上述固定于多聚甲醛中的大鼠阴道组织,经脱水、常规石蜡包埋后切片(厚度3~5 μm),再经苏木精-伊红染色、脱水透明后,以中性树脂封片,使用光学显微镜观察其阴道组织病理改变。
2.2.6 大鼠阴道组织中TLR2、TLR4、NF-κB蛋白表达检测
(1)免疫组化实验:取“2.2.5”项下正常组、模型组、百草妇炎清栓中剂量组大鼠(每组8只)的阴道组织切片,每10 min用二甲苯清洗1次(共4次),再依次用100%、95%、85%、75%乙腈梯度脱水2 min,用水清洗并浸泡5 min;用乙二胺四乙酸修复15 min后,用水冲洗;滴加山羊血清封闭液(以磷酸盐缓冲液稀释),室温孵育60 min;滴加TLR2、TLR4、NF-κB一抗(稀释比例均为1∶100),于4 ℃下孵育过夜;用磷酸盐缓冲液冲洗3 min×3次后,滴加相应二抗(稀释比例为1∶200),于室温下孵育30 min;用磷酸盐缓冲液冲洗3 min×3次后,以DAB显色;用水冲洗后,以苏木精复染1~5 min;用水冲洗,固片;随机选取3个视野,使用显微镜观察上述蛋白的阳性表达情况(以黄色或棕黄色为阳性表达),并使用Image J软件分析阳性表达的平均光密度值,以反映各蛋白的表达水平。
(2)Western blot实验:取“2.2.5”项下正常组、模型组、百草妇炎清栓中剂量组大鼠(每组4只)冻存的阴道组织样品,加入RIPA裂解缓冲液适量,于冰浴中裂解30 min,以6 000 r/min匀浆10 min,再以12 000 r/min于4 ℃下离心15 min,取上清液,用BCA法测定蛋白浓度并作变性处理。取变性后的蛋白样品40 μg,经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离后以湿转法转移至聚偏氟乙烯膜上,用5%脱脂奶粉封闭2 h;加入TLR2、TLR4、NF-κB、GAPDH一抗(稀释比例分别为1∶1 000、1∶1 000、1∶2 000、1∶6 000),于4 ℃下孵育过夜;用TBST缓冲液清洗,加入相应二抗(稀释比例均为1∶6 000),于37 ℃下孵育1 h;以ECL化学发光法显影后,于成像系统下成像。使用Image J软件进行分析,以目的蛋白与内参蛋白(GAPDH)的灰度值比值作为目的蛋白的相对表达量。
2.3 统计学方法
使用SPSS 23.0和GraphPad Prism 8.0软件对数据进行统计分析和可视化展示。数据均以±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。检验水准α=0.05。
3 结果
3.1 百草妇炎清栓对BV大鼠阴道外观评分的影响
与正常组比较,模型组大鼠的阴道口红肿评分和分泌物评分均显著升高(P<0.01)。与模型组比较,各药物组大鼠上述评分均显著降低(P<0.05或P<0.01)。结果见表2。
表2 各组大鼠阴道外观评分和pH比较(±s,n=8)

表2 各组大鼠阴道外观评分和pH比较(±s,n=8)
a:与正常组比较,P<0.01;b:与模型组比较,P<0.01;c:与模型组比较,P<0.05。
阴道口红肿评分0.25±0.46 2.50±0.53a 1.13±0.64b 2.00±0.53c 0.88±0.64b 1.25±0.70b组别正常组模型组甲硝唑组百草妇炎清栓低剂量组百草妇炎清栓中剂量组百草妇炎清栓高剂量组阴道分泌物评分0.38±0.52 2.63±0.52a 0.88±0.35b 1.75±0.46b 1.00±0.53b 1.25±0.46b阴道pH 7.17±0.26 8.00±0.41a 7.53±0.31c 7.63±0.35 7.07±0.61b 7.13±0.52b
3.2 百草妇炎清栓对BV大鼠阴道pH的影响
与正常组比较,模型组大鼠的阴道pH显著升高(P<0.01)。与模型组比较,各药物组大鼠(百草妇炎清栓低剂量组除外)的阴道pH均显著降低(P<0.05或P<0.01)。结果见表2。
3.3 百草妇炎清栓对BV大鼠阴道灌洗液中细胞因子水平的影响
与正常组比较,模型组大鼠阴道灌洗液中促炎因子IL-1β、IL-2水平显著均升高(P<0.01),而IgA水平和抗炎因子IL-13水平均显著降低(P<0.01)。与模型组比较,各药物组大鼠阴道灌洗液中IL-1β、IL-2水平均显著降低(P<0.05或P<0.01),IL-13(百草妇炎清栓低剂量组除外)和IgA水平均显著提高(P<0.05或P<0.01),其中IgA的变化有较明显的剂量依赖趋势。结果见图1。
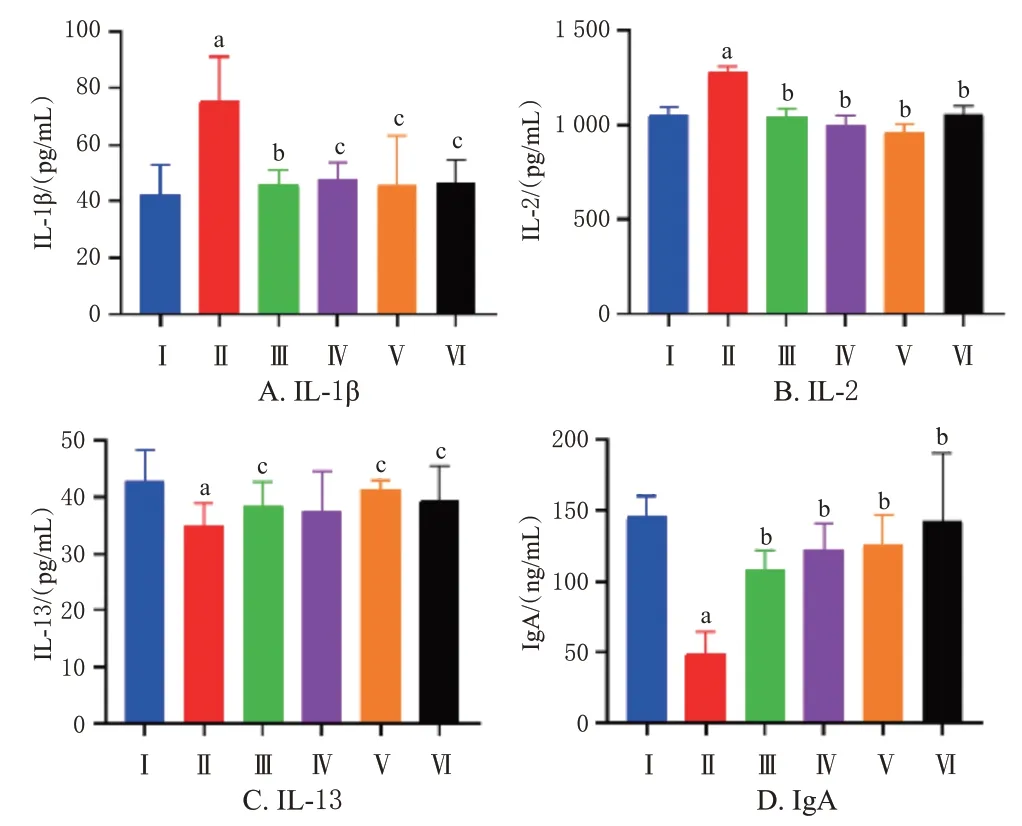
图1 百草妇炎清栓对BV大鼠阴道灌洗液中细胞因子水平的影响(±s,n=8)
3.4 百草妇炎清栓对BV大鼠子宫及附件形态的影响
正常组大鼠子宫及附件形态规则,子宫壁光滑;模型组大鼠子宫明显充血水肿,子宫及附件形状不规则,可见宫腔积液。经百草妇炎清栓治疗后,3个剂量组都有不同程度的改善,其中低剂量组依旧有些许水肿现象,中、高剂量组的干预效果最好。结果见图2(图中,各样本整体长约40 mm)。

图2 百草妇炎清栓对BV大鼠子宫及附件形态的影响
3.5 百草妇炎清栓对BV大鼠阴道组织病理形态的影响
在大肠埃希菌的感染下,模型组大鼠阴道组织除溃烂外,还可见明显的水肿增生和上皮细胞脱落,且伴有大量的炎症细胞浸润。与模型组比较,甲硝唑组大鼠阴道组织仍可见少许上皮细胞脱落;百草妇炎清栓中、高剂量组大鼠阴道组织得以明显修复,但低剂量组仍有上皮组织溃烂的情况。结果见图3。

图3 百草妇炎清栓对BV大鼠阴道组织病理形态影响的显微图
3.6 百草妇炎清栓对BV大鼠阴道组织中TLR2、TLR4、NF-κB蛋白表达的影响
(1)免疫组化实验:与正常组比较,模型组大鼠阴道组织中TLR2、TLR4、NF-κB的阳性着色均明显变深,上述蛋白的表达水平均显著升高(P<0.01);与模型组比较,百草妇炎清栓中剂量组大鼠阴道组织中TLR2、TLR4、NF-κB的阳性着色均明显变浅,上述蛋白的表达水平均显著降低(P<0.05或P<0.01)。结果见图4、表3。
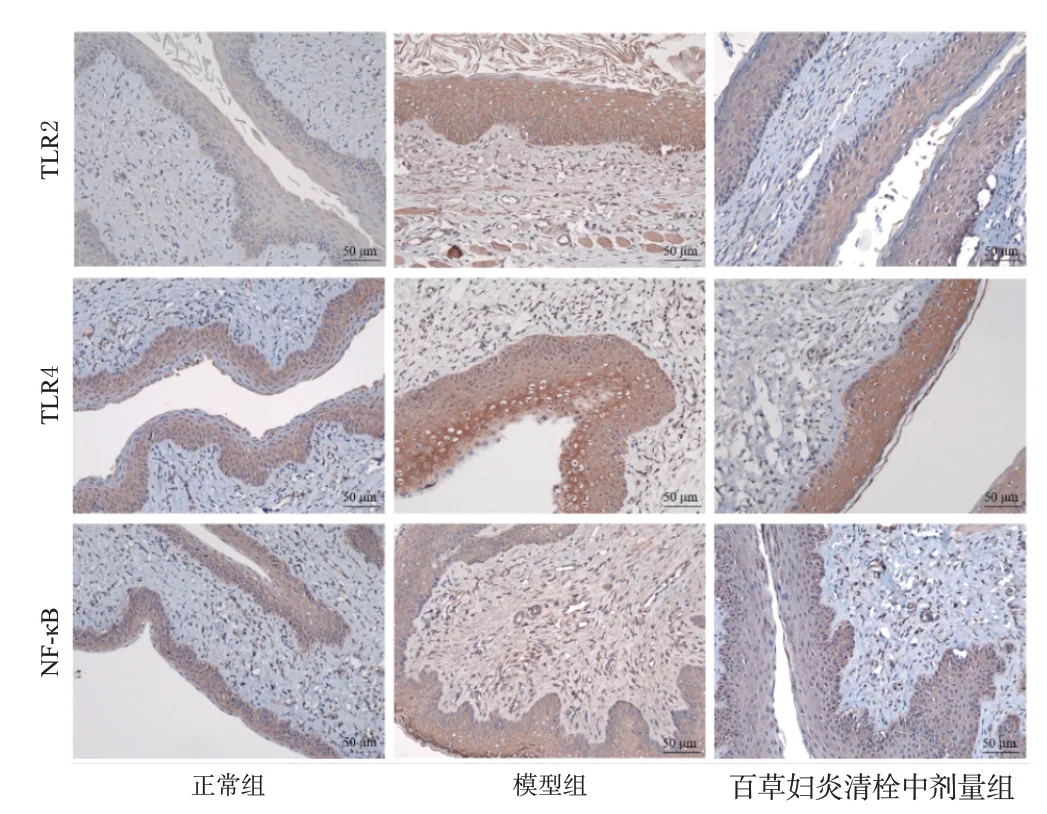
图4 百草妇炎清栓对BV大鼠阴道组织中TLR2、TLR4、NF-κB阳性蛋白表达影响的免疫组化图
表3 百草妇炎清栓对BV大鼠阴道组织中TLR2、TLR4、NF-κB阳性蛋白表达的影响(±s,n=8)
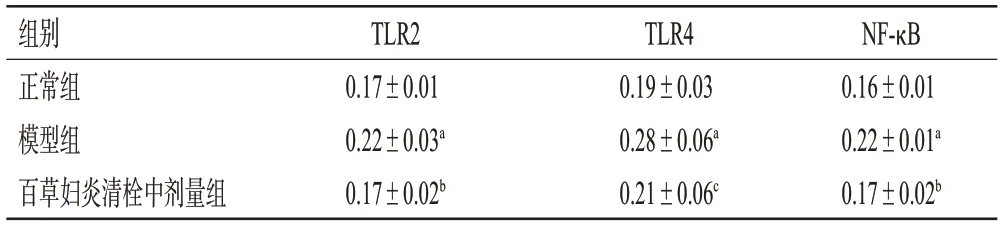
表3 百草妇炎清栓对BV大鼠阴道组织中TLR2、TLR4、NF-κB阳性蛋白表达的影响(±s,n=8)
a:与正常组比较,P<0.01;b:与模型组比较,P<0.01;c:与模型组比较,P<0.05。
TLR2 0.17±0.01 0.22±0.03a 0.17±0.02b组别正常组模型组百草妇炎清栓中剂量组TLR4 0.19±0.03 0.28±0.06a 0.21±0.06c NF-κB 0.16±0.01 0.22±0.01a 0.17±0.02b
(2)Western blot实验:与正常组比较,模型组大鼠阴道组织中TLR2、TLR4、NF-κB蛋白的相对表达量均显著升高(P<0.05或P<0.01);与模型组比较,百草妇炎清栓中剂量组大鼠阴道组织中上述蛋白的相对表达量均显著下降(P<0.05或P<0.01)。结果见图5。
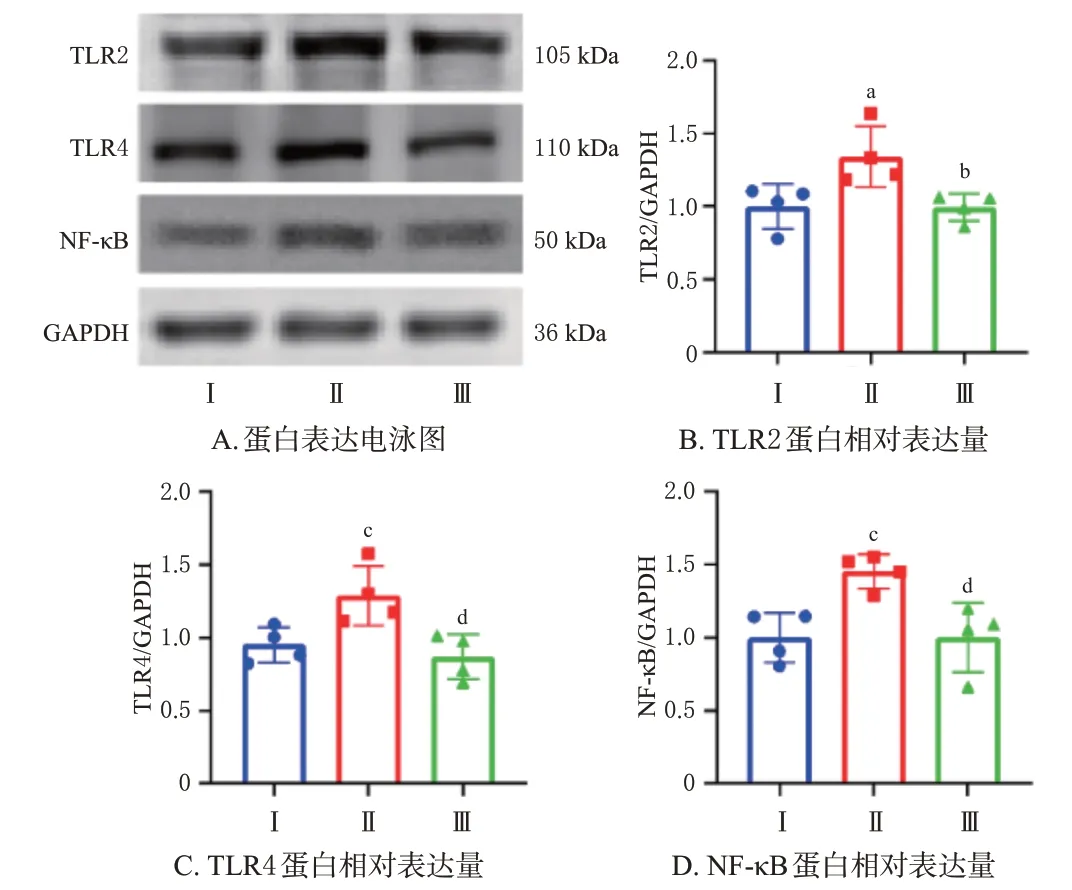
图5 百草妇炎清栓对BV大鼠阴道组织中TLR2、TLR4、NF-κB蛋白表达的影响(±s,n=4)
4 讨论
研究表明,BV的患病率逐年上升,并且在年轻群体中尤为显著[14]。抗菌药物对致病菌有较好的抑制作用,但同时也会杀死阴道益生菌,随之可能会造成病原体耐药、病情复发等不良结局[15]。中医关于阴道炎的理论和实践较为丰富,常用方剂多有清热燥湿、杀虫止痒、消腐生肌等功效。研究表明,中药栓剂用于各种妇科炎症的疗效较好,且不良反应较少,不易引起耐药,在恢复患者正常生理功能和祛除潜在病因方面具有优势[16]。本研究结果显示,百草妇炎清栓可显著降低模型大鼠的阴道口红肿评分及分泌物评分,使其阴道pH恢复正常,改善大鼠子宫及附件、阴道组织的病理损伤,提示该药对大鼠的阴道炎症有一定的干预效果。有研究指出,作为百草妇炎清栓主成分之一的苦参,因具有较强的抗炎活性,常被单独制为凝胶制剂用于治疗BV[17];除此之外,百草妇炎清栓中的百部、蛇床子、紫珠叶和仙鹤草也有一定的抗菌抗炎功效[18—20],均是该药发挥BV治疗作用的药效成分。此外本研究结果还显示,中剂量百草妇炎清栓对大鼠阴道口红肿、分泌物评分的影响更明显,笔者认为可能与高剂量组剂量偏大而对阴道黏膜产生不利影响有关。
阴道黏膜为局部免疫的重要防线之一,可通过快速脱落上皮细胞和分泌具有杀伤作用的细胞因子来抵御病原体入侵[17]。IgA附着于生殖道黏膜,具有清除病原微生物、中和毒素、阻断抗原入侵等功能[21]。本研究结果显示,各药物组大鼠受损阴道组织均有不同程度的改善,水肿增生、上皮细胞脱落、炎症细胞浸润等明显减轻,且IgA水平显著升高,提示百草妇炎清栓可通过修复细菌感染致损的阴道黏膜而恢复IgA的分泌功能,从而增强阴道局部体液免疫功能。
TLR首次在果蝇中被发现,随后TLR同源域也被证实存在于哺乳动物中[22]。TLR可识别、结合病原相关分子模式和损伤相关分子模式,从而介导免疫防御反应;当免疫应答反应过于强烈时,下游蛋白释放的促炎因子会持续释放炎症相关因子,最终造成组织炎症损伤[23]。因此,干预TLR相关信号通路、抑制免疫应答、减少炎症相关因子释放可能是炎症性疾病治疗的重要途径。髓样分化因子88(myeloid differentiation factor 88,MyD88)是TLR信号转导中的主要接头蛋白,当MyD88的碳端与TLR结合后,前者氮端(死亡结构域)可通过招募IL-1受体相关蛋白激酶,再经多个因子转化而激活NF-κB,最终诱导促炎因子IL-1β等的分泌[23]。本研究结果显示,模型组大鼠阴道灌洗液中IL-1β水平和阴道组织中TLR2、TLR4、NF-κB蛋白的表达均较正常组显著上调,提示BV可引发炎症反应,该病的发生可能与TLR/NFκB信号通路激活有关,这与已有研究的结果基本一致[6]。经百草妇炎清栓干预后,大鼠阴道灌洗液中IL-1β水平显著降低,阴道组织中TLR2、TLR4、NF-κB蛋白的表达均显著下调,提示百草妇炎清栓可能通过抑制TLR/NF-κB信号通路来减轻大鼠BV引起的炎症反应。
TLR可通过调控树突细胞或B淋巴细胞来诱导Th1/Th2分化,而Th1/Th2免疫失衡在阴道炎等妇科炎症疾病中具有关键作用[24]。IL-2为Th1细胞分泌的促炎因子,有增强自然杀伤细胞和单核巨噬细胞杀伤力的作用;IL-13是Th2细胞分泌的抗炎因子,可通过抑制Th1细胞介导的噬菌作用来增加细胞的感染易感性[17]。本研究结果表明,经百草妇炎清栓干预后,模型大鼠阴道灌洗液中IL-2水平显著降低,而IL-13水平显著提高,提示该药对Th1/Th2免疫失衡有改善作用。
综上,百草妇炎清栓对BV大鼠的炎症症状有一定的改善作用,其机制可能与抑制TLR/NF-κB信号通路有关。而百草妇炎清栓的作用机制是否还涉及其他信号通路,尚有待后续研究深入探讨。

