嵌合型猫眼综合征的产前诊断及遗传学分析
李世红 阳敏慧 卜秀芬 周霞*
(1.湖南师范大学附属长沙市妇幼保健院区域遗传性出生缺陷防控研究湖南省重点实验室,湖南长沙,410007;2.岳阳市妇幼保健院医学遗传科,湖南岳阳,414000)
猫眼综合征(cat eye syndrome,CES)因患儿大多患有虹膜缺损似猫眼而得名,又称为施-弗二氏综合征、22号染色体部分四体综合征,多以22号染色体短臂和近端长臂的部分三体或四体形成的额外小标记染色体(small supernumerary marker chromosomes,sSMC)的形式出现,是十分罕见的染色体病,在活产儿中的发生率约为1∶50000~1∶150000[1]。sSMC既是染色体结构异常,也是染色体数目异常,约70%的sSMC为新生畸变,约70%没有表型效应[2,3]。因sSMC极不稳定,在受精卵分裂间期,容易发生丢失,约50%病例以嵌合形式存在[4]。统计表明,源于22号染色体的sSMC占总数的9%[5]。虹膜缺损、肛肠闭锁和耳前赘生物是CES的典型三联征,但只在约40%患者中出现[6]。CES临床表型变异大,从严重畸形到表型正常的均有发生。产前CES无特异性的临床表型,很难在超声筛查中发现,绝大多数为出生后表现出典型或部分表型,然后通过染色体核型分析、荧光原位杂交、染色体微阵列分析等遗传学诊断技术确诊。本研究旨在对3例嵌合型CES胎儿的产前诊断和妊娠结局进行回顾性分析,以期为临床医生在产前遗传咨询嵌合型CES病例提供更多有用信息。
1 资料与方法
1.1 病例资料:获得长沙市妇幼保健院伦理委员会批准后,回顾性分析2018年至2022年间在该产前诊断中心产前诊断为CES胎儿的病历资料3例。
病例1:孕妇35岁,孕2产0,既往人流1次。本次妊娠末次月经为2020年6月15日,孕早期无先兆流产保胎史。现孕18+周,因升级版无创产前筛查(non-invasive prenatal testing,NIPT)提示22号染色体22q11.2区域存在9.67Mb重复而转至遗传优生科就诊,经知情同意后行羊膜腔穿刺术进行产前诊断。
病例2:孕妇29岁,孕3产1,既往生育一超雄综合征男孩,引产一特纳氏综合征胎儿。本次妊娠末次月经为2020年9月25日,孕早期无先兆流产保胎史。孕11周胎儿NT未见异常,孕18周超声提示胎儿右锁骨下动脉迷走。现孕19+周,因不良孕产史、超声指标异常而转至遗传优生科就诊,经知情同意后行羊膜腔穿刺术进行产前诊断。
病例3:孕妇37岁,孕7产2(人流3,宫外孕1,存2,存活儿均健康)。本次妊娠末次月经为2020年12月23日,孕早期无先兆流产保胎史,中期唐筛T21为1:275,24周系统超声未见异常。现孕26+周,因升级版NIPT提示22号染色体22q11.2存在8.5Mb重复而转至遗传优生科就诊,经知情同意后行羊膜腔穿刺术进行产前诊断。
1.2 研究方法
1.2.1 染色体核型分析 在超声引导下取孕妇羊水标本30 ml,其中20 ml用于染色体核型分析,以1200rpm/min离心10min后,收集羊水细胞,分两线进行细胞培养。待羊水细胞贴壁生长的克隆岛较多时,加秋水仙素,使染色体分裂像阻滞在有丝分裂中期,然后经低渗、固定、制片等操作后进行320 G显带染色体核型分析。
1.2.2 SNP array检测 取10 ml羊水标本,以1200rpm/min离心10min后,收集羊水细胞,采用TIANamp Micro DNA Kit试剂盒提取羊水基因组DNA。使用Affymetrix CytoScan 750K芯片对3例羊水DNA标本进行全基因组拷贝数变异(copy number variations,CNVs)变异检测,采用ChAs 4.2软件进行数据分析,对缺失>500 kb,重复大于>1 Mb的CNVs片段进行致病性分析。通过查询UCSC(https://genome.ucsc.edu/)、DECIPHER(https://decipher.sanger.ac.uk/)、ClinGen CNV(https://www.ncbi.nlm.nih.gov/projects/dbvar/clingen)、OMIM(https://omim.org/)等数据库和本实验室内部数据库,参照指南对CNVs进行判定。报告致病、可能致病和致病性意义不明CNVs。
1.2.3 随访:对所有病例进行随访,了解孕妇妊娠结局及新生儿生长发育情况。
2 结果
2.1 染色体核型结果:病例1和病例2胎儿部分核型均存在一条sSMC。病例1胎儿染色体核型结果为47,XN,+mar[34]/46,XN[26](图1A)。夫妻双方染色体核型未见异常,提示该sSMC为新生染色体畸变。病例2胎儿核型结果为:47,XN,+mar[47]/46,XN[31](图2A)。夫妻双方染色体核型未见异常,亦提示该sSMC为新发染色体畸变。病例3胎儿常规计数30个分裂相后未发现异常细胞核型,遂加大计数量。计数100个分裂相后,两线平行培养羊水均未发现异常细胞核型,确定病例3胎儿无嵌合。

图1 病例1胎儿核型和SNP-array结果

图2 病例2胎儿核型和SNP-array结果
2.2 SNP array检测结果:3个病例均携带一个致病性CNVs:病例1胎儿SNP-array结果示:arr[GRCh37]22q11.1q12.1(16888900_27744820)×2~3(图1B),即胎儿22号染色体22q11.1q12.1区域存在10.24Mb嵌合重复,嵌合比例约64%;病例2胎儿SNP-array结果示:arr[GRCh37]22q11.1q12.1(16888899_29870363)×2~3(图2B),即胎儿22号染色体22q11.1q12.1区域存在12.90Mb嵌合重复,嵌合比例约69%;病例3胎儿SNP-array结果示:arr[GRCh37]22q11.1q11.23(16888900_23629124)×2~3(图3A、图3B),即胎儿22号染色体22q11.1q11.23区域存在6.74Mb嵌合重复,嵌合比例约26%。病例3孕妇拒绝荧光原位杂交、脐血染色体核型分析等后续检测,不能确定该重复片段来源。
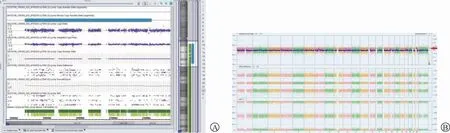
图3 病例3胎儿SNP-array结果
2.3 妊娠结局 根据胎儿染色体核型和SNP array检测结果,3例胎儿均可诊断为嵌合型CES(表1)。经遗传门诊充分咨询,病例2孕妇及家属考虑到罹患CES胎儿出生后可能存在眼部异常、肛门闭锁、耳廓畸形、智力迟钝等症状,要求终止妊娠。胎儿引产后外观无明显异常,因家属原因,未行病理解剖。经遗传咨询和夫妻双方慎重考虑后,病例1和病例3选择继续妊娠,两胎儿整个孕期超声未见结构畸形,胎儿双顶径、头围、腹围、肱骨长、股骨长等与孕周相符。孕39+2周,病例1足月顺产,分娩一女婴,身长50cm,体重3600 g,外观无异常,Apgar评分:8-9-10分。该胎儿出生后因黄疸入住本院新生儿科,经系统检查后,未发现虹膜缺损、耳前赘生物、耳道闭锁等异常表型。幼儿2周岁时,于本院儿童保健中心进行了生长发育评估,其生长发育良好,运动和语言发育正常。病例3于孕39+4周,外院顺产一女婴,出生体重3300g,身长50cm,Apgar评分:9-10分,外观无异常。分别于6月龄、1周岁和1.5周岁对该家庭进行随访,幼儿母亲表示该幼儿按时前往社区卫生服务中心体检,1岁左右开始走路,目前语言表达正常,未见猫眼综合征相关临床表现,也无特殊面容等。因路途遥远,幼儿父母拒绝来本院进行详细的生长发育评估。
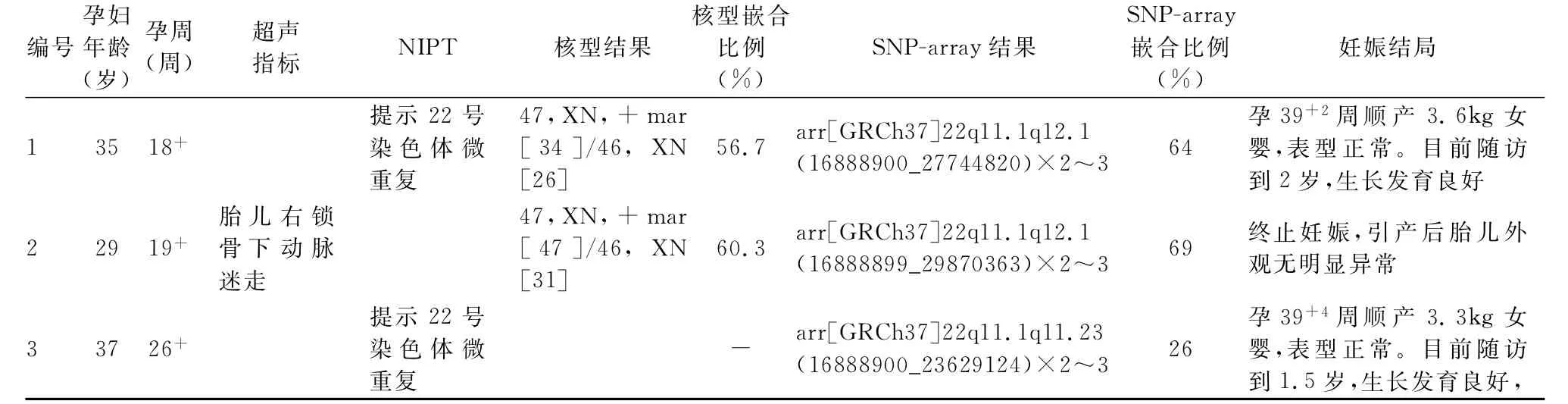
表1 三例病例的产前诊断和妊娠结局
3 讨论
自1965年首次报道以来,数百例CES病例被相继报道。CES常见的表型有耳前赘生物,肛门直肠异常,眼部缺损等[6]。Rosias[7]统计了105例CES的表型特征,发现畸形累及范围广,耳前赘生物/凹陷是CES最一致的表型特征。其次,眼部最易受影响,包括虹膜缺损、小眼、白内障、斜视和Duane眼球后退综合征等。此外,先天性心脏缺陷、肾脏和胃肠畸形亦常见。虽然先天性心脏畸形不属于CES临床典型三联征,但约60%的受累患者存在先天性心脏畸形,其中房室间隔缺损和完全性肺静脉畸形引流发生频率最高[8,9]。另一项纳入71例CES患者的病例系列研究显示,完全性肺静脉畸形引流占21%[10]。CES患儿智力发育也可能受到影响,常伴有轻度/中度或重度智力障碍(分别占病例的近50%和7%)。而在Berends[6]等统计数据显示,在32%(16/50)的病例中发现轻度至中度智力低下,并且智力迟钝在男性CES患者中更常见。产前CES病例罕见报道,绝大多数为出生后表现出典型或部分表型后确诊的。截至2022年底,sSMC数据库[11]只收录数例产前CES病例,产前超声表现为羊水过多/过少、肾脏偏小、肠袢扩张、胎儿宫内发育迟缓等。本研究中,病例1和病例3胎儿整个孕期超声均未见异常,而病例2胎儿孕中期超声提示为右锁骨下动脉迷走,表现为单个心脏超声软指标异常,未见结构畸形,单从产前超声结果很难与CES联系起来。综上可见,CES无特异性的临床表型,且一些表型在产前隐匿,很难在超声筛查中发现。
研究表明[8],22q11.1-q11.21区域是CES的关键区域,通常以部分三体或四体的sSMC形式出现。该区域包含22个基因,其中CECR1(OMIM:607575)和CECR2(OMIM:607576)基因被认为是导致CES心脏/面部和神经/眼睛表型特征的候选基因。由于22q11.2区域包含多种特殊DNA结构如LCRs、Alu序列、回文结构等,能诱发结构重排,介导拷贝数的变化,是染色体重排的易感区域,易导致包括CES、DiGeorge综合征(DiGeorge syndrome,DGS)在内的多种综合征。根据断裂点位置是否涉及DGS关键区域,CES可以分为两种类型:I型CES:不涉及DGS关键区域,断裂点位于22q11近端区域;II型CES:涵盖DGS综合征关键区域,断裂点位于22q11远端区域[12]。本文3例胎儿芯片结果均提示断裂点涉及DGS区域,为II型CES。CES形成机制复杂,只能根据sSMC的结构和来源,推测其相应的形成机制。以22号染色体部分四体sSMC形式出现的CES,是最常见的形式,其发生机制是在减数分裂I期,姐妹染色单体发生交换错误,形成U型交换,着丝粒发生横裂,形成一个主要结构是由染色体短臂构成的双着丝双随体部分四体核型[13]。以22号染色体部分三体形式出现的CES,其发生机制可能是三体自救不完全或22q11.2再发性重排所致[14,15]。本研究中,病例1和病例2胎儿均为新发的携带22号染色体22q11.1 q12.1的部分三体sSMC,根据核型和SNP-array结果推断其形成sSMC的机制可能为22号染色体三体自救合并长臂末端丢失所致。
CES临床表型变异大,从严重畸形到表型正常的均有发生,不同家系之间表型差异大,同一家系不同成员患者亦可表现出不同表型,而这种表型差异的产生可能与嵌合现象的存在有关。Kvarnung等[16]通过家系分析发现,对于嵌合型CES,不同比例的嵌合型CES患者与表型的严重程度具有正相关性,比例越高,表型越严重。而在Anguiano等[17]报道的家系中,分析了多种组织中的嵌合比例,发现同一个体,组织间比例差异大,且不同个体嵌合比例不一,但表型均正常或基本正常。可见,嵌合比例与症状严重程度无绝对的因果关系。Liehr等[18]统计了目前已报道的病例,发现约3.2%携带22号染色22q10-22q11.2区域的sSMC在临床上不显著的,表现为无症状或症状轻微发现,部分散发病例外周血淋巴细胞嵌合比例为100%,但亦无明显的CES表型。对于产前嵌合型CES,因嵌合发生的部位不同、嵌合比例不一,胎儿出生后临床表现往往难以精准预测。本研究中,病例1胎儿两种检测技术均提示嵌合,而病例3胎儿SNP-array检测结果显示低比例嵌合(比例约26%),核型未见异常,核型结果与SNP-array检测结果不一致,孕妇拒绝后续检测。核型分析细胞经体外培养后,细胞畸变、细胞优势生长等会改变异常嵌合体的嵌合比例,不能真实反映胎儿的核型情况。而SNP-array可直接对培养前细胞进行检测,能较好的反映真实的嵌合情况[19]。对于产前检出的CES嵌合体,理应选择两种及以上的技术组合,利用各技术优势互补,综合评定出最接近实际情况的结论,为孕妇的最终选择提供最科学的依据。经遗传咨询和夫妻双方慎重考虑后,病例1和病例3孕妇选择继续妊娠,俩胎儿整个孕期超声未见异常,出生后表型无异常。目前阶段性的随访情况,俩新生儿出生后生长发育可,运动和语言均发育正常。
综上所述,CES无特异性的临床表型,很难在超声筛查中发现。联合运用传统细胞遗传学和分子遗传学技术,能确定sSMC的结构及来源。对于产前诊断确诊为嵌合型CES的胎儿,若系统超声检查未见异常,胎儿预后可能较好。

