染色体微阵列芯片联合核型分析在高龄孕妇产前诊断的应用价值
李熹翀 巫玉婷 孟祥荣 刘建珍 鞠爱萍 覃燕龄(广州市花都区妇幼保健院,广东广州 510800)
随着我国生活水平不断提高,生育政策的调整以及人口结构和婚育观念的改变,35岁及以上的高龄孕妇在孕妇群体所占的比例呈上升趋势,有文献报道约占20%以上,高龄孕妇在占产前诊断比例则高达50%以上[1-2],而胎儿染色体异常与孕妇年龄呈正相关关系[3],高龄孕妇已然成为产前诊断的主要对象。目前G显带染色体核型分析技术仍然是产前诊断细胞遗传学检测的“金标准”。但染色体核型分析只能检测出染色体片段≥10Mb的异常,无法判断染色体上的微缺失、微重复以及亚端粒区的微小重排[4],存在一定局限性。染色体微阵列分析(chromosome microarray,CMA)是通过阵列比较基因组杂交或使用单核苷酸多态性阵列进行分析[5],在染色体微缺失、微重复等方面,与传统的核型分析相比,具有优势。两种方法联合诊断,对提高产前诊断效率和准确性有积极意义[6]。为了进一步分析高龄孕妇胎儿染色体异常的发生情况,本研究通过对CMA联合核型分析在广州市花都区高龄孕妇检出效率进行评估分析,为遗传咨询、产前诊断提供资料和临床诊断技术的应用提供科学依据。
1 对象与方法
1.1 研究对象 收集2020年1月至2023年3月在广州市花都区妇幼保健院产前诊断中心(广州花都区唯一具有产前诊断资质的医院)经羊膜腔穿刺采集羊水、脐带血或绒毛进行染色体核型分析或染色体微阵列芯片的孕妇共2175例(羊水1904例、脐带血17例、绒毛254例),均签署知情同意书,其中35岁及以上高龄孕妇共969例(羊水919例、脐带血1例、绒毛49例)。
1.2 研究方法
1.2.1 染色体核型分析 对羊水、绒毛、脐带血标本进行双线培养,收获以及制片,行G显带检测,染色体异常的分析和描述标准依照《人类细胞遗传学国际命名标准2016版》。
1.2.2 CMA检测 将羊水、绒毛、脐带血样本外送到广东省妇幼保健院医学遗传中心,行DNA提取后用PCR方法扩增,随后对羊水、绒毛、脐带血DNA进行酶切消化、纯化以及片段化处理,行杂交、标记和洗涤,采用美国Affymetrix公司的Cytoscan 750K Array微阵列芯片对拷贝数变异进行分析,以≥100kb(Marker≥50)分辨率分析基因组拷贝数变异(CNV);以≥5Mb(Marker≥50)分析纯合区域(ROH),通过本地化数据库、文献报道和公共在线公共数据对染色体异常情况进行分析。对所检出CNVs的结果判读根据美国医学遗传学与基因组学会指南分为5级:①致病性CNVs(pathogenic CNVs,pCNVs);②可能致病性CNVs(likelypathogenic CNVs);③临床意义不明CNVs(variants of unknown significance CNVs,VOUS CNVs);④可能良性CNVs(1ikely benign CNVs);⑤良性CNVs(benign CNVs)。
1.2.3 统计学方法 使用Excel表格对初始数据进行录入和整理,采用SPSS 23.0统计软件对数据进行分析处理。计数资料以例数(百分率)[n(%)]描述,组间比较使用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 染色体核型分析结果 所收集的948例高龄孕妇胎儿染色体核型分析正常为859例,异常核型为39例,多态性为50例,核型异常检出率为4.11%(39/948),染色体多态性为5.27%(50/948),详见表1。

表1 高龄孕妇不同类型标本的染色体核型分析异常结果检出率情况[例(%)]
2.2 染色体核型分析异常结果情况 将89例染色体核型异常结果按标本类型和染色体异常分类列出,羊水和绒毛标本的染色体数目异常共23例、嵌合体异常共3例、罗氏易位共2例、平衡性易位共6例,染色体多态性共50例,其他结构异常共5例,详见表2。

表2 89例染色体核型分析异常结果情况
2.3 CMA结果 所收集的607例高龄孕妇胎儿CMA正常为561例,异常为46例,异常检出率为7.58%(46/607),其中羊水标本6.91%(39/564)、脐带血0.00%(0/0)、绒毛16.28%(7/43),详见表3。
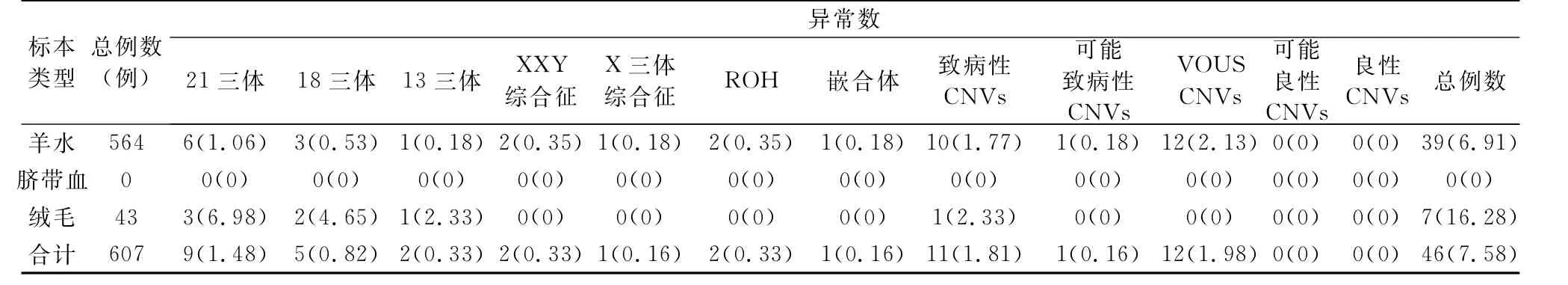
表3 高龄孕妇不同类型标本的CMA异常结果检出率情况[例(%)]
2.4 高龄孕妇胎儿核型分析与CMA异常检出率染色体核型分析异常检出率(4.11%)低于CMA异常检出率(7.58%),两者差异具有统计学意义(χ2=8.595,P=0.003)。
2.5 高龄孕妇胎儿CMA联合核型分析异常检出率 染色体微阵列芯片联合核型分析用于586例高龄孕妇产前诊断的异常检出率为8.53%(50/586),详见表4,高于染色体核型分析的异常检出率(4.11%,详见表1),这两者差异具有统计学意义(χ2=12.937,P=0.000)。染色体微阵列芯片联合核型分析用于高龄孕妇产前诊断的异常检出率(8.53%,详见表4)高于染色体微阵列芯片的异常检出率(7.58%,详见表3),这两者差异不具有统计学意义(χ2=0.367,P=0.545)。

表4 高龄孕妇不同类型标本的CMA联合染色体核型分析异常结果检出率情况[例(%)]
2.6 CMA正常但核型分析异常和多态性的胎儿检测结果 在586例高龄孕妇胎儿CMA联合核型分析检测中,有6例CMA正常但核型分析异常的胎儿结果均是平衡性易位、倒位、罗氏易位等异常,有35例CMA正常但染色体多态性,详见表5。

表5 41例CMA正常但核型分析异常和多态性的胎儿检测结果情况
2.7 CMA异常但核型分析正常的胎儿检测结果 在586例高龄孕妇胎儿CMA联合核型分析检测中果,,有其1中7 1例6 C例M异A常异是常片但段核大型小分均析正是常在的10胎9k儿b结~3.38Mb之间的微缺失和微重复,还有1例异常是片段大小20.4Mb的重复,详见表6。
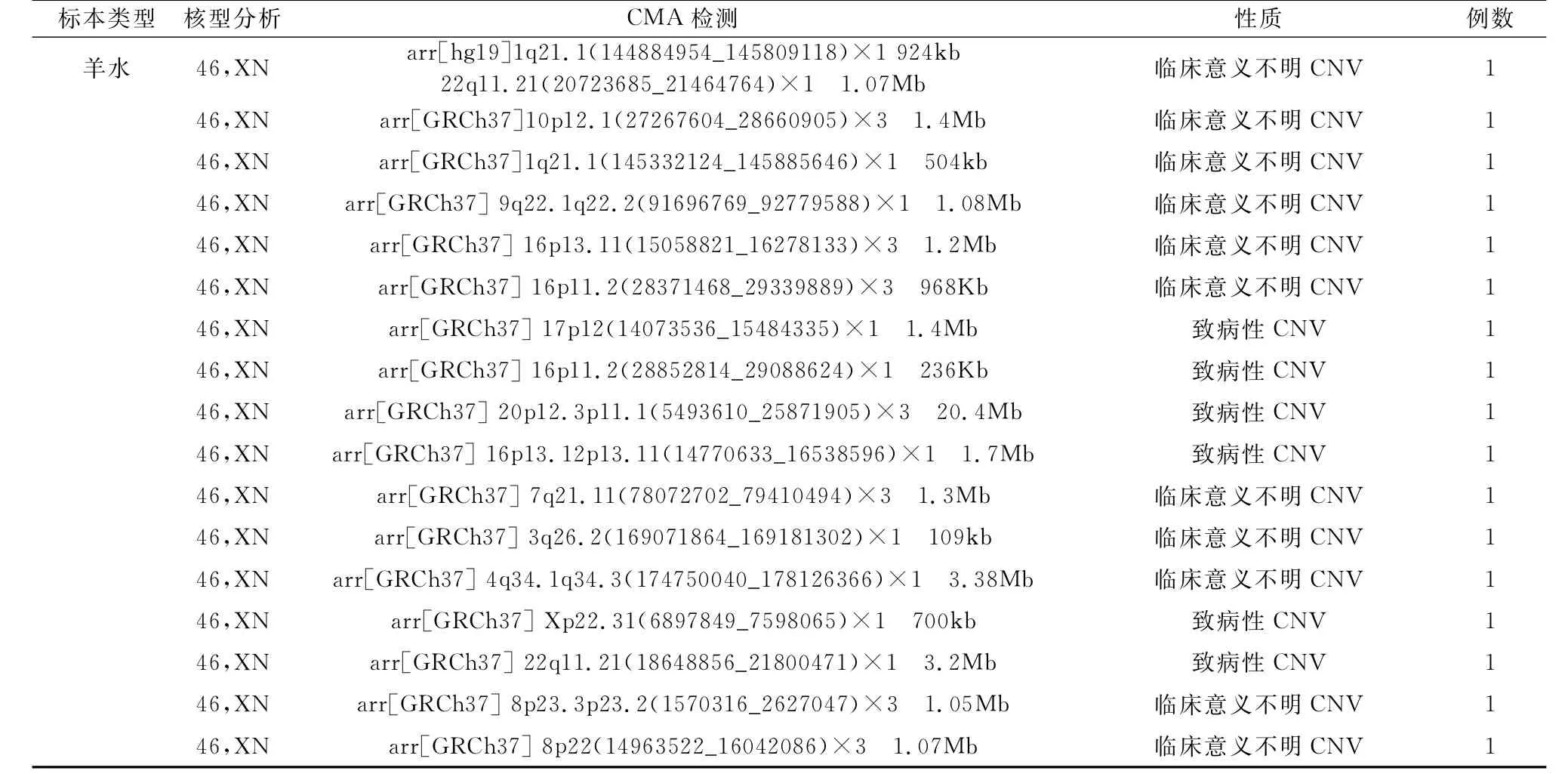
表6 17例CMA异常但核型分析正常的胎儿检测结果情况
2.8 CMA和核型分析检测均异常的胎儿检测结果 在586例高龄孕妇胎儿CMA联合核型分析检测中,有27例CMA和核型分析检测均异常的胎儿结果,其中染色体21三体(9例)、18三体(5例)、13三体(2例)、克氏综合症(2例)、超雌综合征(1例)、性染色体嵌合体(1例)、>10M缺失与重复(3例)两种方法结果基本一致,还有4例异常结果不一致,详见表7。

表7 27例CMA和核型分析检测均异常的胎儿检测结果情况
3 讨论
在2020年1月至2023年3月间收集的产前诊断标本中脐带血标本只有1例高龄病例,可能原因是高龄是做产前诊断重要的高危因素,而脐带血标本基本上都是孕晚期才采集,一般有高龄这一高危因素的孕妇大部分会在孕12周到26周时选择做绒毛或羊水的产前诊断检测。本研究中35岁及以上的高龄孕妇占花都区产前诊断孕妇的比例为44.55%(969/2175),其中高龄孕妇胎儿的染色体核型分析异常检出率为4.11%,低于唐艳[7]等人研究的8.2%,染色体微阵列芯片分析的异常检出率为7.58%,高于文献报道的2.89%[8]。高龄孕妇胎儿染色体多态性和异常结果中的平衡性易位、倒位、罗氏易位等异常占6.12%(58/948),超过核型分析异常率4.11%,说明染色体多态性、平衡性易位、倒位、罗氏易位在高龄孕妇群体中染色体异常较为常见,而CMA无法检测这些异常[9],染色体多态性、平衡性易位、倒位、罗氏易位等异常也与生殖、不孕不育、不良孕产等都有一定关系[10-11],因此,核型分析在这一方面上能很好弥补CMA的局限性,它们联合使用能显著提高染色体异常检出率及准确率。
本研究中,在586例高龄孕妇不同类型标本的CMA联合染色体核型分析中,有6例CMA正常但核型分析结果异常均是平衡性易位、倒位、罗氏易位等,有35例CMA正常但染色体多态性,详见表4、表5,与文献报道的CMA无法检测出染色体多态性、平衡性易位、倒位、罗氏易位相符合[9]。在CMA检测异常但核型分析结果正常的17例中,我们可以看到其中16例的异常片段大小是在109kb~3.38Mb之间,与Wang J[4]等人研究报道相符合,核型分析无法检测低于5Mb的片段。但有1例是广东省妇幼保健院CMA检测出致病性CNV,在染色体20p12.3-p11.1位置发生重复,片段大小约20.4Mb,而核型分析没检测出来,详见表6。随后该孕妇去中山大学附属第一医院行脐血染色体核型检查(47,XN,+mar[30]/46,XN[30])和羊水CMA检测(arr[GRCh37]20p12.3p11.1(5505817_26305566)×2.6~2.8,提示嵌合,嵌合比例约为60%~80%)。该病例中染色体核型分析和CMA检测手段的主要区别是核型分析对羊水进行培养,在培养过程中,会出现细胞优势生长等情况。细胞优势生长指如果原始羊水中存在两种不同核型,而且比例不同的两种细胞时候,细胞生长多和快的就成为优势细胞,在培养过程中优势生长,而比例较少的另一种细胞受到抑制,出现了两种细胞核型培养前后比例不一致的情况,该病例中羊水46,XN核型细胞为优势生长细胞,异常核型细胞由于生长过少,在细胞收获与制片过程中无法得到异常核型,因此造成羊水染色体核型分析技术对嵌合异常的漏检,而脐带血染色体检测出来的嵌合的准确率更高,且一般为真性嵌合[12],所以中山大学附属第一医院的脐血染色体能检测出嵌合异常。而CMA对未经培养的羊水细胞进行检测,较需要进行培养的羊水染色体核型分析更能反映羊水细胞的真实情况,但该技术对嵌合体也存在一定的局限性,该技术对≤30%的低比例嵌合容易漏诊。所以广东省妇幼保健院CMA与本院的核型分析虽然各自对该病例的嵌合异常都发生了漏检,但由于这两种方法联合检测,给临床医生和实验室进行互相验证与提醒,从而避免了遗传缺陷患儿的出生,该病例的孕妇最终选择了引产。如果只做其中一项,尤其是如果当时只做核型分析的话,就很容易发生漏检,使得该遗传缺陷的患儿出生。如果该患儿出生,对于医院、对于患儿、对于孕妇家庭来说都是相当沉重的打击。
在27例CMA和核型分析检测均异常的病例中,染色体21三体(9例)、18三体(5例)、13三体(2例)、克氏综合症(2例)、超雌综合征(1例)、性染色体嵌合体(1例)、>10M缺失与重复(3例)等异常在CMA与核型分析两个检测方法中结果是基本一致的,剩余4例异常结果不一致的病例中,CMA均没检测出染色体多态性、平衡易位与罗氏易位等异常,与张金花[13]等人研究相符,详见表7。而在4例核型分析没检测出的异常中,有2例分别是2.8Mb大小的CNVs和609kb大小的CNVs,染色体微缺失/微重复改变了正常基因组部分片段的拷贝数,<10Mb的重复核型分析无法测出,而CMA技术可以一次性分析大量的基因组序列,实现了对全基因组的均匀覆盖,可对全基因组内的微缺失/微重复区域同时进行检测,对于CNVs的诊断存在明显优势[14]。有1例是CMA检测出12p四体嵌合体,而染色体核型分析没发现嵌合异常,很可能也是因为培养过程中绒毛细胞选择性生长原因,造成漏检。还有1例是CMA提示16号染色体单亲二体(LOH/UPD),而核型分析由于单亲二体只是部分片段均遗传自父母中的一方,不携带另一方的拷贝,导致隐性遗传病患病风险增加,在染色体形态学中并无肉眼可见的异常变化,因而无法测出,这与王晔[15]等人研究中2例16号染色体单亲二体(LOH/UPD)核型分析正常相符,因此CMA是单亲二体等异常检测的一种准确有效的诊断方法,也大大提高了UPD在产前胎儿中的检出率。最后该胎儿正常分娩,经随访小孩发育良好,并无明显异常。
染色体微阵列芯片联合核型分析用于高龄孕妇产前诊断的异常检出率(8.53%)分别高于染色体核型分析、染色体微阵列芯片的异常检出率(4.11%,7.58%)。染色体核型分析主要检测>10Mb以上的大片段结构畸变,并可发现染色体多态性、平衡性易位、倒位、罗氏易位等异常;而CMA可检查>50kb以上的微重复/微缺失,并可识别嵌合体、LOH/UPD等,这两者各有优势和局限性。
综上所述,随着高龄孕妇比例不断上升,染色体微阵列芯片+核型分析联合诊断高龄孕妇胎儿显得至关重要。这两种方法对较高比例嵌合体及非整倍体染色体异常均可以检出,脐带血标本的核型分析技术在鉴别真假嵌合方面更优于羊水和绒毛标本的核型分析技术[12]。对于在高龄孕妇染色体异常中占比超过一半的多态性、平衡性易位、倒位、罗氏易位则只有核型分析可以检出,而微缺失、微重复、单亲二体(LOH/UPD)等异常只有CMA可以检出,因此两种方法联合应用能互为验证,互相补充不同种类的异常核型,使检测结果更加准确与精确,能显著提高产前诊断的异常核型检出率,从而避免了漏诊风险,为胎儿预后评估及夫妻再生育提供科学依据,对降低出生缺陷患儿具有重大的社会效益。

