LDHA抑制剂与靶向药物联用协同抑制延胡索酸水合酶缺陷型肾癌细胞增殖
洪奕伦,王建丰,张 进
(上海交通大学医学院附属仁济医院泌尿科,上海 200127)
2016年世界卫生组织的肾脏肿瘤分类首次提出了遗传性平滑肌瘤病及肾细胞癌综合征(hereditary leiomyomatosis and renal cell carcinoma,HLRCC)相关性肾癌这一分类,HLRCC是一种罕见的常染色体显性遗传病,由延胡索酸水合酶 (fumarate hydratase,FH)基因胚系突变所致[1-2],临床特征表现为多发的皮肤平滑肌瘤、女性多发子宫肌瘤及早发的侵袭性肾癌[3]。由于HLRCC相关性肾癌与FH基因体系突变肾癌均具有侵袭性高、预后差等生物学行为,2022年世界卫生组织(World Health Organization,WHO)肾脏肿瘤分类第五版[4]将二者统称为FH缺陷型肾癌。目前对于FH缺陷型肾癌尚无有效根治手段,且对于晚期转移患者也无统一治疗方案。本文通过RNA-seq、RT-qPCR及免疫组化染色等实验发现乳酸脱氢酶A(lactate dehydrogenase A,LDHA)在FH缺陷型肾癌中高表达,且LDHA抑制剂[(R)-GNE-140]处理FH缺陷型肾癌细胞具有明显抑制肿瘤细胞增殖的作用,因此我们提出了抑制LDHA是FH缺陷型肾癌潜在治疗方式的假设。然而,目前尚无LDHA抑制剂及其联合肾癌靶向药物应用于FH缺陷型肾癌的相关性研究,故本文将探索LDHA抑制剂及其联合靶向药物在FH缺陷型肾癌细胞中的作用,为FH缺陷型肾癌新的治疗方式提供参考。
1 材料与方法
1.1 实验材料FH缺陷型肾癌细胞UOK262和CL19按既往文献报道方法培养[5]。体积分数为10%的胎牛血清、谷氨酰胺、丙酮酸及DMEM培养基均购自美国Gibco公司。组织标本取自上海交通大学附属仁济医院泌尿外科2016—2019年间进行肾癌手术的患者(研究通过仁济医院伦理委员会批准,患者均签署知情同意书),2例男性,4例女性,年龄19~71岁,平均年龄45岁,肾癌临床分期采用美国癌症联合委员会(American Joint Committee on Cancer,AJCC)分期第8版,Ⅰ期2例,Ⅱ期1例,Ⅲ期3例,其中3例经病理及基因检测确诊为FH缺陷型肾癌,3例为Ⅱ型乳头状肾癌(FH缺陷型肾癌最常见的病理类型为乳头状Ⅱ型),取癌组织及癌旁组织进行检测分析。HiScript®Ⅲ逆转录试剂盒和实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)试剂盒购自南京诺唯赞生物科技公司,LDHA抗体购自美国Abcam公司;(R)-GNE-140、卡博替尼购自美国MCE公司,阿昔替尼、舒尼替尼、索拉非尼、培唑帕尼、依维莫司购自美国Selleck公司,磺酰罗丹明B购自美国Sigma公司。
1.2 实验方法
1.2.1FH缺陷型肾癌组织RNA-seq测序 RNA高通量测序由北京迈基诺基因科技公司(中国)进行检测。首先用Trizol试剂从组织中提取总RNA,并使用Agilent 2100 Bioanalyzer生物分析仪测量所得RNA的完整性和总量。使用Illumina平台进行RNA文库构建,后用Illumina NovaSeq 6000进行测序,并产生150 bp配对末端读数。测序片段被高通量测序仪测得,图像数据经CASAVA 碱基识别转化为序列数据(reads),使用HISAT2 (v2.0.5) 将配对末端clean reads 与参照基因组比,Feature Counts(1.5.0-p3)用于计算映射到每个基因的读数,使用DESeq2 软件(1.20.0)进行两个比较组合之间的差异表达分析。
1.2.2实时荧光定量PCR检测FH缺陷型肾癌组织LDHA mRNA表达 由于FH缺陷型肾癌组织样本数量有限,取上述FH缺陷型肾癌和Ⅱ型乳头状肾癌组织及癌旁组织各2例,采用Trizol法研磨提取组织总RNA,HiScript® Ⅲ逆转录试剂盒逆转录合成cDNA并以cDNA为模板采用实时荧光定量PCR试剂盒(ChamQ Universal SYBR qPCR Master Mix,南京诺唯赞生物科技公司)检测LDHA mRNA的表达水平。LDHA以β-actin作为内参,引物均由上海派诺森生物科技公司合成,LDHA的正向引物5′-GGTTGGTGCTGTTGGCATGG-3′,反向引物5′-TGCCCCAGCCGTGATAATGA-3′;β-actin的正向引物5′-TCCTATGTGGGCGACGAG-3′,反向引物:5′-ATGGCTGGGGTGTTGAAG-3′。β-actin作为内参对照,采用2-△△Ct方法检测LDHA mRNA的相对表达量。
1.2.3FH缺陷型肾癌组织LDHA免疫组织化学染色 将1.2.2中的2例FH缺陷型肾癌组织及1例正常肾脏组织进行石蜡包埋及组织切片,经过切片水化、抗原修复、内源性过氧化物酶消除、抗原封闭步骤后,再使用LDHA一抗和二抗孵育、DAB显色和苏木精复染以检测FH缺陷型肾癌组织切片中LDHA基因的蛋白表达情况。
1.2.4FH缺陷型肾癌细胞株功能实验 使细胞处于对数期生长,消化、离心后加入适量培养基重悬细胞,细胞计数后以每孔90 μL种于96孔板中,其中UOK262细胞5 000个/孔,CL19细胞3 000个/孔,12 h后细胞完全贴壁后加入药物。药物包括LDHA抑制剂(R)-GNE-140,上市靶向药物6种(阿昔替尼、卡博替尼、舒尼替尼、索拉非尼、培唑帕尼、依维莫司),药物母液浓度为10 mmol/L,LDHA抑制剂首浓度100 μmol/L,靶向药物首浓度为10 μmol/L(依维莫司为1 μmol/L),以2倍梯度稀释(依维莫司为10倍梯度稀释)药物,6个梯度配置药物,用排枪每孔加入10 μL不同浓度的药物,每个浓度设置3个副孔,对照孔加入等量的生理盐水,混匀后放于细胞培养箱孵育72 h。
根据单药实验结果,选用0.5 μmol/L阿昔替尼、0.5 μmol/L索拉非尼、0.01 μmol/L依维莫司、5 μmol/L卡博替尼、10 μmol/L培唑帕尼、3 μmol/L舒尼替尼与LDHA抑制剂进行初步联用,LDHA抑制剂初始浓度为20 μmol/L,2倍梯度稀释药物设置6个梯度。进一步根据LDHA抑制剂与靶向药物单浓度联合用药结果,对LDHA抑制剂与卡博替尼、索拉非尼、培唑帕尼分别各进行10∶1、1∶1、1∶10等比例浓度联用,初始浓度为20 μmol/L或2 μmol/L,2倍梯度浓度稀释药物5个梯度配置药物,加药混匀后放于细胞培养箱孵育72 h。
72 h后用磺酰罗丹明B(Sulforhodamine B,SRB)比色法染色:首先每孔加100 μL 4 ℃预冷10%三氯乙酸(Trichloroacetic acid,TCA),4 ℃冰箱固定1 h,用去离子水洗板5遍,室温晾干。后加SRB染液染色30 min,然后用1%冰醋酸冲洗96孔板,室温晾干。最后每孔加100 μL非缓冲Tris-base碱液,用酶标仪以560 nm波长,空白孔调零,检测96孔板吸光度(A)值。计算细胞抑制率并绘制抑制率曲线。
1.2.5药物联合指数计算 SRB法检测LDHA抑制剂单独用药及LDHA抑制剂联合靶向药物用药对FH缺陷型肾癌细胞生长的抑制率,并将计算得到的存活率用联合用药软件CompuSyn分析处理,计算最佳药物联合指数(combination index,CI)。CI<1提示两药存在协同作用,CI>1提示两药存在拮抗作用。

2 结 果
2.1 RNA-seq、RT-qPCR及免疫组化染色结果FH缺陷型肾癌组织RNA表达情况测序分析结果显示,在FH缺陷型肾癌组织中LDHA的表达高于癌旁组织的表达(P=0.045),且显著高于Ⅱ型乳头状肾癌组织(P=0.020)及其癌旁组织(P=0.041)中的表达(图1A)。

A:RNA-seq结果显示FH缺陷型肾癌组织中LDHA的表达显著升高;B:RT-qPCR结果显示FH缺陷型肾癌组织中LDHA mRNA的相对表达量显著升高。
采用RT-qPCR对FH缺陷型肾癌组织中LDHA表达情况进一步验证,实时荧光定量PCR结果显示,FH缺陷型肾癌组织中LDHA mRNA的相对表达量(3.42±0.24、4.92±0.39),Ⅱ型乳头状肾癌组织中为(0.51±0.03、0.53±0.02),FH缺陷型肾癌组织中LDHA mRNA的相对表达量显著高于Ⅱ型乳头状肾癌及癌旁组织(P<0.001,图1B)。我们进一步利用免疫组化染色对FH缺陷型肾癌组织中LDHA的蛋白表达水平进行检测,结果显示FH缺陷型肾癌组织中LDHA染色呈强阳性,而正常肾脏组织呈弱阳性(图2),进一步证实了FH缺陷型肾癌组织中LDHA蛋白表达上调。上述RNA-seq、RT-qPCR及免疫组化染色的实验结果均验证了FH缺陷型肾癌组织中LDHA的高表达,提示LDHA可能在FH缺陷型肾癌中发挥重要作用。
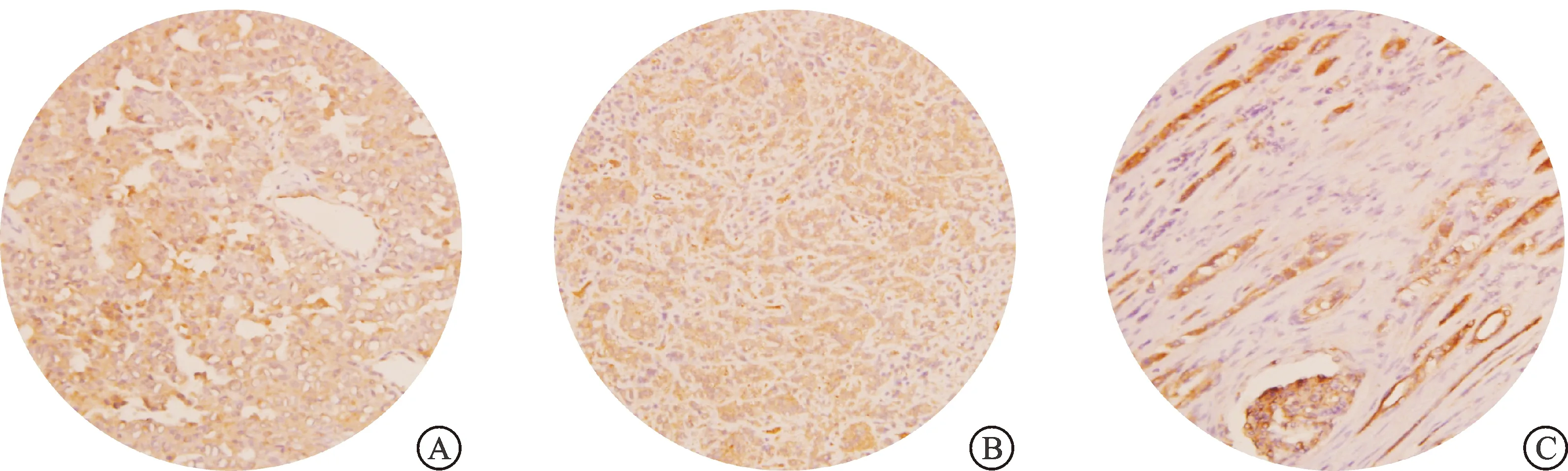
A:FH缺陷型肾癌组织-1;B:FH缺陷型肾癌组织-2;C:正常肾组织。
2.2 LDHA抑制剂及靶向药物对FH缺陷型肾癌细胞的增殖有明显抑制作用我们应用LDHA抑制剂(R)-GNE-140及肾癌上市靶向药物处理FH缺陷型肾癌细胞。细胞增殖实验结果显示LDHA抑制剂(R)-GNE-140可有效抑制FH缺陷型肾癌细胞UOK262和CL19的增殖(图3A),其IC50分别为49.35 μmol/L和52.44 μmol/L。而在靶向药物组中,我们发现卡博替尼、索拉非尼及舒尼替尼对UOK262和CL19细胞增殖均有明显抑制作用。在CL19组中,各靶向药物IC50分别为舒尼替尼6.37 μmol/L、卡博替尼8.26 μmol/L、索拉非尼11.28 μmol/L;而在UOK262组IC50分别为舒尼替尼6.59 μmol/L、卡博替尼7.75 μmol/L、索拉非尼1.143 μmol/L(图3B、C)。单药实验的结果显示,LDHA抑制剂及靶向药物卡博替尼、索拉非尼及舒尼替尼对UOK262和CL19细胞增殖均有明显抑制作用。
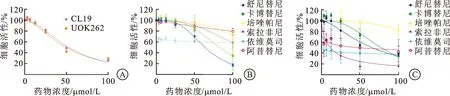
A:LDHA抑制剂显著抑制FH缺陷型肾癌细胞UOK262和CL19的增殖;B:靶向药物对FH缺陷型肾癌细胞CL19增殖的抑制作用;C:靶向药物对FH缺陷型肾癌细胞UOK262增殖的抑制作用。
2.3 LDHA抑制剂分别与靶向药物联合用药对FH缺陷型肾癌细胞增殖具有抑制作用在LDHA抑制剂与6种靶向药物单浓度联合用药实验中,细胞增殖实验结果显示LDHA抑制剂(R)-GNE-140和靶向药物(卡博替尼、培唑帕尼、索拉非尼)单浓度联用结果提示药物联用能进一步抑制FH缺陷型肾癌细胞UOK262和CL19的增殖。在CL19和UOK262细胞中20 μmol/L和10 μmol/L的LDHA抑制剂与3种单浓度靶向药物联用具有明显的细胞抑制作用(图4A、B)。
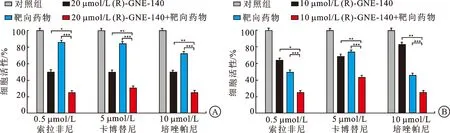
A:CL19细胞中20 μmol/L LDHA抑制剂(R)-GNE-140和靶向药物(卡博替尼、培唑帕尼、索拉非尼)单浓度联用显著增强了细胞增殖的抑制作用;B:UOK262细胞中10 μmol/L LDHA抑制剂(R)-GNE-140和靶向药物(卡博替尼、培唑帕尼、索拉非尼)单浓度联用显著增强了细胞增殖的抑制作用;*P<0.05,**P<0.01,***P<0.001。
进一步将LDHA抑制剂与靶向药物(卡博替尼、培唑帕尼、索拉非尼)等比例浓度梯度联合用药结果表明,CL19细胞中LDHA抑制剂与靶向药物卡博替尼、培唑帕尼以及索拉非尼在10∶1、1∶10及10∶1的等比例浓度梯度联用下CI<1,提示两药有协同作用,且CI值越小表明协同作用越强(图5A~F),而两药在2∶20或20∶2的浓度下由于单药的增殖抑制作用强出现拮抗作用(CI>1)。
3 讨 论
FH缺陷型肾细胞癌是一种罕见的高度恶性肾细胞癌,发病率尚不明确。FH缺陷型肾细胞癌可由延胡索酸水合酶胚系或体系突变所致,其中最常见的是由胚系突变所致的一种罕见的常染色体显性遗传性疾病——HLRCC[3]。法国学者MULLER等[6]对全法国2004-2016年间来自114个家庭的182例HLRCC患者展开了追踪研究,发现19%的患者有肾细胞癌史,且其中82%的患者在确诊时即已转移或在3年内发生转移,远处转移的患者中位生存期仅为18个月。另一项研究显示[7],FH缺陷型肾癌患者初诊时57%为T3~4期,淋巴结转移占52%,远处器官转移占19%,中位随访17.5个月(1~114个月),39%患者死亡、26%患者疾病进展。FH缺陷型肾癌发病年龄早(据文献报道最小的肾癌患者仅7岁[8]),影像学表现不典型及病理形态多变使得临床诊断变得困难,且由于其侵袭性高,易早期出现淋巴结及骨等远处转移,但目前缺乏有效的治疗方案。因此,对于FH缺陷型肾癌,新治疗靶点的探索十分重要。
Warburg效应是肿瘤细胞能量代谢的重要特征,即在氧气含量正常的条件下,肿瘤细胞中通过糖酵解将葡萄糖转化为乳酸并产生三磷酸腺苷,从而满足肿瘤细胞快速生长增殖的能量需求。LDHA是细胞糖酵解中的关键限速酶,是调控乳酸代谢的重要靶点。在缺氧条件下肿瘤细胞中LDH催化丙酮酸生成乳酸并产生氧化型烟酰胺腺嘌呤二核苷酸,提升糖酵解水平,使细胞外pH值下降,产生的乳酸又可被肿瘤细胞摄取进而参与供能[9-10]。近年来的研究发现LDHA在多种肿瘤中如前列腺癌、乳腺癌、肺癌、结直肠癌、胃癌、胰腺癌、膀胱癌、口腔鳞癌等中表达升高[11-14],且与这些恶性肿瘤的不良预后相关。肿瘤中如c-Myc、HIF-1α、CREB、热休克转录因子1(heat-shock factor 1,HSF1)、叉头蛋白 M1 (forkhead box protein M1,FOXM1)等转录因子能够上调LDHA的转录水平[15],从而激活有氧糖酵解。乳酸能够调节肿瘤微环境中的细胞免疫代谢,影响细胞中干扰素(interferon,IFN)的表达,进而促进肿瘤区域的免疫抑制[16]。乳酸的增多引起蛋白酶对细胞外基质(extracellular matrix,ECM)的降解,通过引起血管内皮生长因子(vascular endothelial growth factor,VEGF)的释放参与血管生成,驱动肿瘤的转移及扩散[17]。
FH缺陷型肾癌中,FH基因的突变导致细胞氧化磷酸化的受损,导致细胞的假性缺氧,供能更依赖于糖酵解。延胡索酸是一种竞争性抑制脯氨酰羟化酶(prolyl hydroxylase,PHD)的肿瘤代谢物,破坏了HIF1α和HIF2α的羟基化[18],细胞内HIF水平的升高改变了一些蛋白质和转录因子(如GLUT1、NRF2和AMPK)的活性,HIF下游的LDHA、VEGF、血小板衍生生长因子(platelet derived growth factor,PDGF)、表皮生长因子(epidermal growth factor,EGF)基因激活,从而促进肿瘤生长[19],相关研究也进一步佐证了FH缺陷型肾癌组织中LDHA的高表达是由于延胡索酸积累引起的HIF-1α途径激活所致[20-21]。因此,LDHA可能为FH缺陷型肾癌的潜在治疗靶点。本研究通过RNA-seq、qPCR及免疫组化的结果证实了FH缺陷型肾癌组织中LDHA的高表达。为探索LDHA抑制剂和肾癌靶向药物在体外实验中对FH缺陷型肾癌细胞增殖的影响,我们通过单药的实验表明LDHA抑制剂及靶向药物卡博替尼、索拉非尼、舒尼替尼对FH缺陷型肾癌细胞的增殖有显著抑制作用。且进一步的药物联用实验表明卡博替尼、培唑帕尼及索拉非尼与LDHA抑制剂联合用药有协同抑制FH缺陷型肾癌细胞增殖作用,提示LDHA抑制剂与肾癌靶向药物联合用药可能为FH缺陷型肾癌的潜在治疗方案。
综上所述,本研究证明了LDHA在FH缺陷型肾癌中呈现高表达,LHDA抑制剂能够抑制FH缺陷型肾癌细胞的增殖,且联合靶向药物能进一步增加抑制作用,为FH缺陷型肾癌的治疗提供新的可能性,但具体的作用机制及后续的体内模型验证还有待深入研究和探索。