鲇繁殖生物学特征分析
韩 庆,刘可可,黄艳飞,3,田 汉,王文彬,刘良国
1.湖南文理学院 生命与环境科学学院,湖南 常德 415000
2.水产高效健康生产湖南省协同创新中心,湖南 常德 415000
3.环洞庭湖水产健康养殖及加工湖南省重点实验室,湖南 常德 415000
鲇 (Silurusasotus) 属鲇形目、鲇科、鲇属,广泛分布于我国江河、湖泊,是洞庭湖流域主要鱼类之一[1],性凶猛,肉食性,多以鱼虾为食,具有适应性强、生命力旺、生长发育快、抗病能力强、肉质细腻鲜嫩、肌间刺少等特点[2],已被广泛推广养殖。在鲇形目鱼类繁殖生物学方面,国内已对南方鲇 (S.meriordinalis)[3-4]、怀头鲇 (S.soldatovi)[5]、兰州鲇 (S.lanzhouensis)[6]、洞庭湖鲶 (S.asotus)[7]、豹纹脂身鲶 (Pterygoplichthyspardalis)[8]、中华鲱鲇 (Clupisomasinensis)[9]开展了一系列研究。
鱼类的繁殖能力对其资源变化有一定影响[10]。沅江属长江流域洞庭湖支流水系,是湖南省第二大河流,全长1 033 km,起源于贵州,在湖南汉寿县汇入洞庭湖[11]。凌津滩水电站地处湖南省常德市桃源县,是沅江干流最下游的一个梯级,与上游五强溪水电站相距47.5 km。鱼类的生物学特性由遗传和环境共同作用决定[12],为适应环境,同一物种不同地理种群间生物学特性存在一定的差异[13-16]。目前尚未见对沅江干流水域鲇种群生物学相关的研究报道,选取凌津滩库区为本研究的取样及生态环境调查点,对沅江凌津滩库区鲇的生长与繁殖特征进行研究,一方面可为野生鲇的定种、品种改良以及人工繁殖等提供基础理论资料,另一方面通过探讨鲇对大坝隔断的生态响应,可为其种质资源保护与合理利用提供科学依据,并为凌津滩库区制定鱼类种群调控政策提供理论支撑。
1 材料与方法
1.1 样本采集
2018 年5 月至2020 年4 月共进行了24 次采样,每月15 日左右在湖南省常德市桃源县的凌津滩库区兴隆街河段采集鲇样本约30 尾,共采集样本738 尾。采集的鲇在鲜活状态下,采用带水增氧方式运输至环洞庭湖水产健康养殖及加工湖南省重点实验室进行分析。
1.2 生物学指标测量
体长、体高等指标采用游标卡尺测量,精确到0.01 cm,体质量、去内脏质量 (空壳质量) 和性腺质量等采用电子天平称量,精确到0.01 g。怀卵量采用质量取样法,每年5—8 月从IV 期卵巢中称1.00 g 卵,在Motic 显微操作系统下用计数器对分散成熟的全部卵粒计数。参照文献[17]计算鲇绝对繁殖力和相对繁殖力,同时,随机选取每尾鱼的100 粒卵子测定卵粒直径。
1.3 体长与体质量的关系
体长与体质量的关系参考郜星晨等[17]的方法利用幂函数进行拟合,肥满度 (K) 的计算参照刘艳超[18]采用Fulton法,计算公式如下:
式中:W、L、a、b分别代表体质量、体长、生长的条件因子、异速生长因子。
1.4 性比及性腺发育
性腺发育期根据黄小林等[19]通过目测比对区分。性别鉴定通过鱼体外形特征结合性腺解剖检查进行,并统计雌、雄个体数目计算性比,通过χ2检验性比差异显著性。雌性体长以10 mm 为间距分组,统计各体长组性成熟个体比例,进行Logistic 曲线拟合,并推算雌性鲇群体50% 性成熟体长,公式为:
式中:Pi为各体长区段性成熟个体百分比;k为成熟度增长系数;Li为各体长区段中间值;L50为50% 性成熟体长。
1.5 性成熟系数及繁殖力
绝对繁殖力、相对繁殖力、性成熟系数 计算公式如下:
式中:F为绝对繁殖力;FW为相对繁殖力;GSI 为性成熟系数 (%) ;N为每克卵巢卵数 (粒·g-1);WO为性腺质量;WN为空壳质量。
1.6 实验数据处理
采用Excel 2016 与SPSS 21.0 软件进行数据整理、图表绘制和统计分析。
2 结果
2.1 鲇的雌雄性状鉴别与性比
外观上,可以根据鲇尾鳍分叉的深度来鉴别性别,雄性尾鳍分叉深而明显,超过尾鳍2/3 以上,雌性尾鳍分叉浅,不到尾鳍的1/3 (图 1)。雌、雄胸鳍第一硬刺后缘不同,雌性较为光滑;雄性有粗壮的锯齿,用手摸有割手感。腹部感官不同,雌性膨大具有弹性,外生殖突短而粗大,生殖孔呈椭圆形且较突出、充血红肿;雄性腹部狭小,外生殖突细长,生殖孔狭小稍长、充血不明显。在繁殖盛期,雌性体型较雄性大,体表光滑多黏液,下腹膨胀柔软,卵巢轮廓隐约可见,挤压腹部有卵粒流出;雄性体表黏液少,躯体较狭长,腹部手感较硬。

图1 雌雄鲇尾鳍分叉对比Fig.1 Differences of tail fins between female and male S.asotus
沅江鲇的性比在不同时期有较大差异,但大多是雌性明显多于雄性。根据对738 尾样本的统计,其中雌性404 尾、雄性334 尾,性比为1.21,通过χ2检验,显著大于1 (P<0.05)。不同月份间性比有差异,7、8、10 月最高;3、12 月次之,高于4 月;4 月高于1、9 月,1、9 月高于2、5、11 月,6 月最低,且差异显著 (P<0.05) (表1)。

表1 鲇 1—12 月的性比Table 1 Sex ratio of S.asotus from January to December
2.2 鲇体长与体质量的关系
按照采样月份对测量的738 尾鲇的体长、体高、体质量进行统计 (表2),均在11 月达到最高,分别为(39.52±4.81) cm、(5.88±0.76) cm、(381.60±158.40) g。从体长来看,5—11 月除9 月偏低外总体呈递增趋势,在11 月达到最高,12 月开始下降,次年1 月最低,1—4 月又呈现递增趋势。体高、体质量的变化趋势与体长基本一致。体长、体高、体质量周年变化与繁殖、越冬等生理活动相一致,9 月偏低可能由取样数量偏少导致。雌性体长为19.20~44.00 cm,平均 (32.67±4.52) cm,优势体长为35.00~40.00 cm;体质量为125.00~1 042.00 g,平均(381.78±105.34) g。雄性体长为14.80~37.20 cm,平均(28.19±5.62) cm,优势体长为30~35 cm;体质量为55.00~514.00 g,平均 (276.43±88.72) g。
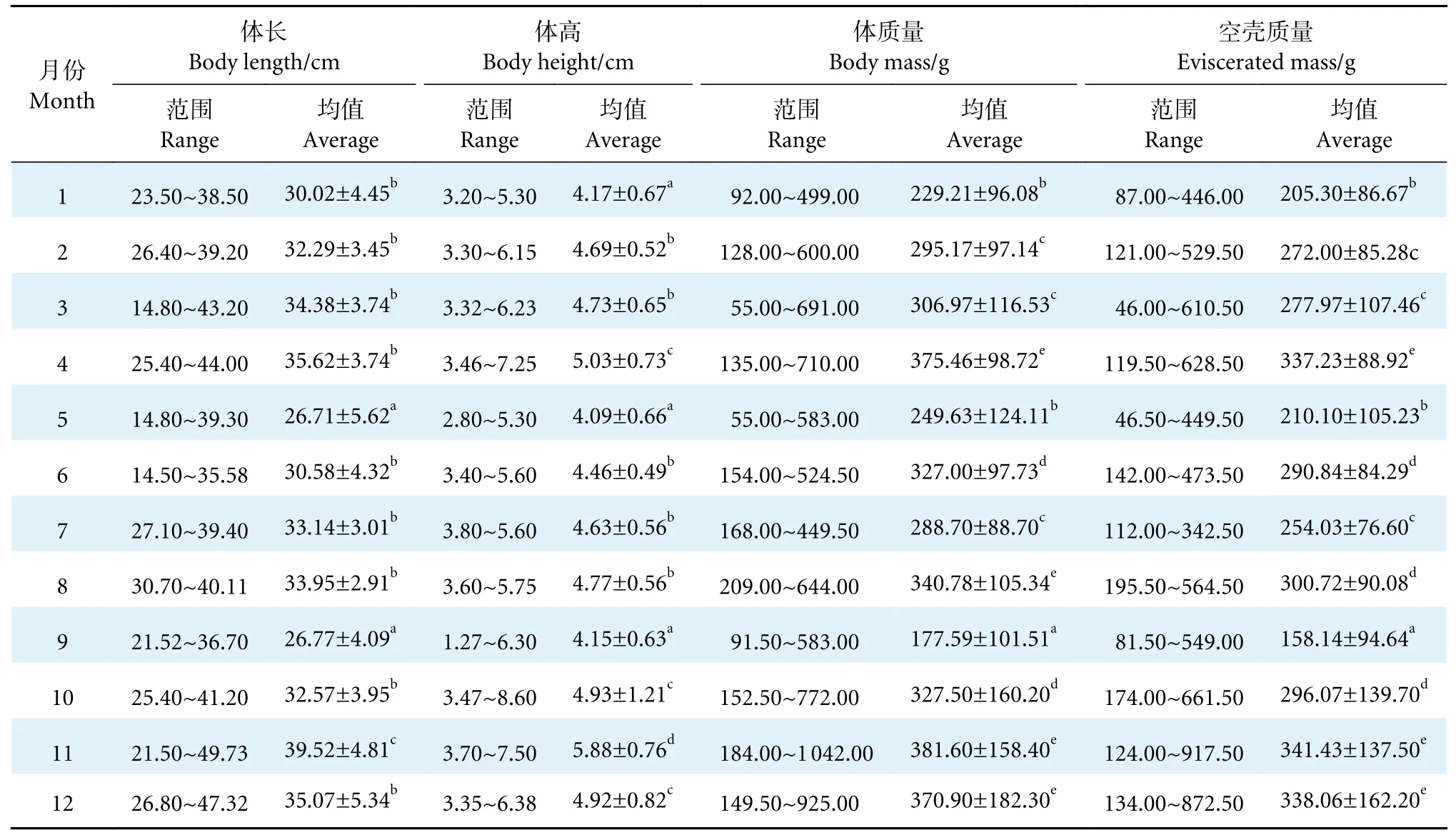
表2 鲇体长、体高、体质量的周年变化Table 2 Annual changes in body length,body height and body mass of S.asotus
经协方差分析显示,雌雄间体长与体质量关系差异不显著 (F=0.39,P=0.57>0.05),不考虑性别因素,通过回归分析得到738 尾鲇体质量和体长的幂函数关系为:W=0.056L2.57(R=0.97,图2),b值2.57,用t检验分析显示低于3 的理论匀速生长值,差异显著 (P<0.05),说明鲇体长按线性长度增加,体质量则按体长的幂次增加,群体生长为异速型。

图2 鲇体长-体质量关系Fig.2 Relationship between body length and body mass of S.asotus
2.3 鲇性腺发育与性成熟系数
鲇周年的发育分期 (表3) 与性成熟系数相一致。IV 期即成熟期为5 月,V 期即生殖期为6—8 月,VI—II 期即疲弱期为9 月,10—12 月为II 期即静息期,有部分是从VI 期重新向II 期过渡,处于I 期的数量很少,卵巢中尚未排出的卵粒慢慢退化,并被亲鱼吸收利用。鲇在繁殖季节5—8 月,各月性腺发育分期的组成存在一定差异 (图3),其中5 月以IV 期为主,占75.50%;6 月以V 期为主,占67.50%;7 月以V 和VI 期为主,分别占52.90% 和41.50%;8 月以VI 期为主,占72.50%。

表3 鲇性腺发育状况Table 3 Gonadal development of S.asotus
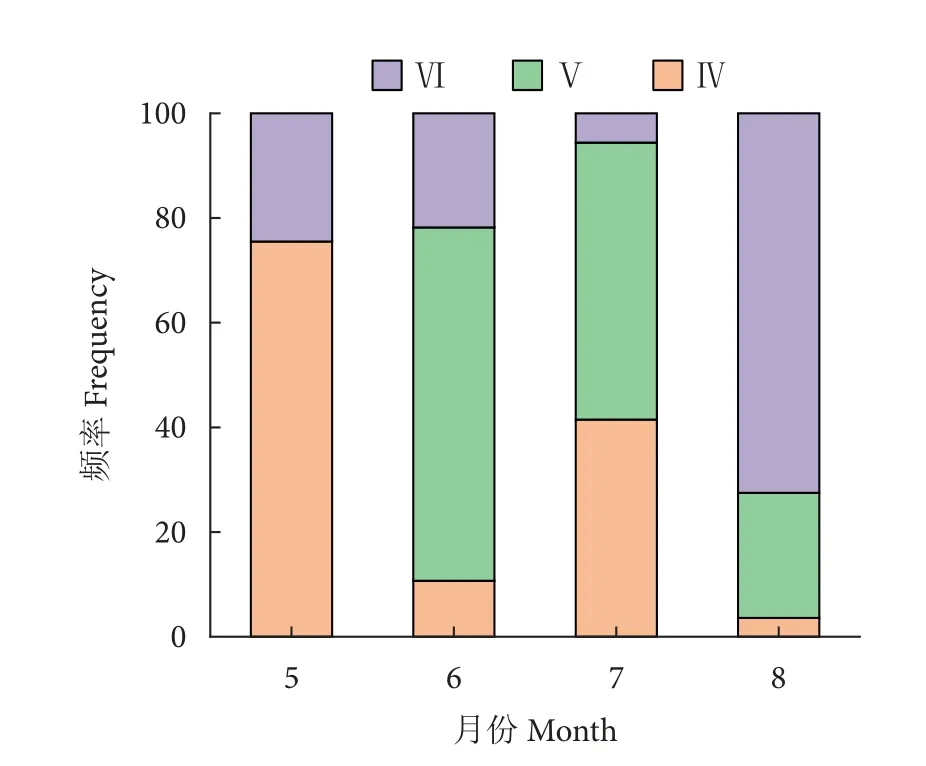
图3 鲇卵巢发育分期的月份变化Fig.3 Variation of ovaries developmental stages of S.asotus from Yuanjiang River in different months
对404 尾雌性鲇,体长以10 mm 为间距分组,然后对各分组性成熟比例和体长进行Logistic 回归拟合,获得性腺成熟度百分比与体长组的关系方程如下 (图4):
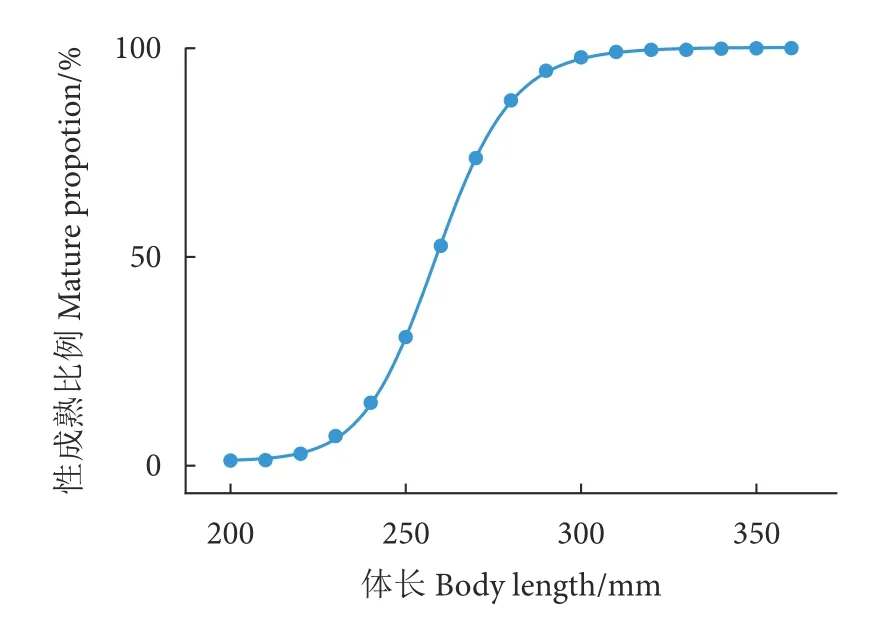
图4 鲇雌性性成熟比例与体长关系Fig.4 Relationship between body length and sex mature frequency of female S.asotus in Yuanjiang River
通过Logistic 曲线回归法拟合估算得到,雌性鲇的群体50%性成熟体长为258.85 mm。
鲇全年平均性成熟系数雌性高于雄性 (P<0.01),雌性平均7.51,雄性平均1.85。鲇雌性性成熟系数5 月最高,达15.24,5—9 月下降,9 月达最低(2.04),9 月至次年5 月呈上升趋势,鱼类卵巢的成熟系数只在繁殖期达到最大,而周年中鲇性成熟系数仅出现一个峰值,说明鲇为一次产卵型鱼类;雄性性成熟系数也是5 月最高(4.24),5—11 月下降,11 月达最低(0.74),11 月至次年5 月上升。说明鲇雌、雄性成熟系数的周年变化趋势基本同步,从而保障了鲇的繁殖率。
鲇雌性性成熟系数平均值从1 月一直增加到6 月,之后逐渐下降,9 月最低,10—12 月较低;雄性性成熟系数变化规律与雌性相似 (表4)。鲇群体肥满度平均为0.88,雌性平均0.94,雄性平均0.81,雌性显著高于雄性 (P<0.01)。雌、雄肥满度周年变化呈相同趋势,12 月至次年5 月逐步上升,5—7 月下降,7—10 月上升,10—12 月下降。雌、雄肥满度均在5 月最高,分别为1.37、1.19;在11 月最低,分别为0.65、0.56。肥满度周年变化与繁殖、越冬等生理活动相适应。
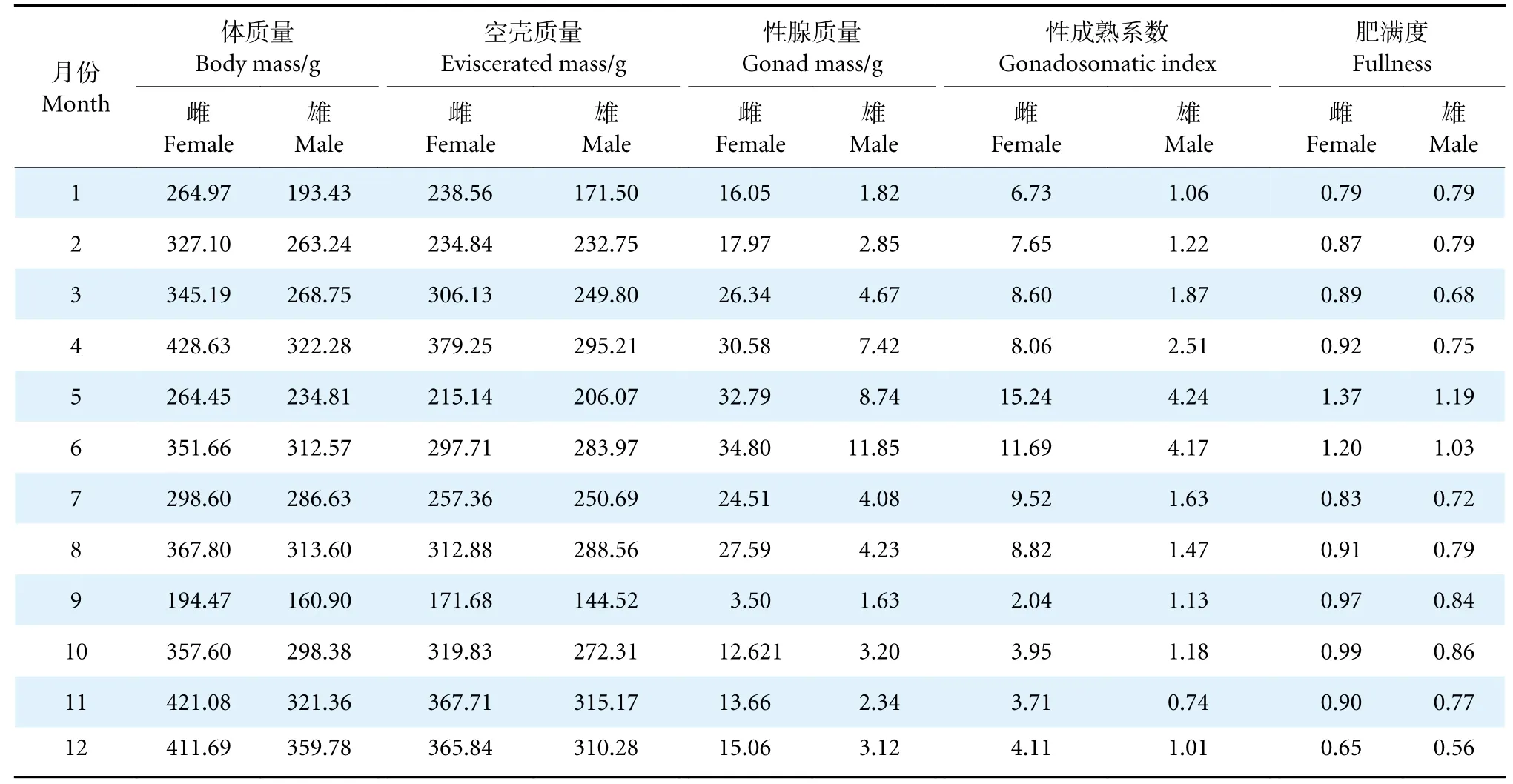
表4 鲇 1—12 月份的性成熟系数Table 4 Gonadosomatic indexes of S.asotus from January to December
2.4 鲇繁殖力和卵径
共分析了5—8 月67 尾雌性性成熟个体的繁殖力,个体绝对繁殖力最大为125 324 粒,最小为4 259 粒,平均(29 677±18 174) 粒;个体相对怀卵量最大为287 粒·g-1,最小为17 粒·g-1,平均 (107±65) 粒·g-1。最小的雌鱼个体体长为23.65 cm,体质量为109.52 g,绝对繁殖力 (F) 与体质量(W) 和体长 (L) 均成直线相关,个体繁殖力随体质量、体长的增加而增加,关系式分别为:
鲇平均卵径范围介于794.40~1 908.40 μm,平均(1 444.50±97.45) μm,优势卵径组为1 200~1 400 μm (图5)。
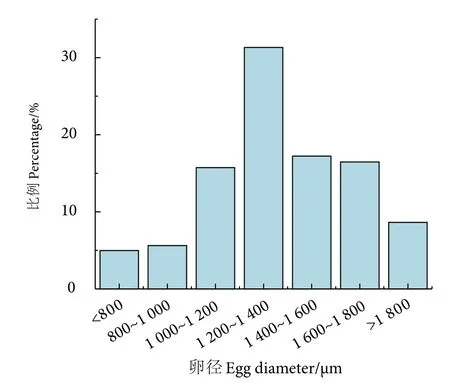
图5 鲇 IV 期卵巢的卵径分布Fig.5 Oocyte diameter-frequency distribution of S.asotus ovary at stage IV
由表3 可知,鲇5—8 月的性腺发育程度,5 月以IV 期为主,6 月以V 期为主,7—8 月以VI 期为主,结合表5 得出,IV—VI 期不同性腺发育期其卵径的大小不一样,表现为IV 期高于V 期高于VI 期,独立t检验显示,IV—VI 期的性腺发育程度与卵径呈负相关关系,且差异显著 (P<0.05)。
3 讨论
3.1 性比
鲇总性别比例为雌性404 尾、雄性334 尾,雌∶雄=1.21∶1,通过χ2检验,大于 1∶1 的理论比值且差异显著 (P<0.05),与肖智[20]鲇繁殖习性研究结果一致,而与短尾高原鳅 (Triplophysabrevieauda)[18]、宽口裂腹鱼(Schizothoraxeurystomus)[21]等繁殖群体中雌性显著少于雄性不同,雄鱼明显多于雌鱼,可保障受精率,提高繁殖力。鲇雌、雄总比例大于1,但在2、5、6、11 月低于1,呈现季节性差异,这种现象也出现在西藏哲古措异尾高原鳅 (T.stewarti)[22]、沙塘鳢 (Odontobutisobscura)[23]中。尤其是鲇6 月的性比仅0.33,这可能与雄性个体小满足繁殖所需相关。鲇雌雄周年总比例大于 1∶1 的理论比值,可能由取样数较少导致,因此要进一步得出鲇的性别比例状况,还需加大取样量和采样的随机性;也可能是雌鱼生长快,具有竞争优势所致。雌性鲇生长速度明显快于雄性,因此,鲇雌性明显多于雄性,正好符合人工养殖需要,有利于提高养殖产量。但是雄性数量少,个体又较雌性小,难以保证受精率,对其繁殖极为不利。要解决这一矛盾需加强对鲇性别分化机制的探讨。何福林等[24]在沟鲶 (Ietalurus punetaus) 鱼苗生长初期使用甲基睾丸酮等激素处理,将沟鲶遗传上的雌性转化为生理上的雄性,从而提高沟鲇雄性的数量。对鲇能否利用甲基睾丸酮等激素诱导雌转雄,还有待进一步研究。若可行,便有望通过遗传雌性与转化雄性交配培育出全雌鲇,如同全雄黄颡鱼 (Pelteobagrusfulvidraco)[25]一样应用于养殖生产,提高养殖产量和经济效益。
3.2 体长与体质量的关系
高小平等[26]认为对硬骨鱼类而言体质量 (W) 与体长(L) 为幂函数关系:W=aLb,b的取值范围为2.5~4.0。本实验得到鲇体长与体质量关系式为:W=0.056L2.57,R=0.97,b=2.57,在高小平等[26]报道的取值范围之内,但与低等甲壳动物中华绒螯蟹 (Eriocheirsinensis) 的直线线性相关不同[27]。杨丽亚等[28]研究显示鱼类是否处于等速生长可以用幂指数b的大小来判断,当b为3 时,则表明鱼类的生长为等速型。鲇b=2.57,与3 差异显著 (P<0.05),说明鲇的生长趋于异速生长,与网箱养殖福瑞鲤 (Cyprinus carpio) (b=2.84)[29]、雅鲁藏布江下弧唇裂腹鱼 (Schizothorax curvilabiatus) (b=2.94)[30]、短尾高原鳅 (b=3.05)[31]、方氏云鳚 (Enedriasfangi) (b=3.10)[32]、鲢 (Hypophthalmichthys molitrix) (b=2.75)[33]等与3 接近的研究结果不一致。影响b值变化的因素包括环境、发育阶段、年龄、季节、捕捞强度[34]、性别、海拔、种群[35]、食物、疾病[17]、个体大小[36]等,本实验并未考虑这些因素的影响,还有待进一步研究。
3.3 繁殖特性
本研究结果显示,鲇性成熟系数的周年变化表现出明显的周期性,雌性性成熟系数5 月最高,5—9 月下降,9 月最低,9 月至次年5 月呈上升趋势;雄性性成熟系数也是5 月最高,5—11 月下降,11 月最低,11 月至翌年5 月上升,雌、雄性成熟系数的周年变化规律基本一致,推测5 月下旬至8 月上旬为其繁殖期与实际的繁殖期一致,这一结果与郜星晨等[17]对长江宜昌段鳙 (Aristichthysnobilis)的繁殖研究结果一致。鲇的卵巢大多处于II、III、IV 期,在5 月基本进入成熟期,部分开始进入排卵期即V 期,GSI 变化较大[37]。绝对怀卵量在4 259~125 324 粒之间变化,差异很大,繁殖力受个体大小、环境因素、成熟期等影响[38-40]。鱼类的产卵类型通常可以通过卵径分布和成熟系数周年变化来判断[41]。本实验中鲇卵径的周年分布中只在5 月达到高峰,这与长江宜昌段鳙[17]呈现双峰不同。鲇成熟卵径均值为1.63 mm,远低于长江宜昌段鳙卵径均值(3.75) mm[17],与同为鲇形目的其他鱼类比较,低于卵径均值为1.87 mm 的豹纹脂身鲶,高于卵径均值为1.56 mm 的光泽黄颡鱼 (P.nitidus)、卵径均值为1.50 mm 的瓦氏黄颡鱼 (P.vachelli) 和卵径均值为1.05 mm 的革胡子鲶 (Clariidaegariepinus)[8]。鲇的卵径较大,说明卵所含供孵化后仔鱼利用的营养物质较多,保证了孵化成活的机会,有利于提高受精卵的孵化率和仔鱼的成活率。在实验过程中发现,雌鲇产卵后卵巢内有明显的空卵泡,并残留大量处于III 期后的未成熟期卵子,这可能是鲇与生俱来的一种正常自然现象,也可能是外来干扰造成的,其产生原因还有待进一步分析。鲇的卵巢发育是同步的,吴士平和李海洋[3]研究发现鲇可第二次产卵和再次进行人工催产。本实验中发现鲇在生殖期结束时,卵巢内残留较多的成熟卵母细胞,这种繁殖特性对鲇的养殖具有重要意义,可在鲇排卵后进行第二次催产,以提高其产卵量,这一现象与吴士平和李海洋[3]的研究结果一致,但是关于催产的时间间隔还有待进一步研究。

