裂褶菌多糖对凡纳滨对虾生长、免疫和肠道菌群的影响
蒋 魁,胡晓娟,徐创文,洪敏娜,刘曦瑶,麦晓勇,陈海谊,杨 铿
1.中国水产科学研究院南海水产研究所/农业农村部南海渔业资源开发利用重点实验室/广东省渔业生态环境重点实验室,广东 广州 510300
2.广州市欣海利生生物科技有限公司,广东 广州 510300
凡纳滨对虾 (Litopenaeusvannamei) 又名南美白对虾,最初主要栖息于南美太平洋地区[1],其对盐度、温度的适应范围广,且生长快、肉质好,是当今世界养殖产量最高的对虾品种[2],目前在中国东部沿海到西部内陆等区域均有养殖。根据中国渔业统计年鉴数据,2022 年我国凡纳滨对虾养殖总产量高达209.86 万吨[3]。
多糖 (Polysaccharide) 是由超过10 个单糖的醛基和酮基通过苷键连接成的聚合糖高分子碳水化合物,是构成生命的四大基本物质之一。多糖可以通过增大巨噬细胞体积,促进淋巴细胞增殖,改善淋巴细胞亚群结构,促进细胞因子分泌,提高动物机体血清中抗体水平等来提高机体免疫力[4-6]。免疫多糖作为水产养殖免疫增强剂使用,具有广泛的应用前景及生态和经济收益,能够替代部分抗生素,减少药物的使用量,减轻对养殖水环境的污染,提高对虾养殖的成功率。
裂褶菌 (SchizophyllumcommunerFr.) 是裂褶菌科、裂褶菌属的真菌[7],广泛分布于世界各地。裂褶菌多糖是裂褶菌子实体、菌丝体或发酵液提取的一种活性多糖,因其具有抗菌、抗炎、抗氧化、抗肿瘤和调节免疫等多种功效而受到广泛关注[8]。目前,已陆续报道桦褐孔菌 (Inonotusobliquus) 多糖[9]、虫草多糖[10]、灵芝多糖[11]、灰树花多糖[12]、β-1,3 葡聚糖[13]和香菇多糖[14]等多糖作为免疫增强剂应用于水产养殖中,显著提高了养殖动物的生长性能、免疫力和抗氧化能力。已有学者对裂褶菌多糖的理化性质、发酵提纯进行了研究,发现其能显著提高小鼠 (Musmusculus) 的免疫力和抗肿瘤能力[15],而在水产养殖中尚未见关于裂褶菌多糖的应用研究报道。本研究在饲料中添加不同水平的裂褶菌多糖,分析凡纳滨对虾的生长性能、免疫酶和抗氧化酶活力、对虾肠道及菌群结构的变化,以期为裂褶菌多糖在凡纳滨对虾养殖中的应用提供数据支持。
1 材料与方法
1.1 材料
本实验在饶平西海岸生物科技有限公司养殖基地展开,12 口室内水泥池,每口池面积25 m2,凡纳滨对虾选用福建漳浦博澳快大品系虾苗。裂褶菌多糖由广州市欣海利生生物科技有限公司提供。所用凡纳滨对虾配合饲料为澳华集团虾安康系列,主要营养成分 (质量分数) 为:粗蛋白质42.0%,粗脂肪6.0%,粗纤维5.0%,粗灰分18.0%,总磷2.0%,赖氨酸2.4%,水分12%等。
养殖水源为自然海水,盐度为25‰~28‰,水质清澈,符合GB 11607—1989《渔业水质标准》和NY 5052—2001《无公害食品 海水养殖用水水质》的要求。
1.2 实验设计与养殖管理
实验用凡纳滨对虾在池塘中暂养28 d,投喂对虾配合饲料。实验开始时选取初始体质量约为1.85 g 的对虾,每口池塘投放约12 500 尾。实验设置对照组和实验组共4 组,饲料中裂褶菌多糖的添加量(质量分数)分别为0% (C 组)、0.5% (S1 组)、1.0% (S2 组) 和2.0% (S3 组),每组3 口池塘。每日分别于6:00、12:00 和18:00 投喂3 次,日投喂量为体质量的4%~6%,根据摄食情况调整投喂量,进行56 d 的养殖实验。
裂褶菌多糖的添加方法为:称取对应饲料量百分比的裂褶菌多糖用少量水稀释后,再与饲料搅拌均匀,晾干0.5 h 后投喂。实验期间保持水温为(27.5±2.5) ℃、pH 为8.0±0.4、溶解氧质量浓度>7.0 mg·L-1,氨氮质量浓度<0.5 mg·L-1。
1.3 样品采集
在养殖实验结束前禁食24 h。实验第56 天,从每口池塘随机采集65 尾对虾,其中30 尾用于测量记录体长及体质量。15 尾用于检测对虾血清中的生化指标及酶活,用灭菌的1 mL 注射器和5 号针头从虾头部的后缘插入围心腔进行采血,置于1.5 mL 无菌离心管中[11],4 ℃静置过夜,5 000 r·min-1离心15 min 取上清液,于-80 ℃冰箱中保存。其余20 尾对虾制备两份肠道样品,一份置于10 mL 4% (质量分数) 多聚甲醛中常温保存,用于肠道切片观察;另一份置于10 mL 保存液 [配方 (1 L):无水乙醇 750 mL,0.5 mol·L-1EDTA 10 mL,无菌水240 mL] 中于-80 ℃保存,进行对虾肠道菌群结构分析。
1.4 指标测定
1.4.1 生长性能测定
用直尺和电子天平测量记录对虾的体长和体质量。
1.4.2 血清生化、免疫和抗氧化指标测定
采用Beckman Synchron CX5 全自动生化分析仪测定血清中总蛋白 (TP)、胆固醇 (CHO)、尿酸(UC) 等的浓度。谷丙转氨酶 (ALT)、谷草转氨酶(AST)、总一氧化氮合成酶 (TNOS)、超氧化物歧化酶 (SOD)、溶菌酶 (LZM)、碱性磷酸酶 (AKP)、过氧化氢酶 (CAT) 等酶活性,丙二醛 (MDA) 浓度和总抗氧化能力 (T-AOC) 均采用南京建成生物工程研究所的专用试剂盒测定;酚氧化酶 (PO) 活性采用北京雪杰特科科技有限公司的专用试剂盒测定。
1.4.3 肠道组织上皮细胞切片分析
取置于10 mL 4%多聚甲醛中常温保存的对虾肠道样品,由武汉塞维尔生物科技有限公司进行肠道组织切片、HE 染色、显微观察分析,并使用CaseViewer 软件测量上皮细胞高度。
1.4.4 对虾肠道菌群结构分析
取置于10 mL 保存液中保存的对虾肠道样品,用于对虾肠道菌群结构分析。选择16S rDNA的V4—V5 区为扩增区间,扩增引物为:515F (5'-GTGCCAGCMGCCGCGG-3')和907R (5'-CCGTCAATTCMTTTRAGTTT-3'),高通量测序分析由明科生物技术 (杭州) 有限公司使用Illumina MiSeq 平台测定。采用 QIIME 1.9.1 软件计算对虾肠道菌群的多样性指数。
1.5 生长性能和数据统计
生长性能指标体质量增长率 (Weight gain rate,WGR)、特定生长率 (Specific growth rate,SGR)、饲料系数 (Feed conversion rate,FCR)、成活率 (Survival rate,SR)、摄食量 (Feed intake,FI) 等计算公式如下:
式中:RWG为平均体质量增长率 (%);RSG为特定生长率 (%·d-1);FE为饲料系数;RS为成活率 (%);QFI为摄食量 (g);F为总摄食量 (g);Wt为终末体质量 (g);W0为初始体质量 (g);n1为实验开始时的虾尾数;n2为实验结束时的虾尾数;t为养殖时间 (d)。
2 结果
2.1 裂褶菌多糖对生长性能的影响
裂褶菌多糖对凡纳滨对虾生长性能的影响见表1。实验56 d 后,S2 组的终末均体质量为23.13 g,显著高于C、S1 和S3 组 (P<0.05),而C、S1、S3组间无显著性差异 (P>0.05)。S2 组平均体质量增长率和特定生长率分别为1 150.45%和4.51%,显著高于C、S1 和S3 组 (P<0.05),而C、S1、S3 组间无显著性差异 (P>0.05)。S2 组成活率为75.37%,显著高于C、S1 和S3 组 (P<0.05),且S3 组成活率显著高于C 和S1 组 (P<0.05)。S1、S2、S3 组摄食量显著高于C 组 (P<0.05),且S2 组 (25.63 g) 显著高于S1 (21.40 g) 和S3 组 (21.13 g) (P<0.05),S1、S3 组无显著性差异 (P>0.05)。各组间的饲料系数和终末体长无显著性差异 (P>0.05)。
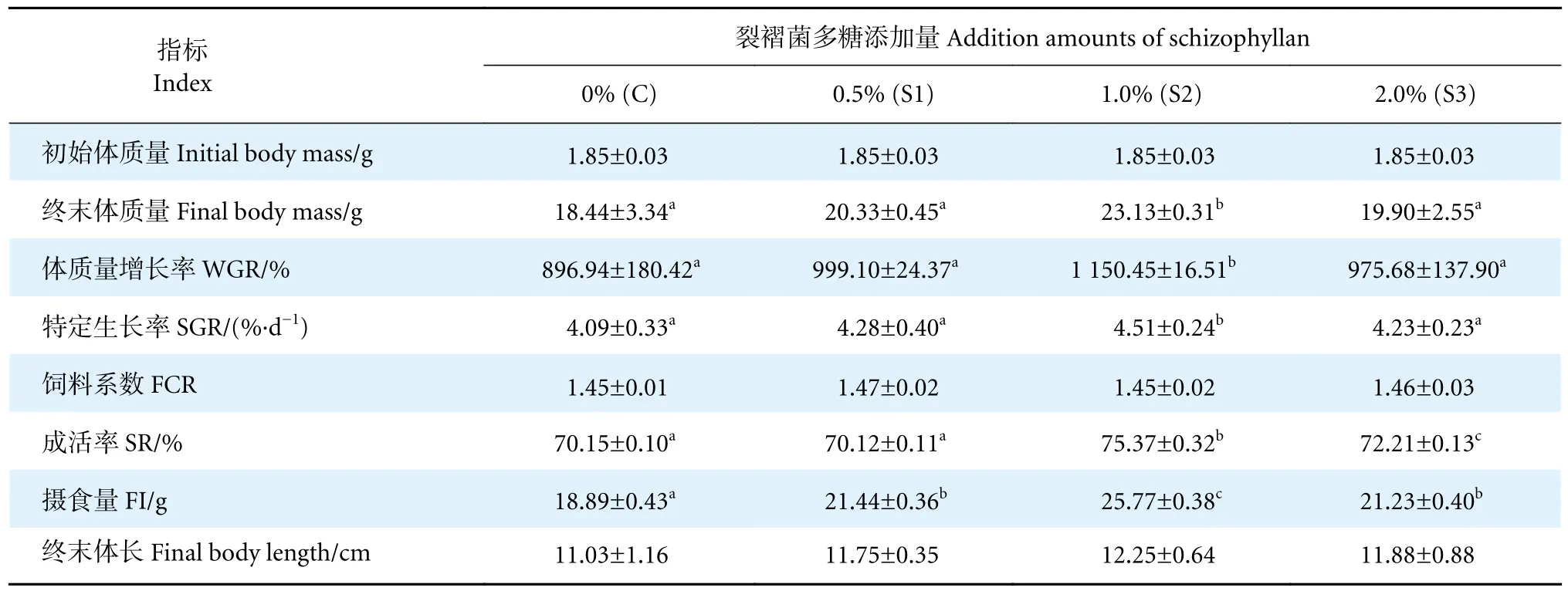
表1 裂褶菌多糖对凡纳滨对虾生长性能比较Table 1 Comparison of effects of schizophyllan on growth performance of L.vannamei
2.2 裂褶菌多糖对肠道上皮细胞的影响
养殖实验结束后,取凡纳滨对虾的肠组织切片,用HE 染色后在显微镜下观察。结果显示对照组肠道上皮细胞有部分损伤、脱落,微绒毛排列不紧密,内层上皮细胞的高度低,而S2 和S3 组对虾肠道内层上皮细胞紧密连接,微绒毛排列整齐,无明显损伤 (图1)。S2 和S3 组内层上皮细胞的高度最高达36 μm,显著高于对照组 (30 μm,P<0.05),S2、S3 组间无显著性差异 (P>0.05,图2)。
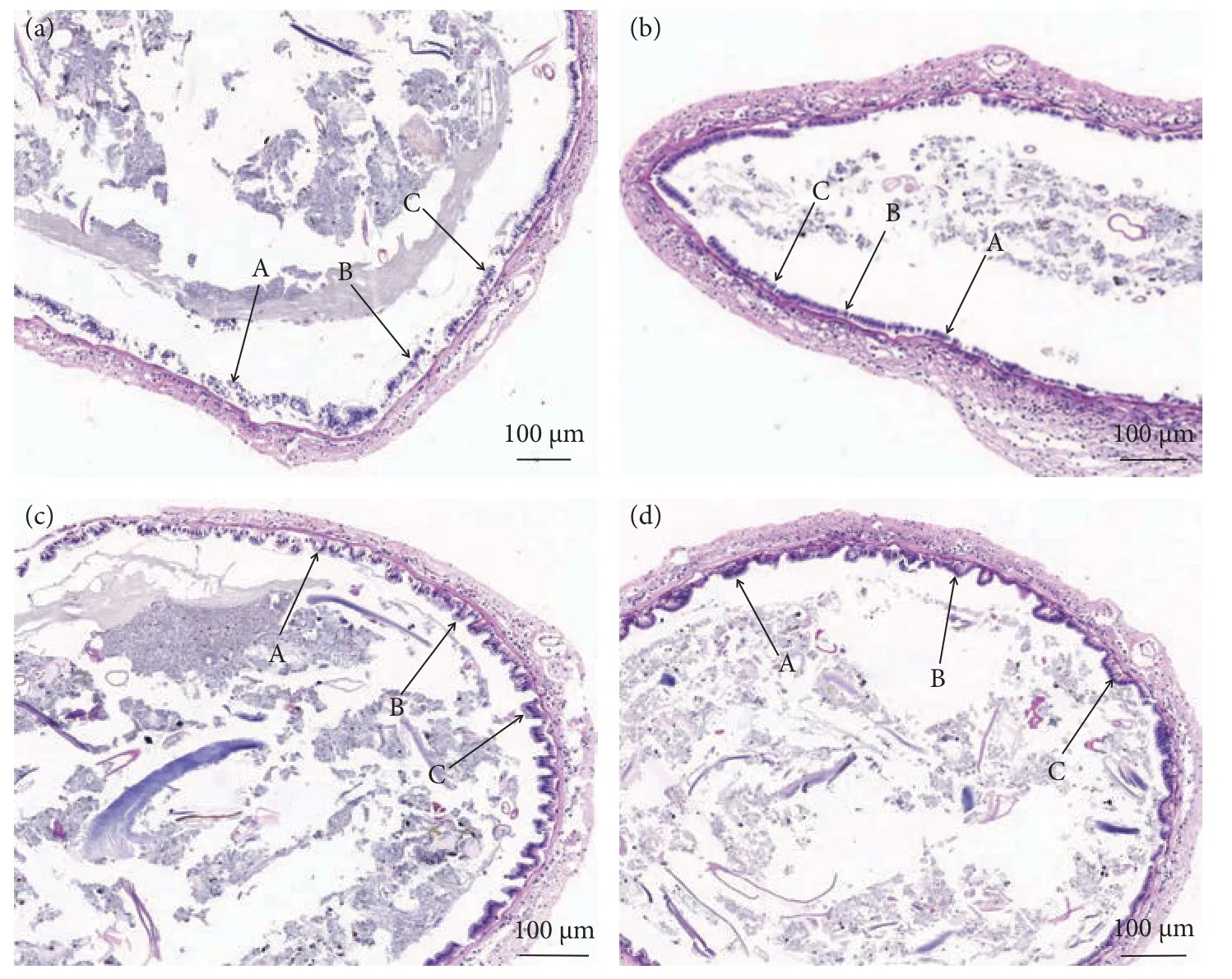
图1 对照组与实验组肠道切片对比 (200×)a.C 组 (0%) 肠道切片;b.S1 组 (0.5%) 肠道切片;c.S2 组 (1.0%) 肠道切片;d.S3 组 (2.0%) 肠道切片;A、B、C 为不同上皮细胞高度。Fig.1 Comparison of intestinal slices between control group and test groups (200×)a.Intestinal slices of Group C; b.Intestinal slices of Group S1; c.Intestinal slices of Group S2; d.Intestinal slices of Group S3;A,B and C represent different epithelial cell heights.
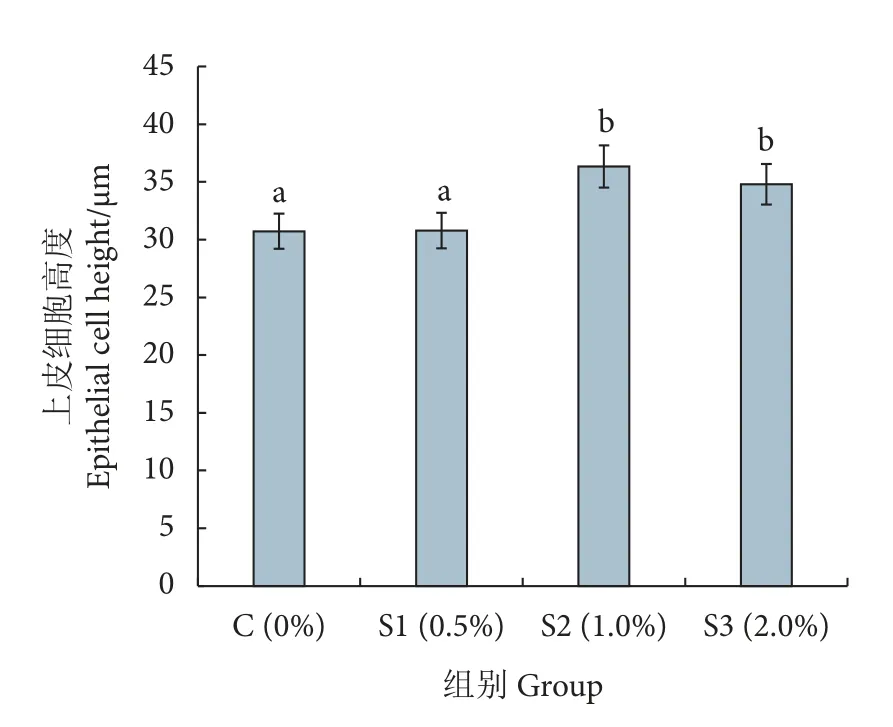
图2 对照组与实验组肠道上皮细胞高度Fig.2 Height of intestinal epithelial cells in control and test groups
2.3 裂褶菌多糖对血清生化指标的影响
添加裂褶菌多糖的实验组血清总蛋白浓度较对照组有升高趋势,而胆固醇浓度有降低趋势,但差异均不显著 (P>0.05,表2)。S2 (12.95 μmol·L-1)和S3 组 (10.75 μmol·L-1) 的尿酸浓度显著低于对照组 (20.17 μmol·L-1,P<0.05),S1 组则无显著性差异(P>0.05)。谷草转氨酶活性各组间无显著性差异(P>0.05);各实验组的谷丙转氨酶活性均低于对照组,其中S1 (247.33 U·L-1) 和S3 组 (230.67 U·L-1)显著低于对照组 (431.67 U·L-1,P<0.05)。可见,添加适当水平的裂褶菌多糖能够提高对虾血清总蛋白浓度,显著降低尿酸浓度和谷丙转氨酶活性。
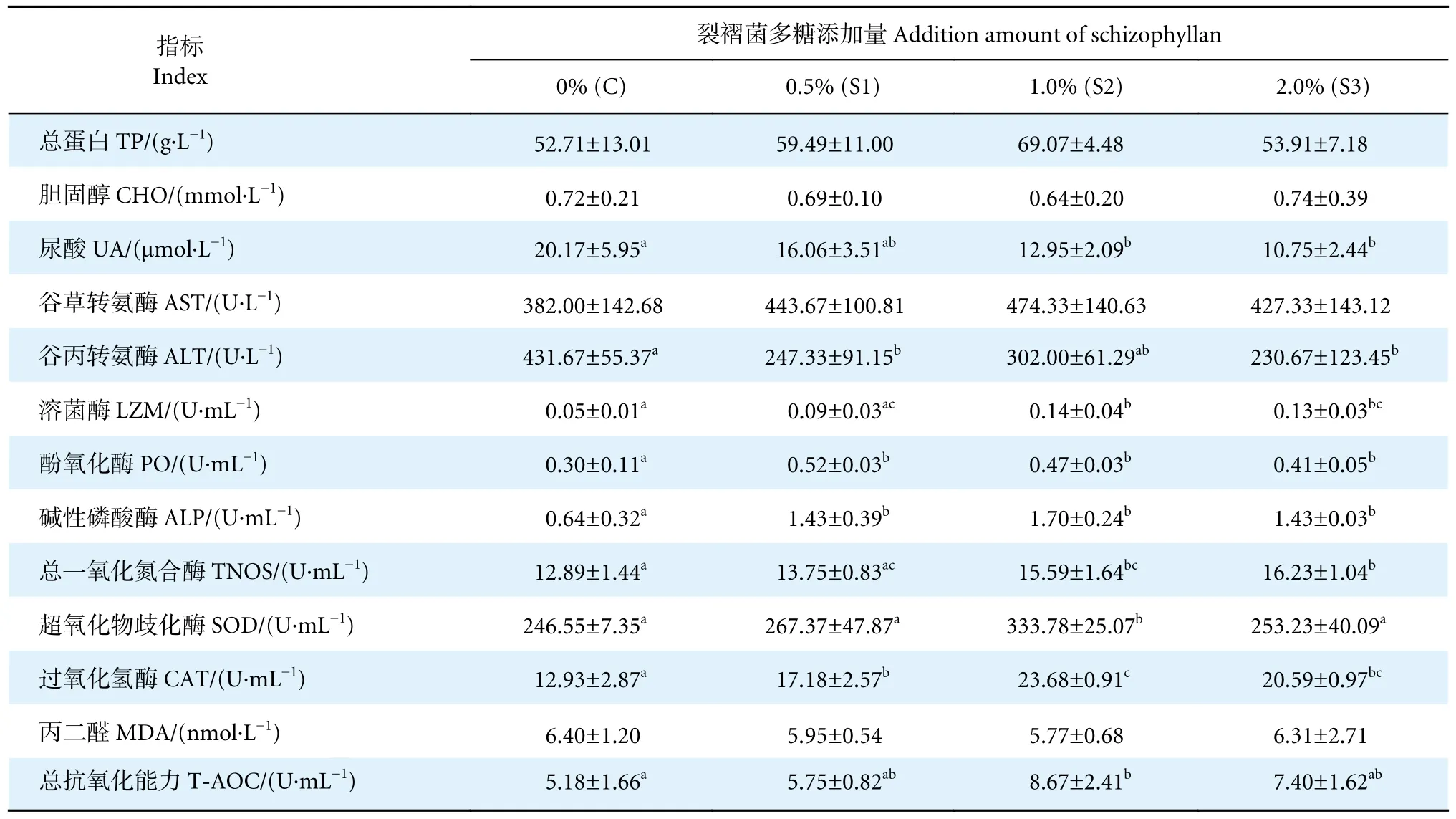
表2 裂褶菌多糖对凡纳滨对虾血清生化指标的影响Table 2 Effect of schizophyllan on serum biochemical indexes of L.vannamei
添加裂褶菌多糖的实验组S2 (0.14 U·mL-1) 和S3 组 (0.13 U·mL-1) 血清中溶菌酶活性显著高于对照组 (0.05 U·mL-1,P<0.05,表2)。3 个实验组血清酚氧化酶和碱性磷酸酶活性均显著高于对照组(P<0.05),且3 个实验组间无显著性差异 (P>0.05)。S2 (15.59 U·mL-1) 和S3 组 (16.23 U·mL-1) 血清中总一氧化氮合成酶的活性显著高于对照组 (12.89 U·mL-1,P<0.05),S1 组与对照组无显著性差异 (P>0.05),且S3 组显著高于S1 组 (P<0.05)。可见,添加不同浓度的裂褶菌多糖能够提高对虾溶菌酶、酚氧化酶、碱性磷酸酶和总一氧化氮合成酶活性。
饲料中添加适量的裂褶菌多糖提高了对虾血清中超氧化物歧化酶活性,S2 组 (333.78 U·mL-1) 活性显著高于对照组 (246.55 U·mL-1,P<0.05) (表2)。S1、S2 和S3 组过氧化氢酶活性均显著高于对照组(P<0.05),且S2 组显著高于S1 组 (P<0.05),S3 与S1 组无显著性差异 (P>0.05)。各实验组血清中丙二醛含量较对照组有下降趋势 (P>0.05)。S2 组 (8.67 U·mL-1) 血清总抗氧化能力显著高于对照组 (5.18 U·mL-1,P<0.05),其余各实验组差异不显著 (P>0.05)。可见,添加不同浓度的裂褶菌多糖能够提高对虾总抗氧化能力、超氧化物歧化酶和过氧化氢酶活性,降低丙二醛浓度。
2.4 裂褶菌多糖对凡纳滨对虾肠道菌群的影响
由表3 可知,饲料中添加不同浓度的裂褶菌多糖对凡纳滨对虾肠道有效OTUs 数目无显著性影响(P>0.05),肠道OTUs 数目最高值出现在S2 组。用Alpha 多样性分析对虾肠道微生物群落的多样性,显示各组肠道菌群检测覆盖率指数均大于0.99,样品达到要求。凡纳滨对虾肠道菌群Ace、Chao1、Shannon、Simpson 指数均无显著性差异(P>0.05)。
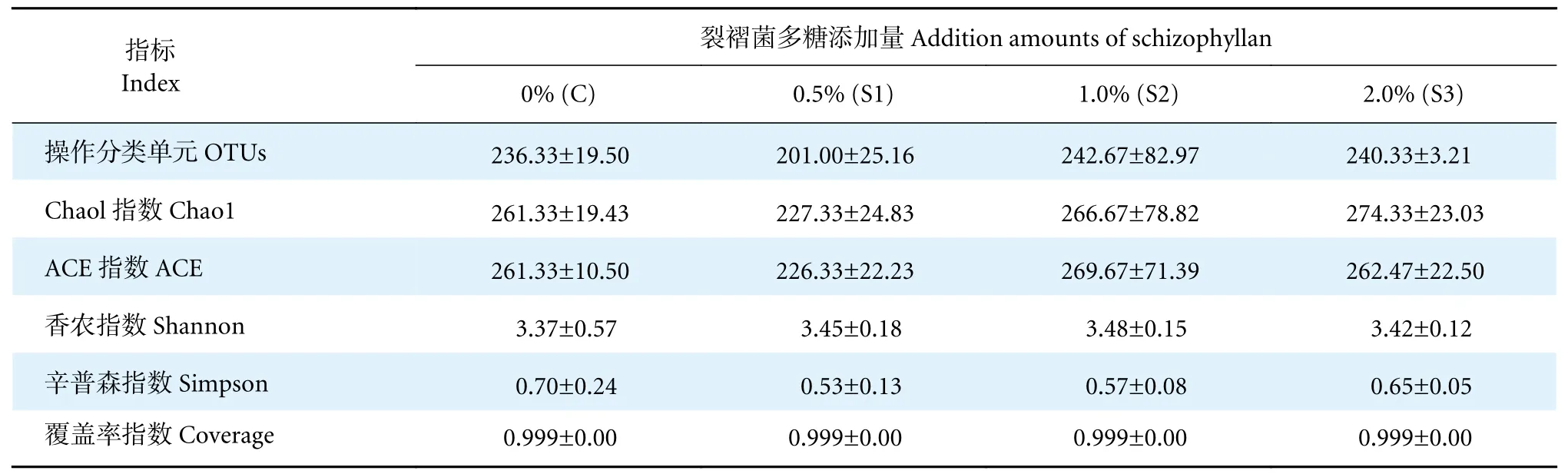
表3 裂褶菌多糖对凡纳滨对虾肠道菌群多样性的影响Table 3 Effects of schizophyllan on intestinal microflora diversity of L.vannamei
在门水平,对虾肠道菌群主要包含变形菌门、放线菌门、软壁菌门、拟杆菌门等 (图3)。各组菌群类别基本一致,但相对丰度存在一定差异。S1 组变形菌门的相对丰度 (46.35%) 较对照组(52.67%) 有下降趋势 (P>0.05)。S2 组软壁菌门的相对丰度 (5.33%) 较对照组 (1.05%) 有上升趋势(P>0.05),而S3 组软壁菌门的相对丰度 (12.32%)显著高于对照组 (P<0.05)。与对照组相比,添加裂褶菌多糖的各实验组变形菌门相对丰度均下降,软壁菌门升高。
在属水平上,肠道菌群主要由Pseudoruegeria、Formosa、Muricauda、鲁杰氏菌 (Ruegeria) 和弧菌属 (Vibrio) 等组成 (图4)。其中,S1 和S2 组中Formosa(11.65% 和8.02%)、Pseudoruegeria(12.03%和16.32%)、Muricauda(6.67%和6.69%)的相对丰度均显著高于对照组 (P<0.05);而弧菌属(2.32%和0.71%) 的相对丰度显著低于对照组 (5.33%,P<0.05)。S2 和S3 组鲁杰氏菌属 (5.73%和12.38%)的相对丰度显著高于对照组 (2.62%,P<0.05)。
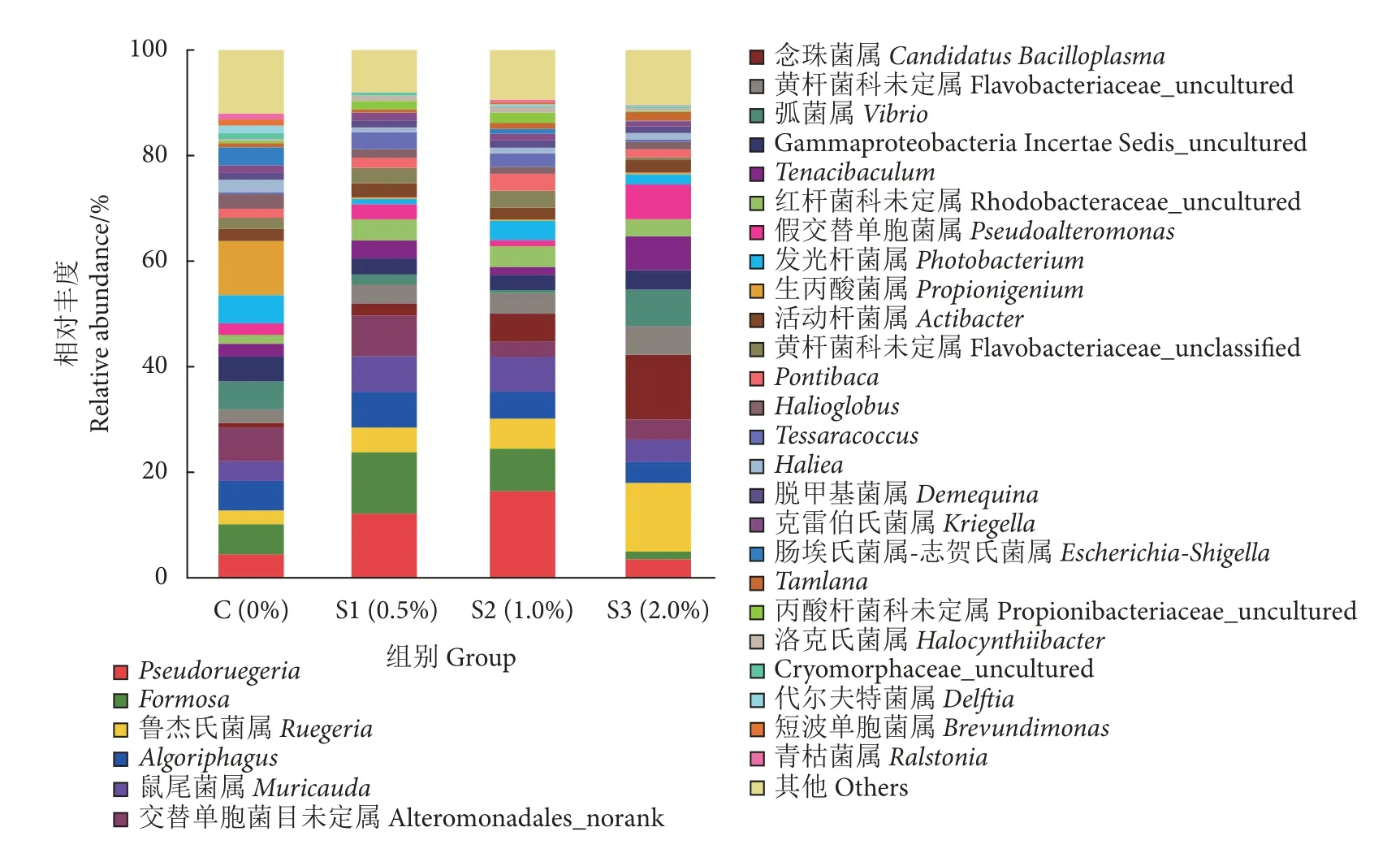
图4 不同水平裂褶菌多糖饲喂凡纳滨对虾肠道菌群属水平的相对丰度Fig.4 Relative abundance of predominant genus of intestinal microflora of L.vannamei fet with different concentrations of schizophyllan
3 讨论
多糖作为免疫增强剂已广泛应用于水产养殖中,其可显著提高对虾的生长性能。本研究将裂褶菌多糖以不同比例添加到饲料中饲养凡纳滨对虾,实验组对虾的终末体质量、体长等生长性能均有提高,其中S2 组对虾的体质量增长最显著;且肠道上皮细胞排列整齐、高度高。这一结果与饲料中添加适量的β 葡聚糖能够显著提高红鲷 (Pagrus auratus)[16]、南亚鲮鱼 (Labeorohitahamilton)[17]及大黄鱼 (Pseudosciaenacrocea)[18]生长性能的结果相似;也与添加其他多糖如桦褐孔菌多糖[9]能显著提高凡纳滨对虾的成活率和摄食量,灵芝多糖[11]和β-1,3 葡聚糖[13]能显著提高凡纳滨对虾的终体质量、平均体质量增长率的结果一致。这可能是由于多糖进入到养殖动物肠道内,为其提供营养,且在肠道内发酵生成短链脂肪酸,保护和修复肠道上皮细胞,改善肠道结构,促进营养物质吸收,从而提高了摄食量、生长性能及肠道健康度,促使对虾摄入更多饲料和营养以满足自身生长及日常活动所需的能量。多糖因具有独特的功效与特点,目前已在水产养殖过程中发挥着重要作用。
血清中生化指标是反映养殖动物体内物质代谢和组织器官机能状态的重要指标[19]。总蛋白和胆固醇等指标变化是动物体内蛋白代谢和脂类吸收水平的体现,而尿酸是动物血清中蛋白质代谢分解后产生的,尿酸浓度越低,表明蛋白质分解的越少,其浓度也反映出动物体内的物质代谢是否正常[20-22]。本研究中,添加不同水平的裂褶菌多糖能提高对虾血清总蛋白浓度,胆固醇和谷草转氨酶无显著差异,尿酸浓度和谷丙转氨酶活性显著降低,与刘小玲等[9]研究的桦褐孔菌多糖对凡纳滨对虾生化指标影响的结果一致,表明饲料中添加裂褶菌多糖能减少蛋白质的异常消耗分解,保护对虾健康。
溶菌酶、总一氧化氮合成酶、酚氧化酶和碱性磷酸酶等是血清中的重要免疫酶,其活性高低直接反映对虾免疫能力的强弱,而增强免疫力和抗氧化能力是鱼虾预防病害的重要途径[23]。本研究中,添加裂褶菌多糖能提高对虾溶菌酶、酚氧化酶、碱性磷酸酶和总一氧化氮合成酶等免疫酶活性;还能增强总抗氧化能力、超氧化物歧化酶和过氧化氢酶活性,降低丙二醛浓度,且S2 组免疫酶活性和抗氧化能力显著高于对照组 (P<0.05)。杨娜等[15]将不同剂量的裂褶菌多糖灌喂小鼠发现,其对免疫力低下的小鼠有一定的恢复作用,可增强小鼠巨噬细胞的吞噬能力,当裂褶菌多糖质量浓度为2 000 μg·mL-1时,对结肠癌细胞增殖的抑制率可达45.32%。在水产饲料中添加多糖或单糖等免疫增强剂可显著提高凡纳滨对虾[8]、卵形鲳鲹 (Trachinotusovatus)[24]、刺参 (Stichopusjaponicus)[25]、大菱鲆 (Scophthalmusmaximus)[26]和舌齿鲈 (Dicentrarchuslabrax)[27]等养殖动物的溶菌酶、酚氧化酶等免疫酶活性和抗氧化能力,与本研究结果相似。但在实际养殖过程中,使用免疫增强剂提高养殖动物免疫力,其效果与使用剂量和时间有密切关系,有研究发现高剂量的β-1,3 葡聚糖会抑制鱼虾的生长,降低其免疫能力[28-30]。故在养殖过程中使用免疫多糖应确定适用剂量,以达到最佳的养殖效果。
肠道是机体消化吸收的主要器官,内含大量结构复杂的微生物菌群,承担着营养吸收的重任。微生物菌群与宿主之间存在着相互促进、相互依赖、相互制约的关系。通常来说,肠道菌群的多样性降低可能会使肠道菌群结构紊乱,增加机体的患病风险[31]。Wu 等[32]研究发现,厚壁菌门、软壁菌门、变形菌门、放线菌门和拟杆菌门等是健康凡纳滨对虾肠道中的主要组成门类,与本研究结果类似。有研究指出变形菌门通常在机体腐败中起重要作用,其含量过高可能会导肠道微生态环境发生改变、失调或者肠炎等,而厚壁菌门可帮助肠道发酵多糖、吸收营养等[33-34]。本研究中,添加裂褶菌多糖可提高对虾肠道上皮细胞高度,S2 和S3 组显著高于对照组 (P<0.05),变形菌门相对丰度降低。说明添加裂褶菌多糖调控了凡纳滨对虾的肠道菌群结构,降低了有害菌的相对丰度。有报道发现,鲁杰氏菌通过产生抑菌蛋白和密度感应淬灭酶等方式防控水产养殖病害,并且能够抑制发光弧菌 (Vibrio vulnificus) 等多种常见病原菌[35]。Pseudoruegeriasp.M32A2M 分泌的新化合物二酮哌嗪环 [Ala-Gly],对几种甲藻类有特定的杀藻活性,但对硅藻类无影响[36];而Muricauda则是一种潜在的有机污染物降解菌。陈晓瑛等[37]研究发现饲料中添加低聚木糖,对虾肠道的总菌和双歧杆菌数量显著高于对照组(P<0.05),肠道弧菌数量显著低于对照组 (P<0.05);Su 等[38]和潘金露[39]均报道了饲料中添加壳寡糖 (COS) 能够显著降低鱼类肠道弧菌属的相对丰度;殷朝敏等[40]将裂褶菌多糖的复合制剂应用于调控人体的肠道菌群,效果显著。与本研究添加裂褶菌多糖的S1 和S2 组中Formosa、Pseudoruegeria和Muricauda的相对丰度均显著高于对照组 (P<0.05),S2 和S3 组鲁杰氏菌属的相对丰度显著高于对照组 (P<0.05),而与对虾白便综合症相关的致病弧菌属[41]的相对丰度显著低于对照组(P<0.05) 的结果相似。这可能是由于多糖作为碳源能促进肠道内有益菌的增殖,同时多糖的结构物质与病原微生物外源凝集素相似,其与病原菌相结合,携带病原菌排出体外,减少了病原菌与肠道的结合[42]。从而起到调控养殖动物的肠道菌群结构、促进有益菌增殖、降低有害菌丰度的作用,进而减少肠道相关疾病的发生。
4 结论
饲料中添加1.0% 的裂褶菌多糖对凡纳滨对虾的生长性能、抗氧化能力和免疫力均有显著提升作用,同时还能调控肠道门和属水平上的菌群丰度,提高有益菌占比,降低有害菌占比。

