虾壳活性肽对斑马鱼氧化应激损伤的保护作用
贺舒雯朱豪杰韩鹏薇杨赛杰崔 波程云辉, 李虹辉文 李
(1. 长沙理工大学食品与生物工程学院,湖南 长沙 410114;2. 齐鲁工业大学食品科学与工程学院,山东 济南 250353)
克氏原螯虾(Procambarusclarkii)俗称小龙虾,是淡水经济虾类,其肉质细嫩、味道鲜美且营养价值高广受人们的喜爱。中国作为世界上最大的克氏原螯虾生产和消费国,每年产生数百万吨虾壳等副产物,绝大部分副产物被直接丢弃[1]。研究[2-4]表明,虾壳中富含蛋白质和各种矿物元素,酶解克氏原螯虾壳蛋白制备的生物活性肽含有丰富的氨基酸,可为机体提供所需的营养和能量。此外,虾壳活性肽在体外具有较强的自由基清除能力和还原能力,被证明具有较好的抗氧化潜力。但是,当前关于克氏原螯虾虾壳肽的研究主要集中在体外抗氧化活性评价,而对机体内抗氧化应激作用及机制研究鲜有报道。
生物活性肽(Bioactive peptides,BP)是由氨基酸通过肽键共价连接形成的有机物质,是蛋白质水解的中间产物,兼具氨基酸与蛋白质的生物学功能,在机体健康中发挥着重要作用[5]。已有研究报道,生物活性肽具有营养、促消化、抗氧化、抗炎和免疫调节等功能特性[6-7];生物活性肽可有效清除体内过剩的活性氧自由基,保护细胞和线粒体的正常结构和功能,还可促进超氧化物歧化酶和谷胱甘肽过氧化物酶活性,以及降低脂质过氧化产物丙二醛含量,在保护机体免受氧化应激损伤中起着重要作用[8-10]。氧化应激是机体内一种有害的氧化还原失衡状态,过多的活性氧自由基会对核酸、蛋白质、糖类、脂质等生物大分子造成氧化损害,影响细胞的功能甚至存活,是导致组织损伤和疾病发生的重要因素之一[11-12]。
研究[13]发现,酶解牙鲆肌肉蛋白制备的生物活性肽对AAPH诱导的Vero肾成纤维细胞氧化应激损伤具有保护作用。红鳍笛鲷鱼鳞肽可保护果蝇免受H2O2、百草枯和紫外线照射引起的氧化损伤[14]。来源于金乌贼中的抗氧化肽能提高超氧化物歧化酶活性,降低氧化损伤秀丽隐杆线虫体内活性氧和丙二醛含量,具有激活抗氧化防御、抑制自由基和脂质过氧化的作用[15]。王际英等[16]在饲料中添加适量的鳕鱼小肽显著提高了星斑川鲽幼鱼的消化酶活性和抗氧化能力,促进机体生长,并在一定程度上提升肌肉品质。Liu等[17]发现谷胱甘肽可增强中华绒螯蟹抗氧化能力,对脂多糖诱导的肝胰脏损伤和细胞凋亡具有保护作用。课题组[18]前期研究发现,日粮添加虾壳蛋白酶解物能显著促进斑马鱼生长,提升其抗氧化能力及核心生物中相关基因表达,有益于机体健康。研究拟利用酶解法制备虾壳活性肽,测定其体外抗氧化活性,并分析日粮添加虾壳活性肽对禁食胁迫下斑马鱼的生长性能、肌肉氨基酸含量、肌纤维组织形态及抗氧化功能的影响,以期为防治氧化应激损伤的相关疾病提供依据。
1 材料与方法
1.1 材料与试剂
克氏原螯虾壳粉:湖南省水产科学研究所;
斑马鱼:360尾,初始平均体重为(0.46±0.02) g,长沙学院水生动物营养与品质调控湖南省重点实验室;
斑马鱼饲料:安徽新彩虹饲料科技有限公司;
碱性蛋白酶:20万U/g,北京索莱宝科技有限公司;
1,1-二苯基-2-三硝基苯肼:98%,北京百灵威有限公司;
十水四硼酸钠:分析纯,国药集团化学试剂有限公司;
总超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶、还原型谷胱甘肽、丙二醛、蛋白质羰基等测定试剂盒:南京建成生物工程研究所;
RNA抽提试剂、SYBR Green qPCR Mix:莫纳生物科技有限公司;
荧光定量PCR引物:铂尚生物技术(上海)有限公司。
1.2 试验方法
1.2.1 虾壳活性肽制备及体外抗氧化活性分析 采用碱提酸沉法提取克氏原螯虾壳蛋白(PCSP),并测定其蛋白质含量。在pH 9.0,37 ℃条件下,按m虾壳蛋白∶V水=1∶20 (g/mL)将虾壳蛋白与水混合,碱性蛋白酶添加量为4 000 U/g,水解3 h。将水解产物置于沸水浴中处理10 min使酶失活,收集上清液,置于-20 ℃预冻12 h后进行真空冷冻干燥,具体参数为:冷阱温度-60 ℃,真空度10 Pa左右,干燥48 h,获得虾壳活性肽(PCSBP)冻干粉,并评估其体外抗氧化活性。通过测定1,1-二苯基-2-三硝基苯肼自由基(DPPH·)和羟自由基(·OH)清除能力,分析其体外抗氧化活性,并使用液相色谱—串联质谱(LC-MS/MS)测定虾壳活性肽序列。
1.2.2 试验动物与饲养管理 选取360尾健康、性成熟且规格大小相一致的野生型斑马鱼,初始平均体重为(0.46±0.02) g,将其随机分为正常组(ND)、禁食组(FA)、禁食后恢复投喂基础日粮组(FR-ND)和禁食后恢复投喂虾壳活性肽日粮组(FR-PCSBP)4个组,每组设置3个重复,每个重复30尾鱼。斑马鱼在循环水养殖系统中饲养,水温保持在24~26 ℃,采取定时投喂策略,试验周期为14 d。
1.2.3 斑马鱼生长指标及肌肉氨基酸含量测定 试验结束后,分别对各组斑马鱼进行称重和测量,计算存活率、终末体重和终末体长等指标,分析虾壳活性肽对禁食胁迫下斑马鱼生长性能的影响。称取斑马鱼新鲜肌肉组织50~100 mg,利用氨基酸自动分析仪测定氨基酸含量。
1.2.4 肌肉组织形态及超微结构特性 取新鲜肌肉组织用4%多聚甲醛固定液固定24 h后,制作石蜡切片并进行苏木素—伊红(HE)染色,通过光学显微镜观察肌肉组织形态变化。将1 mm3大小组织置于2.5%戊二醛固定液中固定,再用四氧化锇固定后制作超薄切片,用乙醇脱水,再用乙酸铀酰和柠檬酸铅染色,透射电镜观察肌肉超微结构变化并采集图像。
1.2.5 抗氧化物质及氧化应激指标测定 称取100 mg肌肉样品,按m肌肉∶V生理盐水=1∶9 (g/mL)比例加入生理盐水,在冰浴条件下用匀浆仪进行组织匀浆,4 ℃、4 000 r/min离心15 min,收集上清液待测。采用南京建成生物工程研究所提供的试剂盒测定肌肉超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-PX)活性和谷胱甘肽(GSH)含量,以及氧化应激指标丙二醛(MDA)和蛋白质羰基(PC)含量。
1.2.6 抗氧化相关基因表达分析 称取新鲜肌肉样品50~100 mg,采用Trizol法提取总RNA,经1%琼脂糖凝胶电泳检测后逆转录为cDNA。使用SYBR Green qPCR Mix试剂在Bio-Rad CFX96TM系统中进行抗氧化相关基因(nrf2、keap1、sod1、sod2、cat、gpx1a、gpx1b、gpx2、gpx3、gsta1、gstm1、gstr、gstz1、gsr)表达分析,荧光定量PCR引物序列如表1所示。
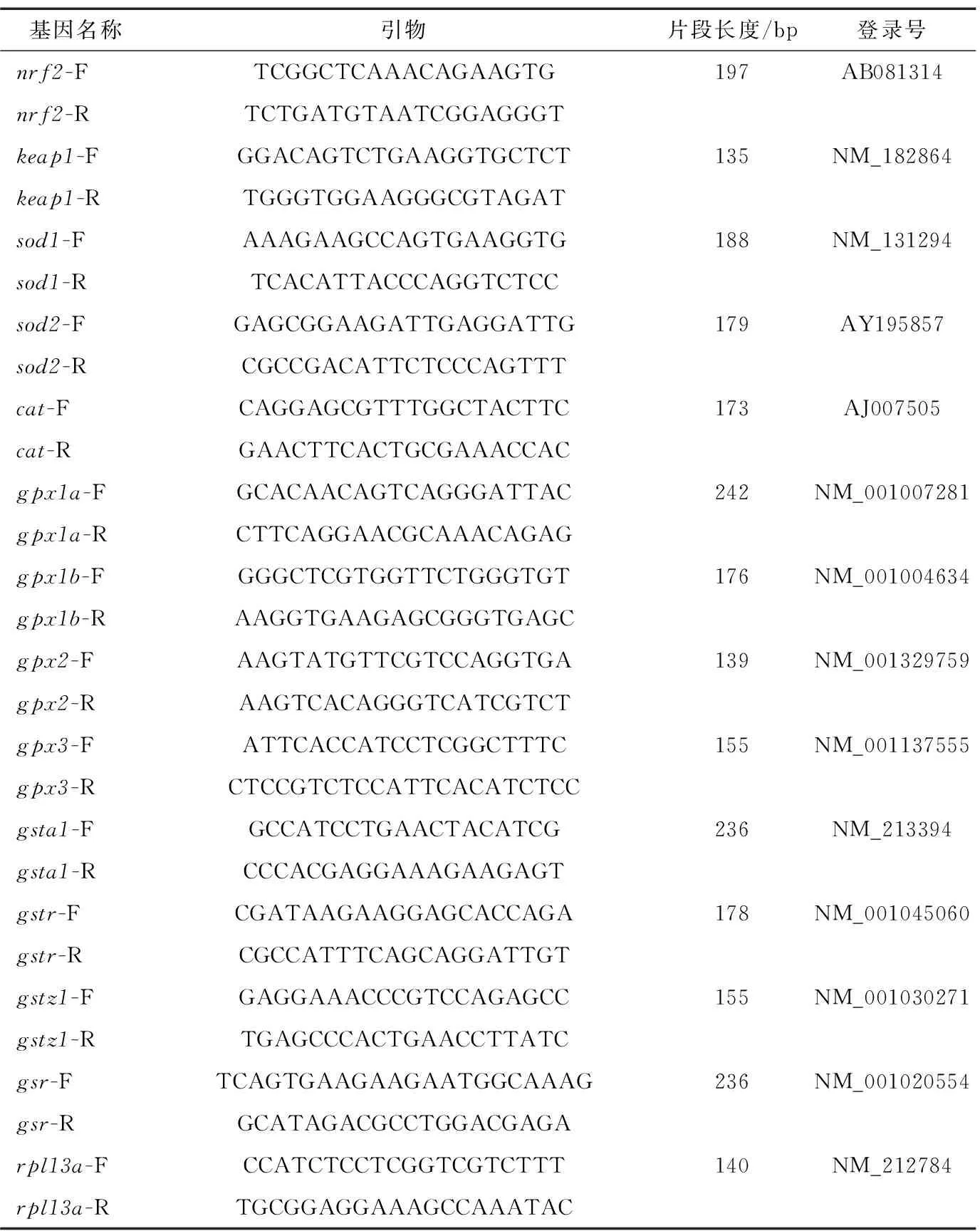
表1 实时荧光定量PCR引物序列†
1.2.7 统计分析 数据采用SPSS 18.0软件进行单因素方差分析(One-way-ANOVA)与显著性检验,所有数据均以平均值±标准误差表示,Duncan法确定各组间的显著性差异(P<0.05)。
2 结果与分析
2.1 虾壳活性肽体外抗氧化活性分析及肽序测定
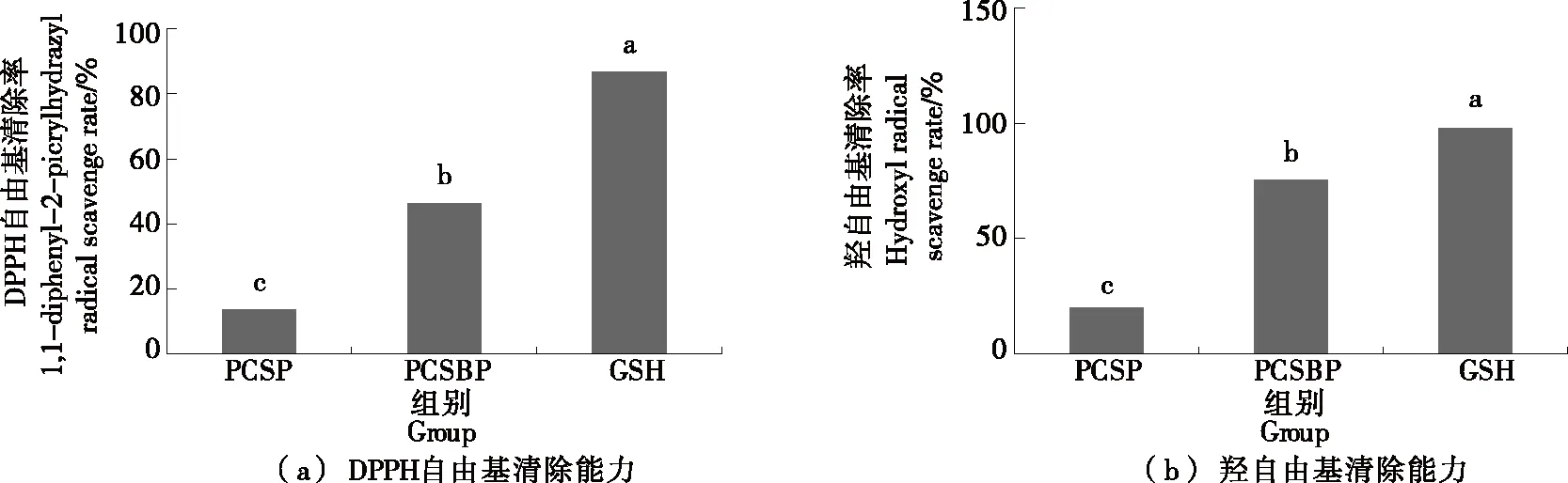
利用碱性蛋白酶对虾壳蛋白进行水解后获得虾壳活性肽,并对其进行体外抗氧化活性分析(图1)及肽序测定(图2)。结果显示,酶解后获得的虾壳活性肽对DPPH自由基和羟自由基清除率为(46.35±1.32)%,(75.22±2.18)%,分别是谷胱甘肽的0.53倍和0.77倍,表现出潜在的抗氧化活性;采用LC-MS/MS法测定虾壳活性肽序列,结果统计发现2 769条匹配肽谱,其中肽序列为1 600条,蛋白质组数量为122个,具有特征肽段的蛋白质140个。已有研究[3]表明,酶解克氏原螯虾壳制备的生物活性肽含有丰富的氨基酸,并具有较强的还原能力和羟自由基清除能力。唐志红等[4]利用克氏原螯虾副产物分离蛋白为原料,以胰酶酶解制备肽混合物,并通过体外抗氧化试验发现酶解产物具有较强的抗氧化活性。
字母不同表示差异显著(P<0.05)

图2 肽谱匹配分数分布及肽谱匹配的前体质量误差
2.2 虾壳活性肽对斑马鱼生长性能的影响
通过测定虾壳活性肽对禁食胁迫下斑马鱼生长性能的影响(表2)可知,各组之间斑马鱼存活率无显著差异(P>0.05),禁食组中斑马鱼终末体重和终末体长均明显下降(P<0.05);当恢复正常饮食后斑马鱼生长性能有所改善,但低于正常组水平,而恢复含虾壳活性肽饮食后斑马鱼生长性能逐渐恢复到正常组水平,说明日粮添加虾壳活性肽能有效改善禁食胁迫下斑马鱼的生长性能。
2.3 虾壳活性肽对斑马鱼肌肉氨基酸含量的影响
通过测定虾壳活性肽对禁食胁迫下斑马鱼肌肉氨基酸含量的影响(表3)可知,与正常组相比,禁食组中斑马鱼肌肉氨基酸总量明显下降,必需氨基酸和呈味氨基酸含量也呈下降趋势,当恢复正常饮食后肌肉氨基酸总量、必需氨基酸和呈味氨基酸含量均有所升高,但未达到正常组水平,而恢复含虾壳活性肽饮食后斑马鱼肌肉氨基酸总量、必需氨基酸和呈味氨基酸含量均恢复到正常组水平,说明日粮添加虾壳活性肽有助于氨基酸合成。

表3 虾壳活性肽对禁食胁迫下斑马鱼肌肉氨基酸含量的影响
2.4 虾壳活性肽对斑马鱼肌肉组织结构的影响
通过观察虾壳活性肽对禁食胁迫下斑马鱼肌肉组织结构的变化(图3)可知,与正常组相比,禁食后可见斑马鱼肌细胞间隙增宽,肌纤维出现部分断裂现象,胞质轻微水肿,有空泡形成,当恢复正常饮食后肌纤维排列相对规则,细胞间隙减少,肌肉组织结构有所恢复,但肌纤维仍有少量断裂现象,而在恢复含虾壳活性肽饮食后肌肉组织排列整齐紧密,肌纤维未见明显断裂,Z线连续,H带结构清晰,水肿程度降低,肌肉组织结构基本恢复到正常组水平。研究[19]发现,正常斑马鱼胚胎在受精后24~120 h时,肌原纤维超微结构正常,排列整齐,Z线、M线清晰可见,而随着槟榔碱处理后,斑马鱼肌纤维排列和超微结构形态发生了显著变化,并出现细胞质空泡、线粒体肿胀等现象。此外,正常斑马鱼心肌纤维细胞间丝连接紧密,Z线、H带和明暗带也能清晰区分,当经过三氯生暴露后,肌细胞核膜轻微起皱,肌丝间隙有一定水肿迹象,肌丝断裂,H带和明暗带难以区分[20]。这与禁食后斑马鱼呈现出的肌肉组织及超微结构变化均有相似之处,说明当机体遭受应激后会造成肌肉组织损伤。
2.5 虾壳活性肽对斑马鱼肌肉抗氧化功能的影响
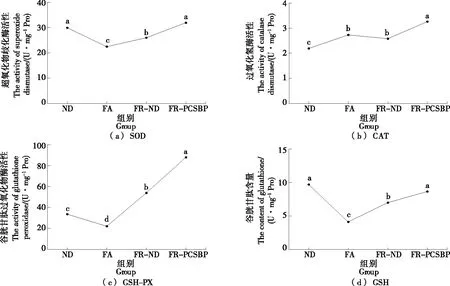
通过对斑马鱼肌肉抗氧化酶活性(图4)和氧化应激损伤(图5)指标的测定与分析可知,禁食组中肌肉抗氧化酶SOD、GSH-PX活性和GSH含量均有不同程度降低,氧化应激损伤指标MDA、PC含量显著增加(P<0.05)。与禁食组相比,恢复正常饮食组中SOD、GSH-PX酶活性及GSH含量得到显著提高,并降低了MDA含量(P<0.05),而在恢复含虾壳活性肽饮食组中,抗氧化酶SOD、CAT、GSH-PX活性和GSH含量均显著提升,且恢复到正常饮食水平,同时还显著降低了MDA、PC含量(P<0.05),有效地改善了斑马鱼肌肉氧化应激损伤。
字母不同表示差异显著(P<0.05)

字母不同表示差异显著(P<0.05)
禁食胁迫诱导机体内生成过量自由基,使组织受到氧化损伤[21]。GSH-Px是机体中清除脂质过氧化物和过氧化氢的重要抗氧化物[22-23],受禁食胁迫后其活性显著下降,其根本原因是由于禁食使机体不能够合成充足的氨基酸,导致GSH合成受阻,而GSH作为GSH-Px发挥作用的辅助底物,GSH含量下降,GSH-Px的活性必定下降[24]。细胞中多不饱和脂肪酸过氧化会产生MDA,而MDA含量是评价脂质氧化性损伤的重要指标[25]。吴晓雲等[26]研究发现,禁食7 d长江鲟肌肉组织中的MDA含量上升和GSH-Px活力下降,与试验过程中禁食胁迫下斑马鱼肌肉组织发生的变化一致,说明禁食使斑马鱼肌肉抗氧化能力下降。在斑马鱼摄食后,机体合成氨基酸的底物得到补充,氨基酸开始合成,GSH得到补充,随之GSH-Px活力也上升。
2.6 虾壳活性肽对斑马鱼肌肉抗氧化相关基因表达的影响
通过对斑马鱼肌肉抗氧化相关基因表达的测定与分析(图6),结果显示,禁食组中斑马鱼肌肉抗氧化酶基因sod1、sod2、cat、gpx1a、gpx2、gstm1、gstr、gstz1、gsr转录水平较正常组显著降低(P<0.05),当恢复正常饮食后,sod1、sod2、cat、gpx1a、gpx2、gstm1、gstz1、gsr表达明显升高,而在恢复含虾壳活性肽饮食后,发现抗氧化信号分子nrf2转录水平显著下调,keap1明显上调,其下游抗氧化酶基因sod1、sod2、cat、gpx1a、gpx2、gpx3、gstm1、gstr、gstz1、gsr表达显著升高且部分基因表达量达到最高值(P<0.05),说明增加了斑马鱼肌肉组织抗氧化防御能力,以改善禁食诱导的氧化应激损伤。
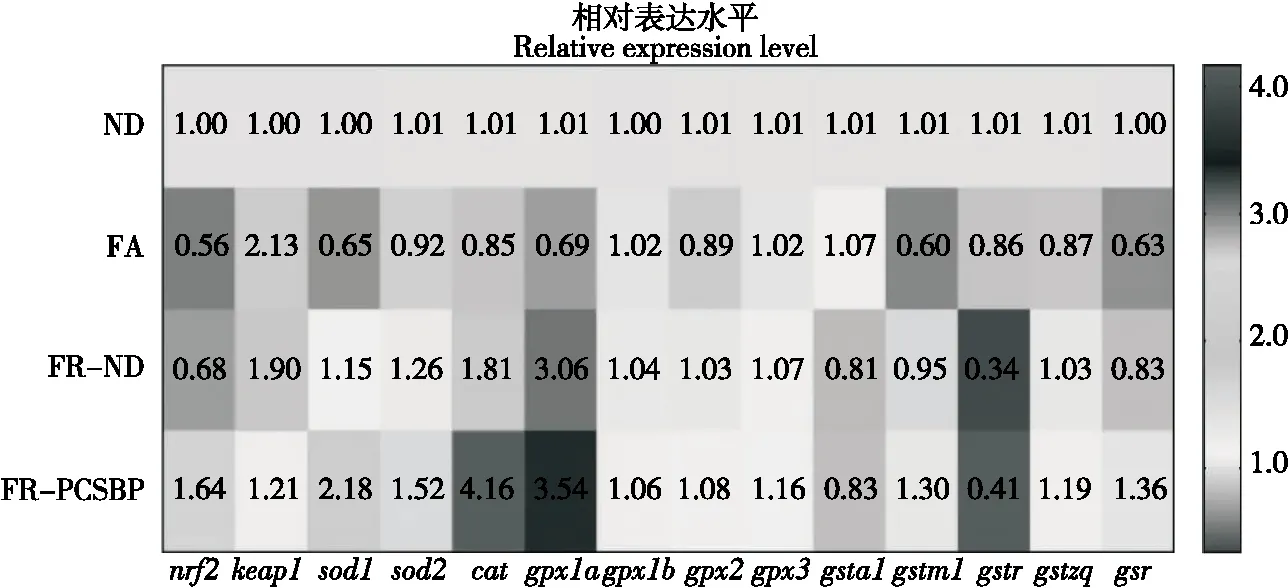
图6 虾壳活性肽对斑马鱼肌肉抗氧化相关基因表达的影响
Kelch样环氧氯丙烷相关蛋白1(Kelch-like ECH-associated protein 1,keap1)-核因子E2相关因子2(Nuclear factor-erythroid 2-related factor-2,nrf2)是维持过氧化物和抗氧化平衡的重要信号通路。已有研究[27]证明,nrf2是一种关键的转录因子,通过与其下游抗氧化酶基因启动子区域的抗氧化反应元件ARE结合,促进抗氧化酶基因(sod、cat、gpx、gst等)转录表达。Deng等[28]研究报道,上调nrf2表达可提高肌肉中sod、cat、gpx和gst基因的表达。研究在饮食中添加虾壳活性肽后,斑马鱼肌肉nrf2表达显著上调,keap1下调并恢复至正常饮食水平,其下游抗氧化酶活性及基因表达得到显著提高,并显著降低了MDA、PC含量,有效减轻了肌肉氧化应激水平,恰好佐证了上述结论。
3 结论
研究利用酶解法制备得到了虾壳活性肽,在体外表现出潜在的抗氧化活性,而在日粮中添加虾壳活性肽可显著提高禁食胁迫下斑马鱼肌肉超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-PX)活性和谷胱甘肽(GSH)含量,并降低丙二醛(MDA)和蛋白质羰基(PC)的生成量。此外,还显著增加抗氧化酶基因表达,并且上调抗氧化信号分子nrf2以及下调keap1表达水平,进而增强斑马鱼抗氧化功能,缓解机体氧化应激损伤。研究证明虾壳活性肽对氧化应激损伤具有一定的保护作用,但对于虾壳活性肽的分离提纯以及在机体中的分子机制尚不清楚,有待进一步深入研究。

