改良Mohs显微描记手术在原发性乳房外Paget病中的应用
谢 凯 郭 璇 耿建辉 王学庆 王金良 刘国艳
山东第一医科大学附属皮肤病医院(山东省皮肤病医院),山东省皮肤病性病防治研究所,山东济南,250022
乳房外Paget病(extramammary Paget’s disease,EMPD)是一种临床少见的皮肤恶性肿瘤,可以是原发的上皮内腺癌,也可以是继发于邻近组织的原位肿瘤或侵袭性肿瘤的Paget样播散。原发性EMPD治疗首选手术切除,继发性EMPD需查找原发肿瘤[1]。EMPD具有侵袭性,可突破基底膜带累及真皮;或沿着毛囊和汗腺导管上皮呈浸润性生长;晚期可通过淋巴系统转移。肿瘤细胞上皮内呈播散性生长,肉眼观察难以判断肿瘤边界,手术切除后肿瘤复发率高;加之肿瘤细胞呈空泡化改变,快速冰冻切片难以识别,增加了快速冰冻切缘的假阴性率。传统外科手术需要通过扩大切除范围或者多次切除来解决亚临床病灶识别难的问题,极大增加了手术创伤和手术经济负担。莫氏显微描记手术(Mohs microsurgery,MMS)极大缩小手术切除范围,但不能解决快速冰冻造成的切缘假阴性,且因手术耗时、流程繁琐,极大限制了临床推广使用。因此,为提高手术成功率、降低切缘假阴性率,笔者团队开展了多种改良Mohs显微描记术式治疗原发性EMPD。
我们回顾分析了2021年8月至2022年12月在我院皮肤外科收治的原发性EMPD患者8例,分别采用不同术式治疗,其中2例患者采用传统扩大切除治疗(wide local excision,WLE),3例采用周围组织的快Mohs手术(rapid peripheral MMS,rpMMS)治疗,3例采取周围组织的慢Mohs手术(slow peripheral MMS,spMMS)治疗,对诊疗过程、治疗效果进行总结分析。
1 材料和方法
1.1 一般资料 pEMPD患者8例,均为男性,患者皮疹均位于外阴部位,术前局部活检、术后组织病理检查诊断为EMPD,常规术前检查无明显手术禁忌。术前行光动力联合Wood灯确定肿瘤边缘,2例患者行WLE治疗,3例患者行rpMMS治疗,3例患者行spMMS治疗。见表1。
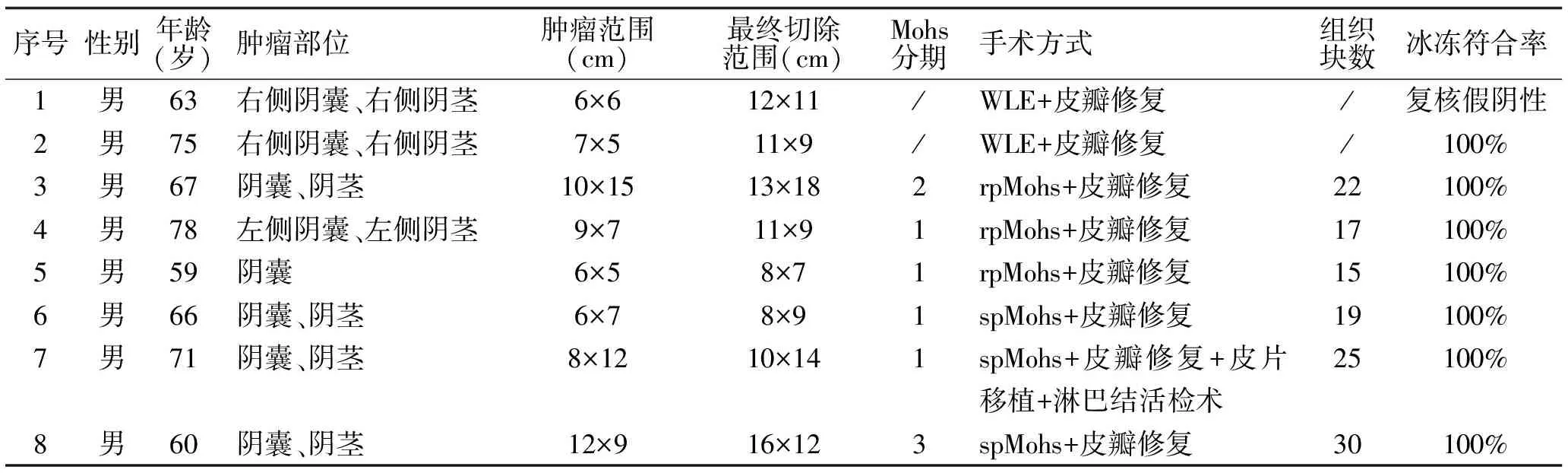
表1 各病例患者临床特点
1.2 治疗方法
1.2.1 术前光动力(photodynamic therapy,PDT) 术前常规备皮,取5-氨基酮戊酸(商品名:艾拉/ALA,上海复旦张江生物医药有限公司,118 mg/支),加入注射用水配置浓度为20%,无菌棉浸润溶液后湿敷皮损及其周围5 cm区域,封包3 h后局部清洗,Wood灯下确定肿瘤边界,亚甲蓝标记。
1.2.2 手术操作 (1)WLE:沿术前标记肿瘤外缘2 cm标记手术切缘,缝线标记6、12点位,病理送检多点活检;如切缘阳性,则对应方位再次扩切至获得阴性切缘。(2)rpMMS:沿术前标记肿瘤外缘1 cm标记手术切缘,切缘分区并在模式图上标记编号。全麻或局麻下,沿标记手术切缘切开皮肤;若切除范围达耻骨联合处,切除深度达脂肪中深层,至未见明显毛囊结构;阴囊、阴茎处切除深度达肉膜中层。完整切除肿瘤后,根据术前分区,将切缘分区快速冰冻送检,外侧缘予以绿色生物染料标记,肿瘤底面予以多点冰冻活检。如提示切缘阳性,则继续于阳性分区切缘处扩切送检,直至切缘未见Paget细胞。创面采用直接缝合、皮瓣修复、皮片移植等方式修复,肿大淋巴结予以行淋巴结活检。(3)spMMS:一期手术确定手术切缘,沿术前标记肿瘤外缘1 cm标记手术切缘,切缘分区并在模式图上标记编号。局麻下,沿标记手术切缘切开皮肤,切除2~3 mm宽环形切缘组织,各部位深度同上,根据术前分区,将环形切缘组织分区切块为(2~3) mm×(6~10) mm大小条形组织,外侧缘绿染,组织固定液固定常规病理送检。手术创面充分止血后,油纱条填塞缝线固定,创面包扎。待常规病理结果,如提示切缘阳性,则重复一期手术,于阳性分区切缘处阔切送检,直至切缘净。二期手术:全麻或局麻下根据一期手术确定切缘,予以切除中央肿瘤及阔切组织,肿瘤底面予以多点冰冻活检,创面修复、淋巴结活检同上。
2 结果
8例患者术后创面均愈合良好,无术后感染、皮瓣皮片坏死情况。各患者术后病理复核均为EMPD,1例WLE治疗患者冰冻切片术后常规组织病理复核出现假阴性切缘,予以局部放射治疗,其余WLE、rpMMS治疗患者未出现假阴性切缘。随访5~19个月,8例患者均无肿瘤复发,部分患者外阴结构轻度牵拉,日常生活无影响,治疗效果满意。
3 典型病例
3.1 病例1、2(图1、2) 术前检查排除远处转移,完善术前准备,20%ALA溶液封包3 h后Wood灯下确定肿瘤边界,亚甲蓝标记。局麻下行rpMMS,底切缘多点活检。病例1患者经一次扩切取得阴性切缘,后行任意皮瓣修复创面。

图1 病例1(1a~1d):术前20%ALA辅助判断肿瘤边缘;rpMMS;Mohs stage II,行任意皮瓣修复创面 图2 病例2(2a~2d):术前20%ALA辅助判断肿瘤边缘;rpMMS;Mohs stage I,行任意皮瓣修复创面;rpMMS,切缘送检
3.2 病例3、4(图3、4) 术前20%光动力确定肿瘤边界,一期手术局麻或全麻下行spMMS,切缘送检,常规病理示切缘净。二期手术局麻下切除中央肿瘤及扩切组织。病例3患者行任意皮瓣修复创面;病例4患者阴囊处任意皮瓣、阴茎处皮片移植修复创面,同时于右侧腹股沟行肿大淋巴结活检,术后病理结果表明淋巴结内未见肿瘤细胞(图5)。

图3 病例3:3a:术前20%ALA辅助判断肿瘤边缘;3b:标记手术切缘;3c、3d:一期spMMS切缘送检;3e、3f:切缘净,二期切除中央肿瘤组织;3g、3h:阴囊处任意皮瓣、阴茎处皮片移植修复创面
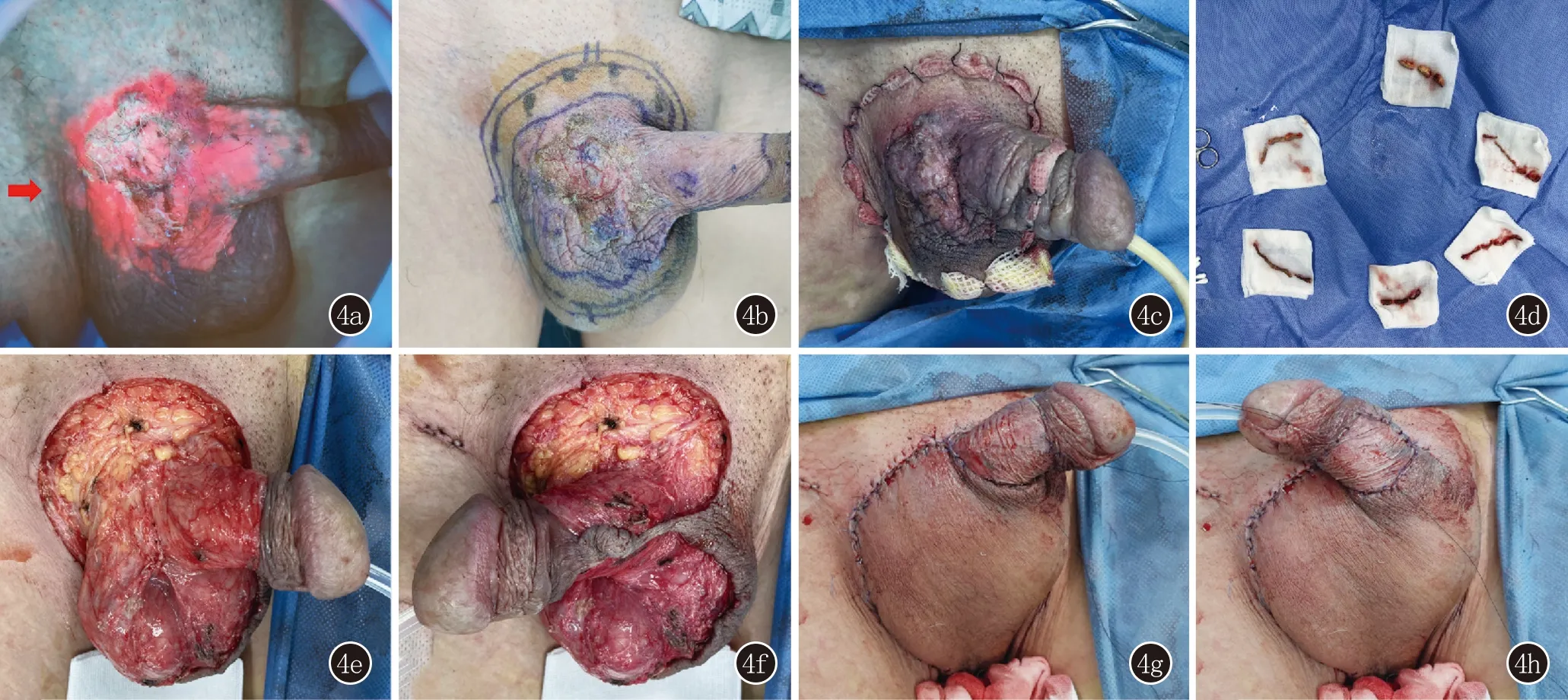
图4 病例4:4a:术前20%ALA辅助判断肿瘤边缘,右侧腹股沟可见亚临床病变皮肤(红色箭头);4b:标记手术切缘;4c、4d:一期spMMS切缘送检;4e、4f:切缘净,二期切除中央肿瘤组织;4g、4h:阴囊处任意皮瓣、阴茎处皮片移植修复创面

图5 5a:表皮层可见大量Paget细胞(HE,×100);5b:肿瘤细胞表达CK7阳性(免疫组化,×100)
4 讨论
EMPD是一种临床少见的皮肤恶性肿瘤,原发性EMPD以手术切除为首选治疗方法。该病好发于50岁以上成年人,多数病变组织局限于表皮内,若病理提示肿瘤细胞沿汗管往真皮或皮下浸润,则提示淋巴转移风险,预后相对较差[2]。EMPD术前边界定位通常较为困难,肿瘤细胞存在跳跃式生长,可出现多中心性分布弥散性扩散,术前单纯肉眼观察难以划定有效手术范围,术后复发率较高[3]。目前对于EMPD,缺乏统一的临床分期方案,手术治疗方案多样,缺乏较为统一的诊疗指南或共识[4]。
4.1 外科手术切除方式的选择 目前公认的手术切除方法主要为WLE和MMS,手术目标均为追求病理学阴性的手术切缘[5]。见表2。
WLE治疗EMPD存在较高的肿瘤复发率,可达30%~60%[6],部分学者推荐初始切缘为3~5 cm[7],因此通常会造成较大创面,需要复杂皮瓣修复,手术并发症多、术后致畸率较高。
MMS可以做到100%切缘检测,理论上较WLE更适用于EMPD的治疗[8],但EMPD的多中心性及跳跃性,增加了传统MMS实际操作的困难,对于大范围皮损患者并不适用[5]。O’Connor等[9]首次报道采用周围组织的Mohs手术(peripheral MMS,pMMS)治疗EMPD,仅对周围切缘组织进行实时冰冻检查,中心组织切除深度至皮下中层,该方法简化流程节省大量手术时间,术后复发率并没有明显提高。万苗坚等采用pMMS治疗28例EMPD患者,平均冰冻切片次数1.86次,取得较好的疗效。
Yumiko通过采用标记活检(Mapping biopsies)对133例原发性EMPD患者进行总结分析,建议:边界清晰的EMPD起切范围为1 cm,边界不清晰EMPD皮损起切可扩至2 cm[10]。因此,我们实行较大安全距离pMMS(1cm)[11],优先考虑快速的切除肿瘤,同时保证了MMS 100%监测切缘的特点。
本研究中MMS治疗患者,4例Mohs分期为1期,1例为2期,1例为3期,因此我们认为在采用pMMS治疗pEMPD过程中,1 cm起切范围可取的较好疗效。WLE组中1例患者术后切缘组织复核报告阳性,rpMMS组与spMMS组患者术后切缘复核均未出现阳性。与WLE相比,MMS治疗EMPD可以更有效的切除肿瘤,保留更多正常组织,减少手术创伤。
4.2 术前PDT目的 EMPD边界通常不清晰,存在亚临床皮损。PDT可在肿瘤细胞内发生光化学反应和氧化反应,伍德灯下表现为强荧光。通过术前PDT,可筛查亚临床皮损,更准确地确定起切范围,减少手术扩切次数。
4.3 rMohs与sMohs的选择 冰冻切片检查无法可靠地评估EMPD的组织切缘,假阴性率高达10.4%~13.2%[11]。其主要原因可能是:(1)诊断经验不足;(2)冰冻切片的表皮空泡化表现影响诊断准确性;(3)外阴处皮肤回缩内卷明显,快速制片困难。慢Mohs显微描记术(slow Mohs microsurgery,sMMS)是将皮肤外科技术与常规组织切片相结合的一种特殊手术方法。虽然石蜡切片提供报告时间延迟,但其切片质量、诊断准确性更高。Möller等[12]采用切缘分期切除技术治疗EMPD,一期环形切除2~3mm切缘组织,创面对边缝合,石蜡切片评估切缘;二期手术切除中央组织修复创面。该方法不仅对手术切缘充分评估,避免冰冻切片的不准确性,同时避免了中央大面积皮损切除后的长时间创面暴露,减少手术感染、术后出血等风险。我们借鉴了该术式,并予以改良,切缘使用油纱条进行填塞避免了切缘肿瘤种植可能,待石蜡切片提示阴性切缘,再予以二期手术。
在本研究中,虽然rpMMS组患者的冰冻符合率为100%,但在实际切片制片、切片判读中,对病理科制片员及病理科医师有较高要求,难度较大。相信随着样本量的增加,spMMS势必优于rpMMS。在实际临床工作中,手术方式的选择需要根据患者的基础情况、皮损范围、病理科实际情况等多种因素充分评估后制定合适治疗方案。
4.4 底切缘评估与预后 术前准确判断肿瘤侵犯深度对判断疾病预后有重要作用。MMS治疗EMPD仅能观察周围切缘组织,对于中央肿瘤组织的侵犯深度并不能做到有效评估。为减少大面积EMPD患者实行MMS的时间, Hendi等[13]采用“周围Mohs手术(peripheral Mohs)”,对于>8 cm的皮损周围切缘采用Mohs技术,中央肿瘤区域切除深度到达皮下中层,术后肿瘤复发率明显低于WLE。
为弥补pMMS无法评估底切缘的缺陷,O’Connor、Long等[8,14]予以改良,手术切除深度达深筋膜,采用面包片法处理中央肿瘤组织,以保证中央肿瘤区底切缘的筛查。但笔者在实际操作中发现,该流程操作繁琐,且由于阴囊、阴茎处皮肤活动度大,切除皮损回缩明显,中央肿瘤组织底切缘分区后难以与创面对应,无法保证准确性。对此,我们放弃了面包片法处理中央肿瘤组织全面评估底切缘,采取底切缘多点活检的方式进行评估。通常,手术切除深度达脂肪中深层、肉膜中层可得到阴性底切缘。
目前EMPD缺乏统一的治疗方案,阴性切缘可有效降低术后复发率,MMS可在保留较多正常组织的基础上100%检测切缘,pMMS可在保证诊疗质量前提下提高治疗效率,sMMS可有效规避EMPD冰冻切片的不准确性及大面积创面暴露的感染、出血风险。对于EMPD患者手术方式的选择应该根据患者基本情况、皮损范围制定个性化治疗方案。本研究由于样本量较少,部分患者随访时间短,在以后的研究中需进一步随访以说明上述结论的准确性。

