血清TIMP-1、TGF-β1水平对瘢痕子宫再次妊娠产后出血的预测价值
朱立艳,耿炜,李晓鹏,李建波,李爱华,田志勇
(邯郸市第一医院妇产科,河北 邯郸 056004)
瘢痕子宫的产生主要是由于女性行剖宫产、子宫肌瘤剔除等手术后,子宫因受到创伤而留下瘢痕[1-2]。瘢痕子宫产妇再次妊娠分娩时风险较高,并且术后常伴发并发症,产后出血是较为常见的并发症之一[3-4]。产后出血主要表现为产妇产后24 h内阴道出血量超过500 mL,严重时将导致失血性休克[5]。因此,准确预测瘢痕子宫再次妊娠产妇是否发生产后出血对于保障其生命安全具有重要意义。基质金属蛋白酶组织抑制因子-1(tissue inhibitor of metalloproteinase-1,TIMP-1)是基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)的抑制剂,在机体各组织及器官中均有表达,能通过稳定MMP-9活性、避免MMP-9过度激活来维持细胞外基质的稳定[6]。转化生长因子-β1(transforming growth foctor-beta1,TGF-β1)是TGF-β超家族的一员,其主要由血液中的血小板及白细胞分泌,不仅能促进细胞外基质蛋白的合成,还能通过抑制炎症细胞的激活,减少机体中炎症反应的发生[7-8]。有研究发现,TIMP-1和TGF-β1与子宫内膜间质细胞及组织的形成、生长等有关,可能与产妇妊娠结局有关[9];但关于TIMP-1、TGF-β 1对瘢痕子宫再次妊娠产妇以及产后出血的影响尚需进一步研究。基于此,本研究检测瘢痕子宫再次妊娠产妇血清TIMP-1、TGF-β1表达水平,并分析二者联合预测瘢痕子宫产妇产后出血的效能。
1 资料与方法
1.1 临床资料
选取2019年3月至2021年12月在本院分娩的瘢痕子宫再次妊娠产妇217例,年龄26~35岁,平均(30.23±2.45)岁,根据是否并发产后出血分为观察组(137例,发生产后出血)和对照组(80例,未发生产后出血)。2组产妇年龄、BMI、舒张压等一般资料比较无显著差异(P>0.05)。纳入标准:①经临床检查及B超确诊为瘢痕子宫;②二次分娩;③此次妊娠距上次剖宫产时间在2年以上;④经B超检测确定为单胎;⑤年龄≥18岁。排除标准:①合并高血压、甲亢、糖尿病等疾病;②伴有凝血功能障碍;③妊娠期进行抗凝治疗;④心、肝、肾等器官功能障碍;⑤合并神经疾病。收集所有研究对象的年龄、分娩孕周、孕次、子宫瘢痕厚度、两次妊娠间隔时间及刮宫次数等临床资料。本研究经我院医学伦理委员会审批(2019-01108),患者及家属对本研究知情且同意。
1.2 血清TIMP-1、TGF-β1表达水平检测
采集所有产妇入院次日清晨空腹静脉血5 mL,3 000 r/min离心10 min,收集上清液,于-80 ℃保存,待检。采用酶联免疫吸附法测定血清TIMP-1和TGF-β1表达水平。
1.3 统计学方法
采用SPSS 25.0统计软件对数据进行分析,计数资料以率(%)表示,采用χ2检验,计量资料以均数±标准差(x-±s)表示,两组间比较行t检验。Pearson法分析血清TGF-β1和TIMP-1表达水平的相关性;采用Logistic多因素回归分析瘢痕子宫再次妊娠产妇发生产后出血的影响因素;采用受试者工作特征(receiver operating characteristic,ROC)曲线分析血清TGF-β1和TIMP-1预测瘢痕子宫再次妊娠产妇发生产后出血的效能,曲线下面积(area under the curve,AUC)比较采用Z检验;P<0.05为差异具有统计学意义。
2 结果
2.1 2组血清TIMP-1、TGF-β1水平
观察组血清TIMP-1水平高于对照组,血清TGF-β1水平低于对照组,差异均有统计学意义(P<0.05),见表1。
2.2 观察组血清TIMP-1与TGF-β1的相关性分析
Pearson法分析显示,观察组患者血清TIMP-1与TGF-β1的表达呈负相关(r=-0.935,P<0.05),见图1。
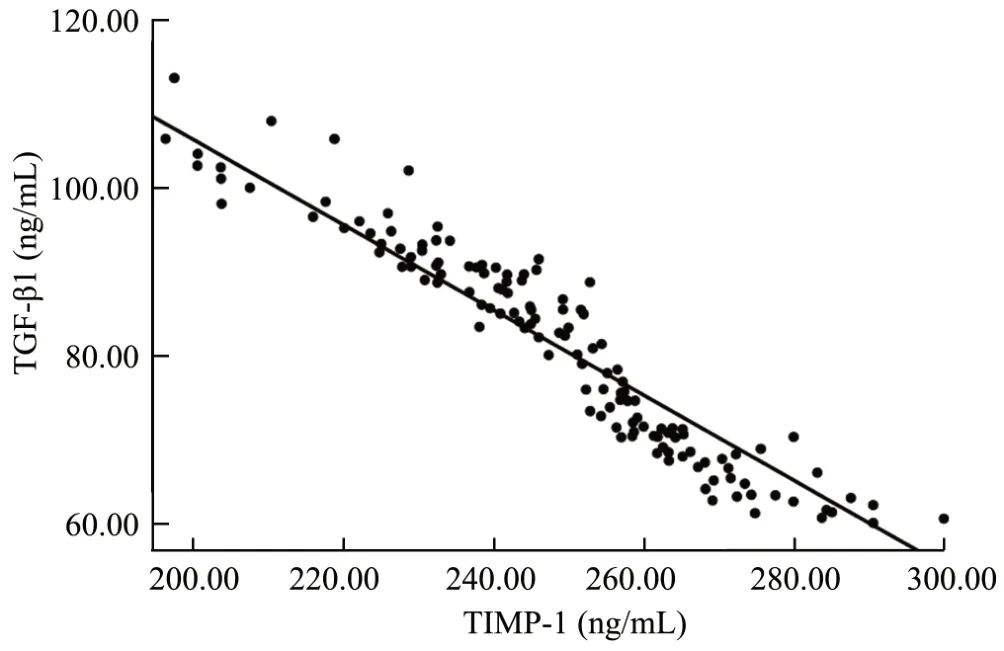
图1 观察组患者血清TIMP-1与TGF-β1的相关性分析
2.3 瘢痕子宫再次妊娠产妇发生产后出血的单因素分析
单因素分析结果显示,2组年龄、孕次及两次妊娠间隔时间比较,差异无统计学意义(P>0.05),而观察组分娩孕周<40周、子宫瘢痕厚度<4 mm、刮宫次数≥2次的患者比例均高于对照组(P<0.05),见表2。

表2 影响瘢痕子宫再次妊娠产妇发生产后出血的单因素分析[例(%)]
2.4 瘢痕子宫再次妊娠产妇发生产后出血的多因素分析
以瘢痕子宫再次妊娠产妇是否发生产后出血为因变量(是=1,否=0),分娩孕周(<40周=1,≥40周=0)、子宫瘢痕厚度(<4 mm=1,≥4 mm=0)、刮宫次数(≥2次=1,<2次=0)、TIMP-1(连续变量)、TGF-β1(连续变量)为自变量,行Logistic多因素回归分析,结果显示,分娩孕周<40周、子宫瘢痕厚度<4 mm、刮宫次数≥2次、TIMP-1均为瘢痕子宫再次妊娠产妇发生产后出血的危险因素(P<0.05),而TGF-β1为保护因素(P<0.05),见表3。
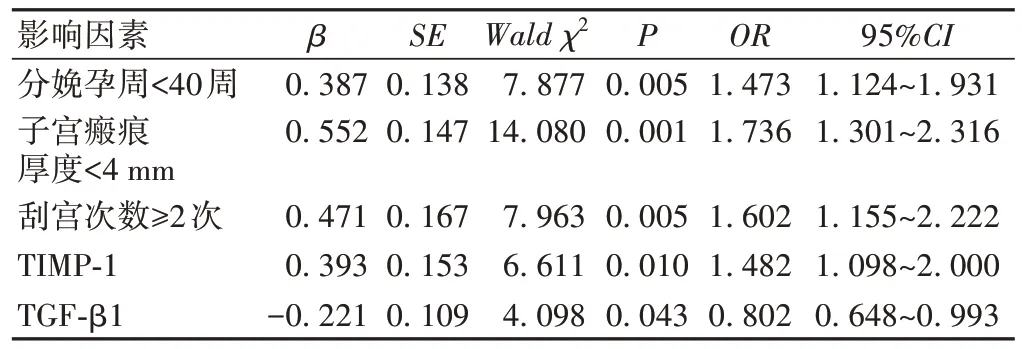
表3 影响瘢痕子宫再次妊娠产妇发生产后出血的多因素分析
2.5 血清TIMP-1、TGF-β1对瘢痕子宫再次妊娠产妇产后出血的预测价值
ROC曲线分析结果显示,血清TIMP-1、TGF-β1单独预测的AUC分别为0.881、0.901,而二者联合预测的AUC为0.959,优于血清TIMP-1、TGF-β1单独预测(Z=2.139、2.227,P=0.036、0.024),见表4、图2。
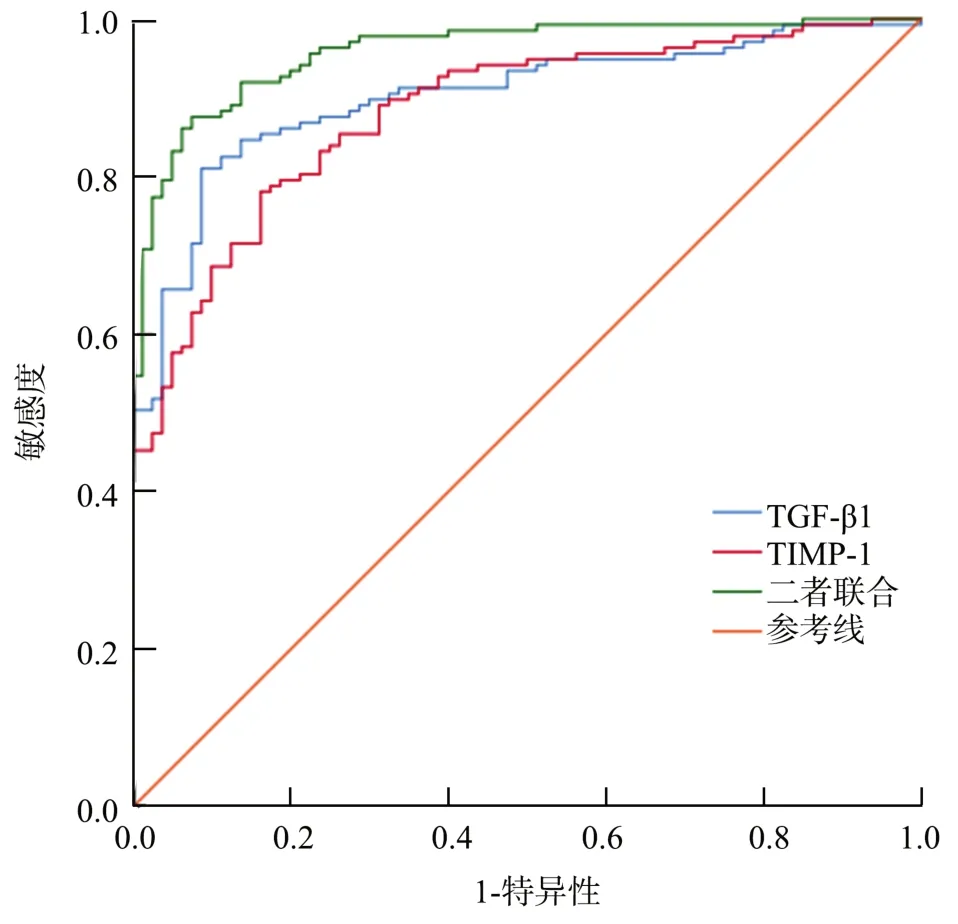
图2 血清TIMP-1、TGF-β1预测瘢痕子宫再次妊娠产妇产后出血的ROC曲线
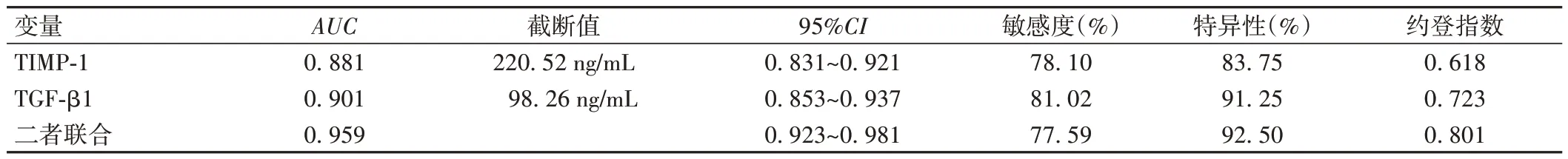
表4 血清TIMP-1、TGF-β1水平对瘢痕子宫再次妊娠产妇产后出血的预测价值
3 讨论
临床上常把剖宫产术、子宫肌瘤剔除术造成的子宫穿孔或子宫肌层损伤称为瘢痕子宫[10]。近年来,瘢痕子宫再次妊娠的产妇越来越多,但由于这类产妇瘢痕处子宫壁薄弱,导致子宫收缩乏力,再次妊娠时发生产后出血的概率及病死率均较高,严重威胁母婴生命安全[11-13]。因此,寻找瘢痕子宫再次妊娠产妇发生产后出血的相关特异性指标,提早干预,对提高患者生存率具有重要意义。
有研究表明,转化生长因子β家族在细胞外基质的形成过程中起到重要作用,能影响子宫瘢痕的形成、增生等[14]。TGF-β1作为转化生长因子β家族的一员,也能在新生血管形成、细胞分化、凋亡等过程中发挥作用[15-16]。龚浩等[8]对不同神经功能损伤程度的急性脑出血患者血清TGF-β1水平的测定结果显示,重度组患者血清TGF-β1水平低于轻度组。刘绪荣[17]的研究发现,TGF-β1表达也与妊娠不良结局的发生有关。本研究结果显示,观察组血清TGF-β1水平显著低于对照组,表明血清TGF-β1水平也与瘢痕子宫再次妊娠产妇产后出血的发生有关,可能为预测瘢痕子宫再次妊娠产妇发生产后出血的特异性指标。
有研究表明,MMPs参与并促进了子宫内膜间质成分的降解,能够诱导子宫内膜血管发生损伤,导致内膜出血[18-19]。而TIMP-1作为MMP-9的特异性抑制剂,在稳定MMP-9活性的同时,还可避免MMP-9的过度激活[9]。田烜等[20]的研究结果显示,高血压性脑出血患者血清中TIMP-1水平明显高于健康者,并且TIMP-1水平随着患者病情加重而逐渐升高。本研究中观察组血清TIMP-1水平高于对照组,与上述研究结果一致。分析其原因为TIMP-1作为MMPs家族的调控因子,在MMP相关因子表达升高时,会促进TIMP-1反馈性升高[21]。进一步采用Logistic多因素回归分析影响瘢痕子宫再次妊娠产妇发生产后出血的相关因素,结果显示,分娩孕周、子宫瘢痕厚度、刮宫次数、TGF-β1及TIMP-1均为瘢痕子宫再次妊娠产妇发生产后出血的影响因素。这主要是由于分娩孕周会影响瘢痕处的肌层收缩能力,导致产后出血的发生;而子宫瘢痕厚度过薄时,容易在分娩时发生子宫破裂;刮宫同样也会影响子宫厚度,还会造成腹膜、子宫等粘连,以上均会导致产后出血的发生。采用ROC曲线分析血清TIMP-1、TGF-β1水平对瘢痕子宫再次妊娠产妇发生产后出血的预测效能,结果显示,二者联合检测的预测效能较高,能够作为临床辅助预测此类患者妊娠结局的特异性指标。
综上所述,瘢痕子宫再次妊娠产妇血清TIMP-1、TGF-β1水平与产后出血的发生密切相关,二者联合检测对瘢痕子宫再次妊娠产妇是否发生产后出血具有较好的预测价值。但TIMP-1、TGF-β1对瘢痕子宫再次妊娠产妇发生产后出血的影响机制还需深入探究。

