TSP-1对小鼠皮肤放创复合伤伤口愈合的影响
南莎,柳随义,冉永红,赵雅贞,郝玉徽
(陆军军医大学军事预防医学系复合伤研究所,重庆 400038)
放创复合伤(combined radiation-wound injury,CRWI)是核事故以及核战争时所发生的主要伤类之一,与单纯放射损伤相比,其发生率和病死率大大增加[1]。伤口愈合是一个复杂、相互协调的过程,可分为3个相互区分而又联系的阶段:炎症反应期、增殖修复期以及组织重塑期[2-4]。受电离辐射的影响,CRWI伤口部位的炎症细胞和修复细胞数量减少、功能受损,伤口难以愈合,且机制复杂,需要我们不断探索。
TSP-1是一种多功能胞外基质蛋白,参与炎症调控、血管生成等病理生理过程,在伤口修复过程中发挥重要作用[5]。相关研究表明,与野生型(WT)小鼠相比,缺乏TSP-1会导致小鼠皮肤热损伤伤口的愈合速度减缓[6]。也有研究发现,用TSP-1预处理人角膜内皮细胞后,其分泌的外泌体可以有效促进角膜伤口愈合[7],即TSP-1能够促进伤口愈合。然而,一项应用二甲双胍治疗二型糖尿病伤口的研究发现,二甲双胍可以通过降低伤口部位TSP-1的表达水平,加速二型糖尿病伤口愈合[8],说明TSP-1对伤口愈合也有不利影响。以上研究结果表明TSP-1在不同的伤口模型中发挥的作用不同。
目前,TSP-1在CRWI愈合中的作用尚不明确。因此,本研究以TSP-1基因全敲除小鼠为主要研究对象,探讨TSP-1在CRWI伤口愈合过程中的作用,以期为CRWI的救治提供实验依据。
1 材料与方法
1.1 材料
RIPA裂解液、BCA蛋白浓度测定试剂盒、DAB显色液、DAPI、抗荧光淬灭封片剂、山羊抗兔IgG、小鼠基因型快速鉴定试剂盒均购自上海碧云天生物技术有限公司;RNAiso试剂、PrimeScript RT reagent Kit with gDNA Eraser、SYBRII荧光定量PCR试剂均购自大连宝生物工程有限公司;柠檬酸修复液、封闭用山羊血清、SV超敏反应两步试剂盒均购自北京中杉金桥生物技术有限公司;兔抗多克隆F4/80、CD31、β-actin均购自武汉三鹰生物技术有限公司;NF-κB抗体购自美国Biolegend公司;α-SMA抗体购自美国Cell Signaling Technology公司;RT-qPCR引物由上海生工生物工程有限公司合成;荧光酶标仪Bio-Ple 200 System、Realtime PCR仪、Chemidoc×RS成像系统均购自美国Bio-Rad公司。
1.2 实验动物
本研究共使用C57BL/6J雄性小鼠(6周龄)30只,TSP-1KO组及WT组各15只。TSP-1KO小鼠来源于美国赛业生物科技有限公司,WT小鼠来源于陆军军医大学实验动物中心,动物使用许可证号:SYXK(渝)20170002。所有小鼠饲养在12 h明暗循环的实验环境中,湿度维持在50%~60%,温度保持在(24±0.5)℃。
1.3 建立小鼠皮肤CRWI模型
建立小鼠皮肤CRWI模型[9-10]。首先对小鼠进行5 Gy60Coγ全身辐照,剂量率为0.5~0.6 Gy/min。辐照后1 h内,在小鼠背部皮肤制造伤口:用1%戊巴比妥钠(0.15 mL)腹腔注射麻醉、备皮、局部消毒后,在每只小鼠背部胸段脊柱附近用打孔器切出圆形伤口,伤口直径1 cm,深达皮下组织全层。手术后将小鼠放回笼子恢复,在伤口形成后的第0、1、3、7、10、14天观察2组小鼠伤口愈合情况并拍照记录。使用Image J对伤口面积进行定量分析,伤口闭合率=(A0-At)/A0×100%,A0表示第0天伤口部位的面积,At代表伤口形成后不同时间点伤口部位的面积。在伤口形成后第7天取小鼠伤口部位的皮肤组织,其中一半用4%中性甲醛固定,用于后续伤口组织HE染色、免疫组化染色及免疫荧光染色;另一半用液氮冻存,用于进一步的Western blot蛋白检测及组织RNA表达检测。
1.4 HE染色
取新鲜的伤口组织制作3.5 μm的石蜡组织切片,对石蜡切片进行苏木精-伊红(HE)染色,用于观察伤口的形态。
使用SV超敏反应两步试剂盒进行免疫组化染色:将石蜡切片脱蜡后,用柠檬酸钠进行抗原修复,然后使用过氧化氢浸泡20 min。使用山羊血清封闭1 h后,用一抗F4/80(1:200)、CD31(1:200)于4 ℃孵育过夜。二抗孵育20 min,使用DAB对组织中目标蛋白进行显色,然后进行复染。目标蛋白的表达使用Image J进行定量分析。
1.5 免疫荧光染色
将石蜡切片脱蜡后,用柠檬酸钠进行抗原修复。然后使用山羊血清封闭1 h,加入一抗α-SMA(1:100),于4 ℃孵育过夜。荧光二抗避光孵育1 h后,使用DAPI对细胞核进行染色。最后使用荧光显微镜进行拍照观察,并用Image J进行定量分析。
1.6 RT-qPCR
使用TRIzol™试剂提取伤口组织中总RNA,对各样本RNA浓度进行测定并配平,使用PrimeScript™ RT预混液将RNA逆转录成cDNA。最后使用SYBR预混料Ex Taq™进行RT-qPCR。使用的引物序列见表1。

表1 用于RT-qPCR反应的引物序列
1.7 Western blot检测蛋白表达
在冰上使用RIPA裂解液裂解伤口组织获得总蛋白。使用BCA蛋白浓度测定试剂盒测定各样本组织蛋白浓度。调整上样体积使每组上样质量为20 μg,加载到8%SDS-PAGE预制胶上进行电泳,而后使用0.45 μm PVDF膜进行电转。使用5%脱脂奶粉封闭2 h,孵育一抗NF-κB(1:1 000)和β-actin(1:10 000)于4 °C冰箱过夜。室温孵育二抗(1:5 000)1 h。最后进行显影,并使用Image J进行定量分析。
1.8 敲除小鼠基因型鉴定
用消毒的剪刀剪取小鼠鼠尾0.5 cm备用。按照DNA Extraction Solution:Enzyme Mix=96:4的比例配置消化液,将配好的消化液加入离心管,每管100 μL。金属浴55 ℃,15 min;95 ℃,5 min。消化完成后,向上述各样品中加入100 μL的终止液,终止消化。而后进行PCR反应,PCR反应体系见表2。最后进行琼脂糖凝胶电泳(130 V,30 min),结果使用Chemidoc×RS成像系统检测。

表2 用于PCR的反应体系
1.9 统计学分析
采用SPSS 26.0和GraphPad Prism 8进行统计学分析。连续性数据用均数±标准差(x-±s)表示,两个独立样本组之间的比较采用t检验。P<0.05表示差异有统计学意义。
2 结果
2.1 TSP-1基因敲除小鼠鉴定
本课题组成功引进并繁育了TSP-1基因全敲除小鼠。对繁育小鼠的基因型进行鉴定,TSP-1-/-小鼠基因组PCR产物电泳图像只具有660 bp单一条带,TSP-1+/-小鼠的电泳图像具有660 bp和823 bp两条条带,TSP-1+/+小鼠的电泳图像只具有823 bp单一条带,见图1。随后,对敲除小鼠的出生、生长和繁殖情况进行观察记录,发现TSP-1KO小鼠能正常生长、繁育。
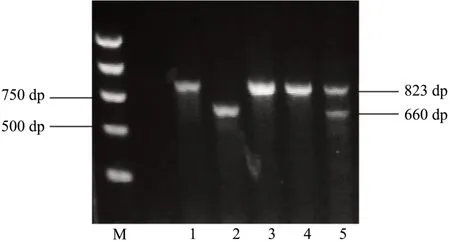
图1 TSP-1KO小鼠基因型鉴定PCR电泳图
2.2 敲除TSP-1小鼠皮肤CRWI的伤口愈合情况
根据伤口愈合的结果,从建模第3天开始TSP-1KO小鼠的皮肤CRWI伤口表现出显著的愈合延迟(P<0.05),见图2a、b。在小鼠皮肤CRWI建模后的第7天,取2组伤口组织进行HE染色,结果表明,与WT小鼠相比,TSP-1KO小鼠具有较短的再上皮化距离(P<0.05);同时,TSP-1KO小鼠皮肤CRWI的伤口宽度和伤口面积均明显较大(P<0.05),见图2c、d。以上结果表明,敲除TSP-1后,小鼠皮肤CRWI再上皮化速率减慢,伤口愈合延迟。

图2 WT及TSP-1KO小鼠皮肤CRWI的伤口愈合情况
2.3 敲除TSP-1小鼠皮肤CRWI伤口部位的炎症反应情况
小鼠皮肤CRWI建模后的第7天,与WT小鼠相比,TSP-1KO小鼠伤口部位的F4/80阳性巨噬细胞明显减少(P<0.05),NF-кB蛋白表达水平显著降低(P<0.05),见图3a~d。RT-qPCR的结果表明,TSP-1KO小鼠的伤口部位IL-1β、IL-6 mRNA表达水平显著降低(P<0.01),敲除TSP-1对小鼠皮肤CRWI伤口部位TNF-α mRNA表达水平影响不明显(P>0.05),见图3e。以上结果表明,敲除TSP-1会使小鼠皮肤CRWI炎症降到更低水平。

图3 小鼠皮肤CRWI建模后第7天WT及TSP-1KO小鼠伤口部位的炎症反应情况
2.4 敲除TSP-1小鼠皮肤CRWI伤口部位的血管生成情况
免疫组化染色结果显示,与WT小鼠相比,TSP-1KO小鼠伤口部位CD31阳性细胞(新生成血管)表达显著减少(P<0.05),见图4a、b。同时,与WT小鼠相比,TSP-1KO小鼠伤口部位α-SMA阳性细胞(成熟血管)表达也减少(P<0.05),见图4c、d。即敲除TSP-1会导致小鼠皮肤CRWI血管生成受到抑制。
3 讨论
为了确定TSP-1在小鼠皮肤CRWI伤口愈合中的作用,我们培育了TSP-1基因全敲除小鼠,应用TSP-1KO小鼠进行伤口愈合实验,结果显示,TSP-1KO小鼠皮肤CRWI的伤口部位巨噬细胞浸润较少,NF-κB蛋白表达降低,炎症细胞因子表达减少,并且血管生成也相应减少。
TSP-1在免疫调节方面发挥重要作用,是单核细胞趋化性、巨噬细胞吞噬作用、调节T细胞功能、激活潜伏TGF-β1的重要介质[11]。有研究发现,转染siRNA抑制TSP-1表达可减少THP-1细胞中IL-6、IL-1β和TNF-α的分泌,并且过表达TSP-1可上调THP-1细胞中IL-6、IL-1β和TNF-α的表达水平[12]。本研究中TSP-1KO小鼠皮肤CRWI伤口部位炎症细胞因子表达降低,炎症反应减弱,与以上研究结果相同,即TSP-1在小鼠皮肤CRWI伤口愈合过程中发挥促炎作用。CRWI伤口部位炎症反应较轻[13],将促炎因子TSP-1敲除,致使CRWI炎症反应进一步减轻,更加不利于小鼠皮肤CRWI伤口愈合。
大多数研究认为,TSP-1是抑制血管生成最重要的蛋白之一[14-15],而TSP-1KO小鼠皮肤CRWI伤口部位血管生成却减少,可能是因为炎症反应在伤口愈合过程中发挥主导作用[16],伤口愈合前期的炎症反应不足会影响愈合后期的细胞因子以及其他营养物质的积累,使得TSP-1抑制血管生成的作用未能显现。新生血管可以为伤口部位提供氧、营养和生物活性物质,在伤口愈合过程中发挥不可替代的作用[17]。TSP-1KO小鼠的伤口部位血管生成减少,进一步导致小鼠皮肤CRWI伤口愈合延迟。
综上所述,本研究探讨了TSP-1在小鼠皮肤CRWI愈合中的作用,发现TSP-1是小鼠皮肤CRWI愈合过程中促进炎症反应的关键因子,并且在一定程度上有利于伤口部位的血管生成。上述结果为后续深入研究TSP-1在CRWI以及其他伤口模型中的作用机制奠定了基础。

