功能性纳米自组装多肽KLPP凝胶修复软骨缺损的实验研究
于鹏,贾丙申,段炼,付昆
(海南医学院第一附属医院关节外科,海南 海口 570102)
关节软骨缺损是一种常见的关节疾病,其特点是软骨组织部分或完全损坏,严重影响患者的生活质量,难以自愈[1-2]。虽然目前已经有一些治疗软骨缺损的方法,如自体软骨移植和骨髓刺激剂等,但往往都存在诸如供体不足、手术创伤大以及软骨结构和功能难以恢复正常等一系列问题。由于关节软骨缺损的发病原因仍然不明确,药物治疗效果并不明显,而人工关节置换治疗的费用也相当高昂,因此研发具有修复关节软骨作用的诱导疗法具有重要意义[3]。
功能性纳米自组装多肽KLPP凝胶因其具有可定制性和广泛适用性,已成为医学和生物技术领域的一个研究热点[4]。KLPP凝胶是通过包含部分功能化的侧链和肽基之间的共价和氢键相互作用的组合而形成的,其具有在分子水平上进行定制的能力,在药物输送、组织工程和再生医学方面发挥重要作用[5]。近年来,可控聚合过程允许增加对多肽水凝胶的流变性和生物学特性的控制,以满足各种生物医学应用中的特定要求[6]。此外,功能化肽序列在成胶过程中可以通过共价键与其他分子(如蛋白质、非编码RNA、DNA)发生相互作用,从而产生具有理想特性的多功能水凝胶,如可以缓释抗菌药物和生物活性分子的功能性水凝胶[7]。然而,目前还不清楚KLPP凝胶对软骨损伤修复的作用。本研究旨在探讨KLPP凝胶对软骨缺损的修复作用。
1 材料与方法
1.1 软骨组织
选取于我院关节外科进行全膝关节置换术的老年双膝关节骨关节炎患者10例,年龄58~81岁,平均(67.2±5.9)岁;病程3~18年,平均(12.1±1.8)年。患者均为双膝关节骨关节炎,出现不同程度畸形、痉挛、功能障碍或最大屈曲受限,经X射线检查发现不同程度功能性退化,间隙异常变小,可见明显异常病理性改变,结合临床症状诊断为晚期膝关节骨性关节炎,均采取全膝关节置换术治疗。收集全膝关节置换术中截除丢弃的组织并获取软骨组织。本研究经患者知情同意,并获得我院医学伦理委员会批准[2022(科研L)第(51)号]。
在无菌环境下,随机选取3例软骨组织,用5 mm的环形组织铲取出直径5 mm的圆形软骨片,使用2 mm的环形组织铲在各软骨片中央制作一个直径2 mm的软骨缺损区域。使用KLPP凝胶填充软骨缺损区域,在37 ℃下于培养箱内孵育培养,每2 d更换一次培养液,设为软骨-KLPP组。随机选取3例软骨组织用KLD-12凝胶填充,设为软骨-KLD-12组,其余操作与软骨-KLPP组一致。在无菌环境下,随机选取3例软骨组织制作一个直径2 mm的软骨缺损区域,在37 ℃下于培养箱内孵育培养,每2 d更换一次培养液,设为软骨组。处理49 d,收集各组软骨组织用于后续实验检测。
1.2 试剂与材料
人骨髓间充质干细胞(bone marrow mesenchyml stem cells,BMSCs)购于上海弗元生物科技有限公司。KLD-12与KLPP凝胶均由实验室自主合成。溴化乙锭染色试剂和软骨分化诱导剂Kartogenin(KGN)购于北京百奥莱博公司。二喹啉甲酸(bicinchoninic acid,BCA)试剂盒、MTT试剂盒、阿尔新蓝染色试剂盒、茜素红染色试剂盒均购于上海碧云天生物科技有限公司。钙黄绿素-乙酰羟甲基酯染色试剂盒购于西安齐岳生物科技有限公司。Ⅰ型胶原(collagen-Ⅰ,Col-Ⅰ)、Ⅱ型胶原(collagen-Ⅱ,Col-Ⅱ)、X型胶原(collagen-Ⅹ,Col-Ⅹ)、GAPDH的一抗均购于美国Abcam公司。
1.3 BMSCs培养
BMSCs置于DMEM/F12(1∶1,美国Hyclone公司)培养液中,培养液中添加10% FBS(美国Hyclone公司)、100 U/mL青霉素、100 U/mL链霉素,在37 °C、含5% CO2的培养箱中培养,每隔24 h换液一次,48 h传代一次,将对数生长期的BMSCs用于后续实验。
1.4 细胞分组处理
将BMSCs分为BMSCs-KLD-12组和BMSCs-KLPP组。其中将BMSCs-KLD-12组BMSCs接种到KLD-12凝胶中培养24 h,收集细胞;将BMSCs-KLPP组BMSCs接种到KLPP凝胶中培养24 h,收集细胞。用于软骨分化诱导。
1.5 软骨分化诱导
将BMSCs-KLD-12组和BMSCs-KLPP组细胞原培养液更换为含50 nmol/L KGN的DMEM/F12培养基(含10% FBS、100 U/mL青霉素、100 U/mL链霉素),于37 ℃、含5% CO2的培养箱中进行软骨分化诱导,分别培养1 d、3 d、7 d进行细胞增殖和软骨分化能力的检测。
1.6 MTT实验
BMSCs-KLD-12组和BMSCs-KLPP组诱导软骨分化后1 d、3 d、7 d分别加入MTT溶液,孵育4~6 h后,将培养皿中的MTT晶体溶解于弱酸性尿素溶液中,然后通过酶标仪检测各组的OD值。
1.7 Calcein-AM/PI双染法检测细胞毒性
收集BMSCs-KLD-12组和BMSCs-KLPP组的软骨细胞,多聚甲醛固定15 min,PBS清洗3次,每次5 min。加入抗酶液2 mL孵育30 min,抑制非特异性酶;并将Calcein-AM添加到标本中染色15 min:用PBS洗涤标本3次,每次5 min,PI染色5 min,去除多余的染色液;将染色后的标本放在荧光显微镜下拍照观察。
1.8 阿尔新蓝染色
软骨-KLPP组、软骨-KLD-12组和软骨组的软骨标本培养49 d后,用PBS洗涤3次,每次5 min。用0.1 mol/L的盐酸溶液处理软骨切片10 min,在1%阿尔新蓝染色溶液中孵育10 h。随后拍照观察。
1.9 Western blot检测软骨分化标志物
检测BMSCs-KLD-12组、BMSCs-KLPP组、软骨组、软骨-KLPP组、软骨-KLD-12组中软骨分化相关蛋白,包括Col-Ⅰ、Col-Ⅱ、Col-Ⅹ。用RIPA缓冲液裂解细胞或组织提取总蛋白。蛋白浓度用BCA试剂盒测定。此外,使用12% SDS-PAGE凝胶分离蛋白,并将其转移到PVDF膜上。将膜用5%脱脂牛奶封闭2 h,然后在4 ℃下与一抗孵育10 h。免疫复合物用辣根过氧化物酶偶联的抗兔IgG抗体(1∶5 000)孵育。最后使用Western blot化学发光检测蛋白信号表达。所有实验均重复3次。抗体为Col-Ⅰ(1∶1 000)、Col-Ⅱ(1∶1 000)、Col-Ⅹ(1∶1 000)。
1.10 统计学分析
数据使用GraphPad PRISM 5.01进行统计学分析,正态分布的数据以均数±标准差(x-±s)表示。两组间的数据差异采用t检验。单因素方差分析评估均数之间的差异,并进行LSD-t的多重比较,以评估两组之间的统计差异。检验水准为α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 KLPP凝胶
通过质谱和高效液相色谱验证,本研究制备的KLPP凝胶被证明合成成功。KLPP凝胶的相对分子质量为1 498.26,纯度商为94.12%。KLPP凝胶形成了纳米纤维,纤维直径平均为(13.5±5.3)nm,长度可达650 nm。这些纳米纤维交织在一起,形成了网状的多孔结构。另外,0.5%的KLPP凝胶能够快速自组装生成水凝胶,结构完整均匀,有足够的内聚力保持固定形状,见图1。

图1 自组装KLPP凝胶
2.2 KLPP凝胶对BMSCs增殖的影响
与BMSCs-KLD-12组比较,BMSCs-KLPP组培养1 d、3 d和7 d的细胞增殖活性(490 nm处OD值)均增加(P<0.05),且均随着时间的延长而明显增加(P<0.05),见图2。
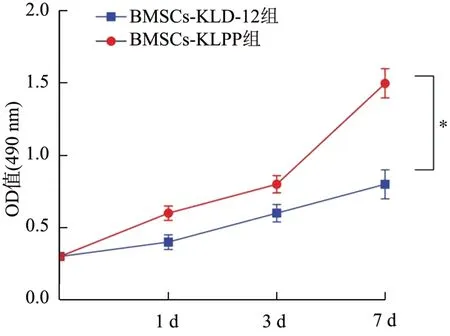
图2 MTT实验检测KLPP凝胶对BMSCs增殖的影响
2.3 KLPP凝胶促进BMSCs的软骨分化
与BMSCs-KLD-12组比较,BMSCs-KLPP组Col-Ⅰ、Col-Ⅱ、Col-Ⅹ的相对表达水平明显增加(P<0.05),见图3。
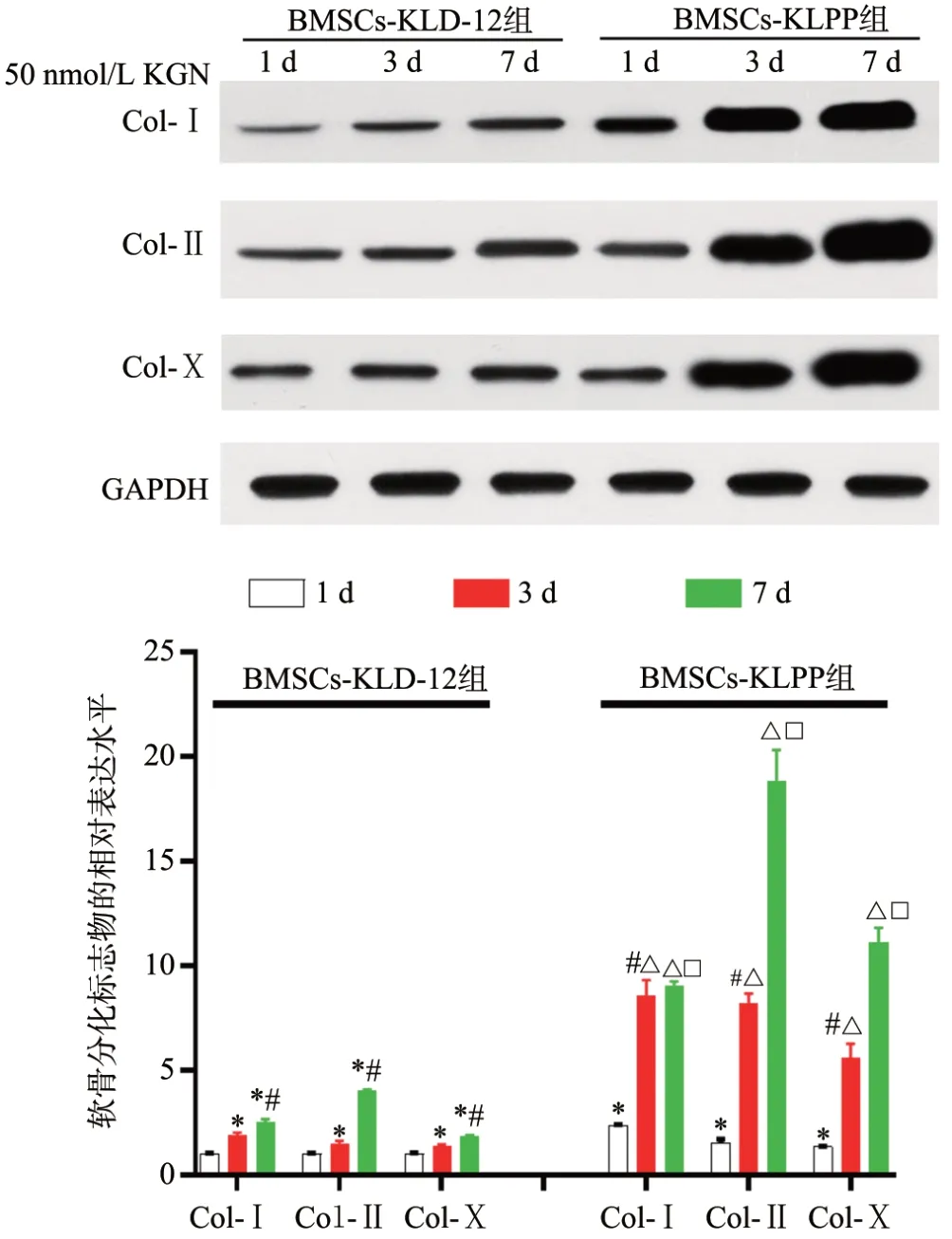
图3 KLPP凝胶对BMSCs软骨分化标志物表达水平的影响
2.4 KLPP凝胶维持软骨细胞的存活
Calcein-AM/PI双染色检测表明,BMSCs-KLPP组和BMSCs-KLD-12组细胞活性基本一致。软骨诱导7 d时,KLPP凝胶和KLD-12凝胶中都发现大量活的软骨细胞,极少死亡细胞。KLPP凝胶中的细胞保持圆形,KLPP凝胶孔底部细胞呈纺锤状或梭形,见图4。表明KLPP凝胶可以良好地支持保护软骨细胞的生长。
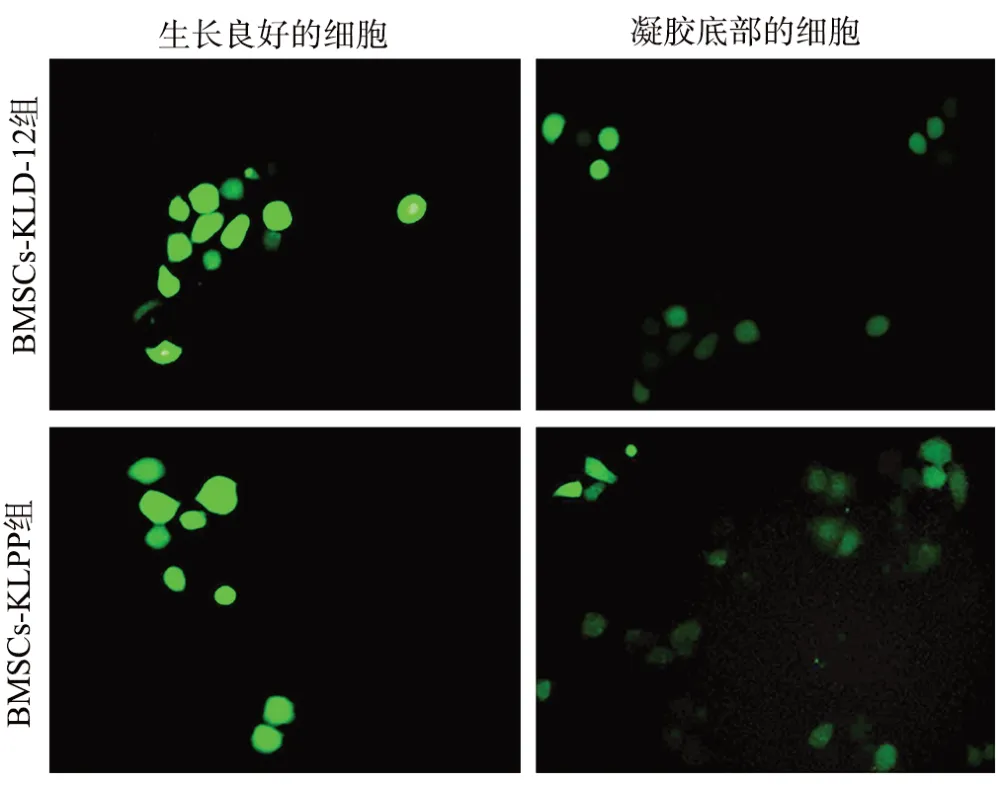
图4 软骨诱导7 d时Calcein-AM/PI双染色(×200)
2.5 KLPP凝胶促进软骨缺损的修复
阿尔新蓝染色显示:与软骨组比较,软骨-KLD-12组和软骨-KLPP组软骨增生活跃,染色阳性比例明显升高,2组软骨缺损修复作用均较明显,且软骨-KLPP组较软骨-KLD-12组更加明显(P<0.05)。与软骨组比较,软骨-KLD-12组和软骨-KLPP组Col-Ⅰ、Col-Ⅱ、Col-Ⅹ的相对表达水平均明显增加(P<0.05),且软骨-KLPP组较软骨-KLD-12组增加更显著(P<0.05),见图5、6。
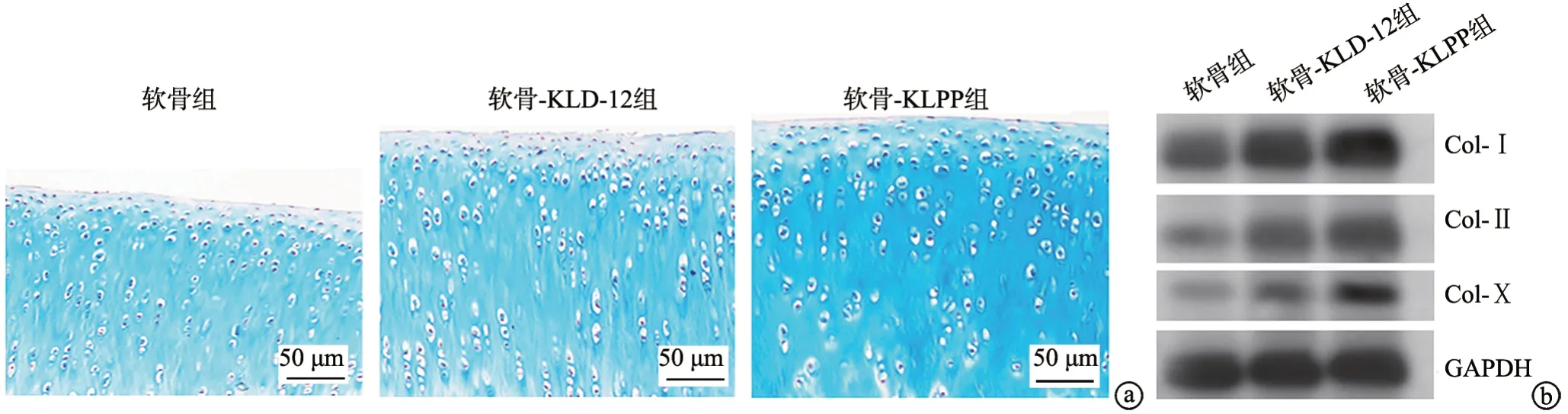
图5 软骨缺损组织中软骨和软骨标志物的表达
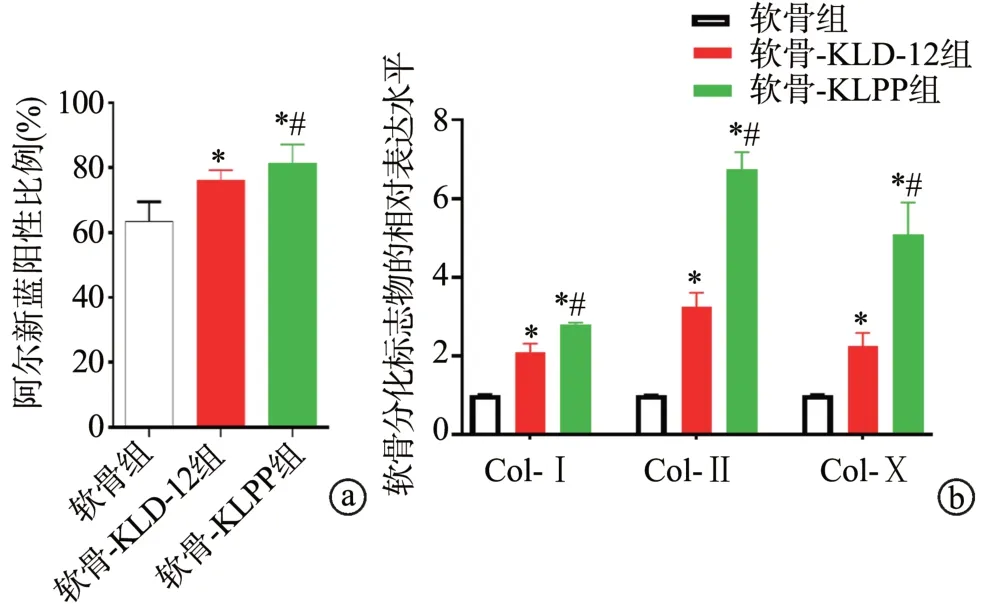
图6 KLPP凝胶对软骨缺损组织中软骨和软骨标志物表达水平的影响
3 讨论
关节软骨损坏后的自我修复能力非常有限,若不及时治疗,即使是较小的损伤也会随着时间的推移发展成更严重的病变,最终导致整个关节的退变和骨关节炎[8]。目前,软骨缺损提倡阶梯治疗,即根据疾病的不同发展阶段选择不同的治疗方式,包括降低体质量、补充营养、锻炼、使用药物和外科手术治疗等[2]。由于目前保守治疗的效果有限,关节内注射药物的疗效不确切[9-10],人工关节置换术仍是治疗严重关节软骨缺损的金标准。但人工关节假体价格高昂,增加了医疗负担,因此,研究新的软骨修复手段十分必要。KLPP凝胶与传统KLD-12凝胶具有相似的纳米结构和流变性能。本研究通过自主合成KLPP凝胶,并观察KLPP凝胶对软骨缺损的修复作用,以期为关节软骨缺损提供新的治疗策略。
内源性干细胞的原位软骨再生技术在软骨缺损的治疗中受到了广泛关注,该技术利用人体自身的再生能力来修复软骨组织,避免了外源性细胞带来的不利影响[11]。微骨折是关节软骨修复的常用策略,利用BMSCs分化的原理来使软骨组织再生。然而,新组织大多是相对较弱的纤维软骨,而不是透明软骨。原因可能是招募的干细胞数量不足[12]。因此,能够改善和增强内源性干细胞聚集的化学诱导剂或生物诱导支架成为了研究焦点[13]。
KLD-12凝胶是目前研究中比较成熟的自组装纳米多肽材料,近几年已被国外用于内源性软骨细胞的募集[14]。然而常规的KLD-12凝胶不能满足软骨缺损修复对BMSCs聚集的高需求[15]。本研究通过使用两个甘氨酸(G)残基作为间隔链,将具有软骨诱导作用的功能基序DHLSDHLSDNYTLDIDRAIH添加到KLD-12的C-末端,从而制造了氨基酸序列为KLDLKLDLKLDLGGDHLS DHLSDNYTLDEDRAIH的功能性纳米自组装多肽KLPP凝胶。这种材料既保留了纳米自组装多肽KLD-12可以自组装成胶的特性,又具备了可以诱导软骨细胞增殖的功能,其可以通过微创的方式注入关节内,并在关节内提供润滑及塑型填补软骨缺损面的作用,在软骨缺损治疗中可能具有较大优势。
为了明确KLPP凝胶在软骨缺损修复方面的作用,本研究对比观察了KLPP凝胶与KLD-12凝胶对BMSCs软骨分化诱导后细胞增殖活力的影响以及对软骨缺损修复的作用,结果显示,KLPP凝胶可显著提高软骨分化后BMSCs的增殖活力,并促进BMSCs中软骨细胞再生标志物Col-Ⅰ、Col-Ⅱ、Col-Ⅹ的蛋白表达,而且KLPP凝胶对软骨细胞再生标志物的促进作用明显大于KLD-12凝胶。Lu等[16]报道了软骨细胞在诱导下可以向周围组织材料内迁移,从而有利于组织工程软骨的整合。Levinson等[17]将软骨颗粒嵌入纤维蛋白和胶原蛋白凝胶中,并在培养28 d后观察到明显的软骨细胞生长。Ng等[9]报道,在体外软骨缺损模型中,大孔聚乙烯醇(PVA)支架促进了软骨细胞从宿主软骨迁移到支架,并改善了界面整合。这些研究都证明了软骨细胞可以迁移进入组织工程材料并在材料的支持下更好地促进软骨缺损区域的修复。本研究中KLPP凝胶也同样提供了促进软骨生长的功能序列和支架结构,结果显示,在KLPP凝胶内软骨细胞生长明显优于对照组。因此,我们认为KLPP凝胶具有较好的促进软骨分化和软骨细胞生长的作用。另外,本研究证实了KLPP凝胶与KLD-12凝胶具有相似的细胞毒性,均可以良好地支持保护软骨细胞的生长。为进一步验证KLPP凝胶的软骨缺损修复作用,本研究利用临床软骨组织标本,建立软骨缺损软骨片,经过长期的KLPP凝胶治疗发现,KLPP凝胶具有较好的软骨修复、界面整合和软骨再生作用,且效果强于KLD-12凝胶。我们推测这与KLPP凝胶具备了较好的软骨细胞增殖诱导功能以及较好的软骨细胞和BMSCs的募集功能密切相关。进一步检测软骨细胞标志物Col-Ⅰ、Col-Ⅱ、Col-Ⅹ的蛋白表达发现,在软骨缺损治疗中KLPP凝胶对软骨细胞标志物Col-Ⅰ、Col-Ⅱ、Col-Ⅹ表达的促进作用大于KLD-12凝胶;而未经治疗的软骨缺损并未愈合,且其中主要以纤维组织或纤维软骨为主。因此,KLPP凝胶是一种极具潜力的软骨缺损修复候选者。
综上所述,功能性纳米自组装多肽KLPP凝胶可促进BMSCs细胞软骨分化后的细胞活力,修复受损的透明软骨并促进其再生,改善软骨缺损区域的界面整合。因此,KLPP凝胶将是一种很有前途的软骨再生的候选者,不需要任何外来细胞或化学引诱剂。

