毛乌素沙地樟子松林植物-土壤生态化学计量特征演变关系
拓卫卫, 范家伟, 周雅洁, 杨 京, 张延文, 佟小刚,, 吴发启, 姚 冲
(1.西北农林科技大学 水土保持研究所, 陕西 杨凌 712100; 2.农业农村部西北旱地农业绿色低碳重点实验室, 陕西 杨凌 712100)
樟子松(Pinussylvestrisvar.mongolicaLitv)以其显著的耐旱、耐寒、耐贫瘠的特性,成为我国西部沙漠化防治的“功勋”树种之一[1],在沙区种植面积已接近80万hm2,近70年来发挥出了巨大的防风固沙、恢复植被、释氧固碳等生态服务功能[2]。但20世纪90年代以来,部分地区出现了林分“早衰”或死亡的现象,这与气候变化关联的干旱、高温下林地植被-土壤自我维持能力减弱以及水资源消耗直接相关。因此,樟子松林应对气候变化可持续恢复能力成为人们关注点[3],特别是掌握植物-土壤间养分转化与积累对于调控和提升樟子松林恢复能力具有重要的科学意义。
人工林恢复过程中植物通过吸收土壤养分,调节植物体内碳(C)、氮(N)、磷(P)等营养元素的分配与动态平衡,同时随着林龄增加,植物通过枯落物分解、根系分泌等途径对土壤养分产生影响[4]。可见,C,N,P养分平衡是土壤与植物联系和互馈的核心过程之一。生态化学计量学综合了生态学、化学计量学及生物学的基本原理,是研究生物系统养分平衡和C,N,P等化学元素平衡的学科[5],为探索植被恢复后植被和土壤C,N和P的互馈动态提供了一条科学途径。
目前,关于不同森林类型和不同演替阶段植物生态化学计量特征进行了大量研究[6-7]。如俞月凤等[8]报道了西南喀斯特地区人工林土壤C∶P,N∶P以及植物C∶P在不同林间差异显著。杨佳佳等[9]对黄土高原刺槐林不同坡向植物与土壤间的化学计量特征研究表明:C,N,P化学计量比在植物土壤之间存在显著相关性。杨霞等[10]研究说明了辽宁油松林土壤有机碳和全氮质量分数随林龄增加而增加。新近研究还发现植物还会通过控制生态化学计量比以适应生长速率的改变[11]。但森林生态系统养分循环受多种因素影响[12],随着林龄的增加森林生态系统的组成结构和土壤性质也会发生改变,可见,将林地叶片、枯落物、根和土壤四者联系,系统探讨不同恢复年限“植被-土壤”间的生态化学计量特征演变关系,才能进一步揭示植被恢复过程植物-土壤间养分循环与互作效应。因此,本研究选择榆林毛乌素沙地的樟子松固沙林为研究对象,对樟子松林叶、枯落物、细根及土壤的C,N,P含量进行测定和分析,探讨随着植被恢复年限的增加,植物和土壤C,N,P化学计量特征的演变关系,以期为深入认知樟子松固沙林植被—土壤协同恢复机制和管理实践提供科学依据。
1 材料与方法
1.1 研究区概况
研究区位于陕西省榆林市红石峡林区(38°12′47″—38°21′04″N,109°37′55″—109°43′19″E),地处毛乌素沙地东南缘,是典型的生态脆弱区。该地区海拔1 050~1 500 m,属暖温带半干旱气候,年均温8.5℃,年均降雨量415 mm。土壤主要为风沙土,砂粒含量高达92.6 %,且养分贫瘠,抗侵蚀性能差。该地区属于典型农牧交错带,历史上过度的开垦与放牧造成了严重的沙漠化,形成了植被覆盖率低于1.8%的密集、连续、网状流动沙丘带。为逆转沙漠化危害,20世纪60年代起该区域逐步开展了植被重建与生态恢复措施。从设置草方格沙障、飞播造林到人工栽植防风固沙林,植被逐渐恢复,流动沙丘转变为半固定沙地、固定沙地,形成了樟子松为主的人工林植被生态系统,林下草本亦进入自然演替状态。近年来,研究区已建成人工防风固沙林33.3 km2,植被覆盖率达到80%[13],为本研究提供了良好的植被恢复序列样地。
1.2 样地选择与采样
2020年8月,通过陕西省治沙研究所调查获得研究区不同年份种植的防风固沙林地。基于时空互代法选择半固定沙地作为0 a对照,同时选择1995年、1985年、1978年、1964年种植樟子松的4个林地,分别代表恢复了25 a,35 a,42 a及56 a的林地,选取的样地具有基本一致的立地条件,坡向均为阳坡。每种林地选择3个立地条件基本一致且间距大于50 m的重复样地,记录样点海拔、经纬度,各样地基本特征见表1。每个样地内设置20 m×20 m的采样区,测定樟子松高度、胸径(1.3 m高处为准)、郁闭度及株行距;在标准样区设3个1 m×1 m的小样方,调查记录林下物种总数(S)、单个物种个体数(N);同时采集3株标准木高处枝条上新鲜叶片,收集小样方内枯落物,并在0—20 cm土壤小样方收集细根,最后所有植物样品除去浮土后放入塑封袋带回实验室冷藏。使用钻土芯法、样方收集法和尼龙网袋法分别用来收集林下植被根量、林下地上生物量和枯落物生物量。采用土钻(直径5 cm,长120 cm)在每个标准采样区按“S”型12分布采集0—20 cm土样,混合后作为该样区待测样;并用环刀法测定该层土壤容重。
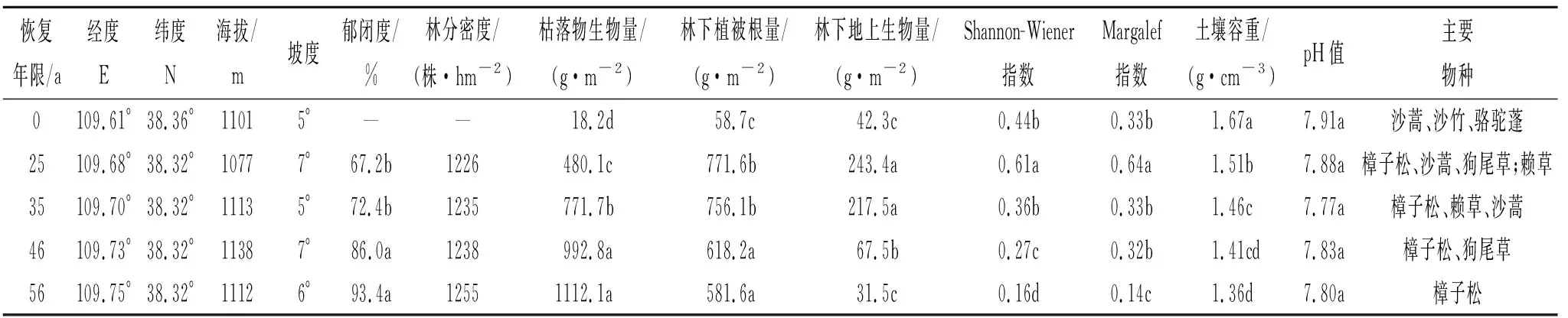
表1 不同恢复年限樟子松林植被特征及0—20 cm土壤基本理化性质Table 1 Vegetation characteristics and basic physicochemical properties of 0-20 cm soil in Pinus sylvestris forest with different restoration years
1.3 指标测定
采集的土壤样品经自然风干后过2 mm筛同时去除土中的植物残体等杂物,密封保存备用。土壤 pH值采用pH计(PHS-3 G pH酸度计,中国)测定,水土比为2.5∶1。采用重铬酸钾氧化法[14]测定土壤有机碳(C)含量。土壤总氮(N)以及总磷(P)分别用凯氏定氮法和HClO4-H2SO4消煮,钼蓝比色法[15]测定。
植物叶片以及根系用蒸馏水清洗过后置于105℃烘箱中杀青15 min,然后与枯落物样品在60℃烘干后,粉碎过0.15 mm筛备用。植物C,N含量用总有机碳分析仪(vario TOC cube)测定,植物P通过H2SO4和H2O2溶液的消化定量法测定[16]。土壤与植物中碳氮磷化学计量以元素质量比计算。
植被物种多样性选用Shannon-Wiener(SW)指数表征,群落丰富度以Margalef指数(M)[17]表征,计算公式如下:
Shannon-Wiener指数:SW=∑PilnPi
(1)
Pi=Ni/N
(2)
Margalef丰富度指数:M=(S-1)/lnN
(3)
式中:N为样方内某一物种个体总数;Ni为第i个物种的个体总数;S为样方内物种数量。
1.4 数据处理和统计分析
数据结果用均值±标准差(SD)来表示。采用方差分析(ANOVA)与LSD多重比较法分析不同植被恢复年限间的土壤理化性质、物种多样性以及碳氮磷生态化学计量特征在p<0.05水平下的差异显著性,使用Amos Graphics 24对土壤C,N和P影响因子进行路径分析,樟子松植物组织和土壤碳氮磷含量及化学计量比之间的拟合分析与作图采用Origin 2021进行。
2 结果与分析
2.1 土壤理化性质与樟子松林群落多样性的变化特征
随着植被恢复年限的增加,土壤理化性质得到显著改善(表1)。相比对照半固定沙地,不同恢复年限樟子松林地土壤容重从恢复25 a到56 a下降了9.6%~18.6%。土壤黏粒含量则随恢复年限增长均呈持续增加趋势,到恢复55 a时比对照提升了1.52倍。相反地,对比恢复25 a林地,到恢复56 a时,樟子松林下物种多样指数Shannon-Wiener和丰富度指数Margalef分别显著下降了73.8%和78.1%,即樟子松恢复后期基本成为纯林,群落多样性显著低于对照地。恢复25~56 a,枯落生物量和林下植被根量比对照分别增加了25.4~60.1倍和8.9~12.1倍,这必然引起樟子松植被-土壤间显著的养分转化和交互作用。
2.2 樟子松林C,N,P含量及其化学计量比的演变特征
随着植被恢复年限的增加,樟子松植物各组织C,N,P含量显著变化 见图1。植被恢复25~56 a与半固定沙地相比樟子松叶片、枯落物和细根C含量分别显著增加7.1%~9.1%,0.8%~15.8%和26.8%~25.7%。植被恢复25~56 a与半固定沙地相比枯落物N含量显著降低14.9%~45.1%,细根N含量显著增加41.8%~80.3%,植被恢复46~56 a与半固定沙地相比叶片N含量显著降低13.0%~13.9%。植被恢复25~56 a与半固定沙地相比樟子松叶片、枯落物和细根P含量分别显著降低53.9%~60.8%,57.8%~72.8%和36.2%~60.6%(p<0.05)。整体来看,樟子松叶片C,N,P含量最高,细根N,P含量高于枯落物,且叶、枯落物和细根的C,N,P含量在植被恢复35 a后没有显著变化(p>0.05)。
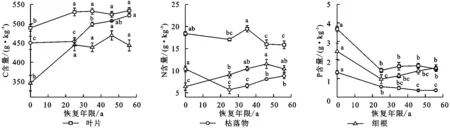
注:不同小写字母表示不同植被恢复年限间差异达到显著性(p<0.05)。下图同。图1 不同恢复年限樟子松林植物组织C,N,P含量Fig. 1 Content of C, N and P in plant tissue of Pinus sylvestris forest under different restoration years
随着植被恢复年限的增加,樟子松植物各组织C,N,P比值变化显著(图2)。植被恢复25~56 a樟子松叶片和枯落物C∶N与半固定沙地相比显著增加2.7%~27.1%和36.5%~86.5%,细根C∶N显著降低9.7%~25.0%。植被恢复25~56 a叶片、枯落物和细根C∶P分别为半固定沙地的2.3~2.6倍、2.4~4.2倍和1.9~3.3倍,但在植被恢复过程中(25~56 a),叶片和细根C∶P却随着恢复年限的增加逐渐降低。植被恢复25~56 a叶片、枯落物和细根N∶P分别为半固定沙地的1.8~2.3倍、1.3~3.0倍和2.5~3.7倍。植被恢复25~56 a时,枯落物和细根C∶N显著降低,叶片则显著增加,叶片与细根C∶P和N∶P显著降低,枯落物显著增加(p<0.05),到恢复56 a时,枯落物C∶N,C∶P,N∶P均高于叶片和细根,细根只有C∶N高于叶片。
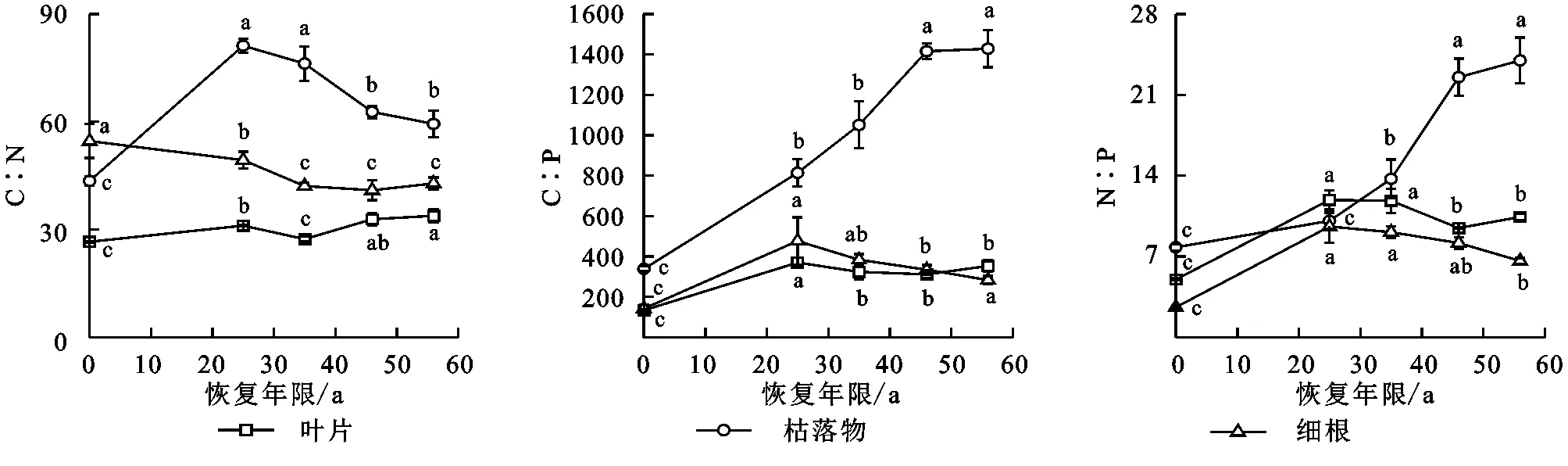
图2 不同恢复年限樟子松林植物组织C∶N,C∶P,N∶PFig. 2 Plant tissue C∶N, C∶P, N∶P of Pinus sylvestris forest under different restoration years
2.3 土壤C,N,P含量及其化学计量比演变特征
樟子松林地土壤C,N,P含量随植被恢复年限增加显著变化(图3)。植被恢复25~56 a土壤C和N分别为半固定沙地的2.8~6.3倍和1.3~2.1倍。土壤P在恢复25 a时与半固定沙地相比无显著变化,在恢复35~56 a时较半固定沙地显著增加了24.7%~75.6%。在植被恢复45~56 a时土壤C,N含量无显著差异。土壤C∶N和C∶P随着植被恢复年限的增加分别为半固定沙地的2.3~3.1倍和3.2~3.8倍,在植被恢复35 a时,土壤N∶P与其他恢复年限有显著差异(p<0.05)。土壤中C∶P>C∶N>N∶P。
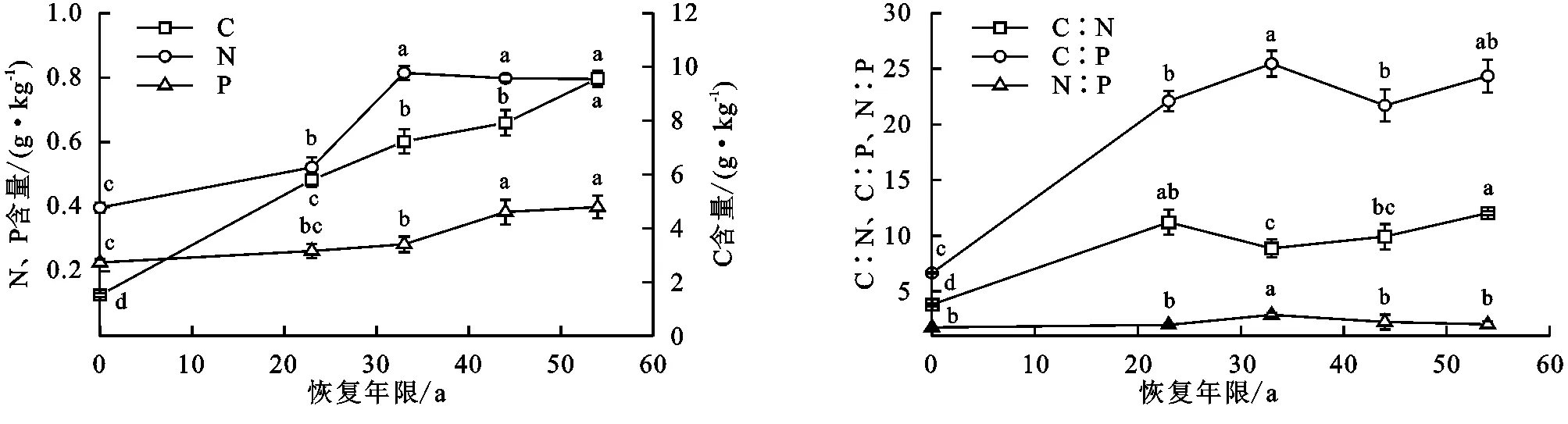
图3 不同恢复年限樟子松林土壤C,N,P含量及化学计量比Fig. 3 Content and stoichiometric ratio of C, N, P in soil of Pinus sylvestris forest under different restoration years
2.4 植物-土壤C,N,P含量及化学计量比间的演变关系
由樟子松植物组织和土壤C,N和P含量间的线性拟合分析看出(图4),叶片C,N,P含量、枯落物P含量、根C含量与土壤C,N,P含量之间不存在线性相关关系,枯落物与土壤C含量存在显著的线性相关关系(R2=0.78,p<0.05);枯落物与土壤N含量存在显著的线性相关关系(R2=0.48,p<0.05),且细根和土壤N含量存在极显著的线性相关关系(R2=0.54,p<0.01);细根与土壤P含量存在显著的线性相关关系(R2=0.67,p<0.05)。则植被恢复后土壤C含量的增加与枯落物C含量的增加密切相关,土壤N,P含量的增加与细根养分的输入密切相关。
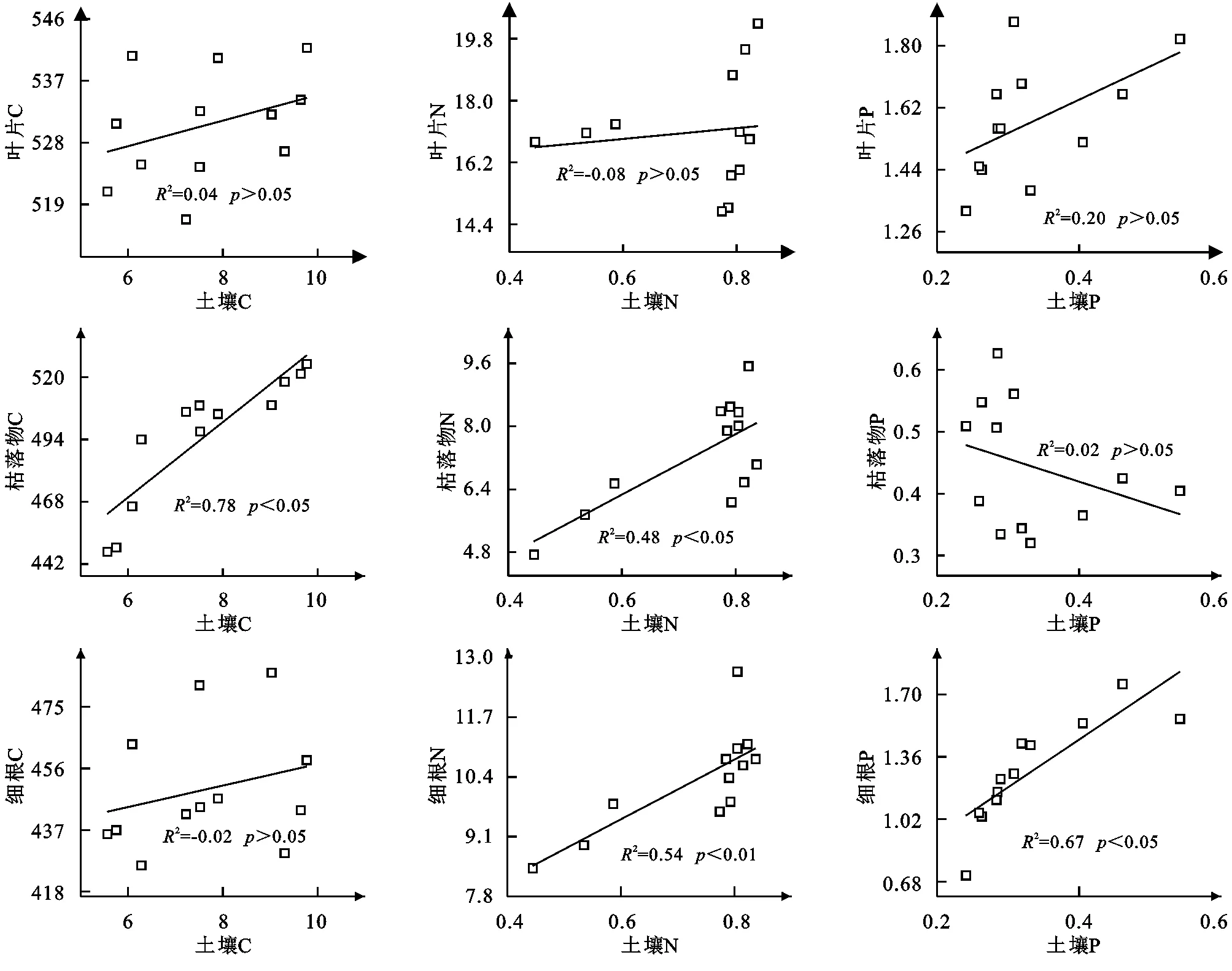
图4 不同恢复年限樟子松林植物-土壤C,N,P含量的回归关系Fig. 4 Regression relationship between plant and soil C, N, P content in Pinus sylvestris forest under different restoration years
由樟子松植物组织、土壤化学计量比之间的拟合关系分析得出,土壤与植物的C∶N,N∶P之间呈现显著的二项式回归关系(p<0.05)。土壤与植物组织C∶P呈现显著正相关线性关系(p<0.05)。叶、枯落物和细根与土壤之间C∶N拟合的R2分别为0.53,0.63,0.55;C∶P拟合的R2分别为0.78,0.79,0.65;N∶P拟合的R2分别为0.32,0.37,0.63(图5)。则樟子松植物组织和土壤之间C∶P关系最为密切。
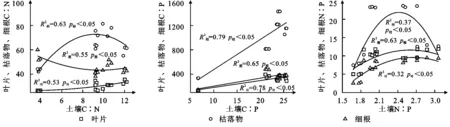
图5 不同恢复年限樟子松林植物-土壤C,N,P化学计量比的回归关系Fig. 5 Regression relationship of the stoichiometric ratios of C, N and P in the plant-soil of Pinus sylvestris forest under different restoration years
2.5 植被恢复后土壤C,N,P含量影响因子的路径分析
为了明确植被恢复后土壤C,N,P含量的影响因素,通过构建结构方程模型分析恢复年限、林下地上生物量、林下植被根量、枯落物生物量以及樟子松各植物组织C,N和P含量对土壤C,N,P含量的综合响应(图6)。结构方程模型拟合结果为:χ2=1.7,df=3,p=0.877,RMSEA=0.000,AIC=27.640,GFI=0.984。模型解释了土壤C,N,P含量90%的变异,模型对枯落物C,N,P含量、叶片C,N,P含量和细根C,N,P含量分别解释了78%,86%和85%的变异(图6)。结构方程模型的路径系数能反映自变量对因变量影响效应的大小及其相对重要性,即枯落物C,N,P含量、细根C,N,P含量、枯落物生物量和林下植被根量是影响土壤C,N,P含量的主要因子,路径系数分别为0.87,0.90,0.51,0.67,且总效应分别为15.34%,18.57%,15.35%和18.22%(图6)。恢复年限、林下地上生物量和叶片C,N,P含量主要间接影响土壤C,N,P含量,间接效应系数分别为0.796,-0.071,0.228。林下植被根量、枯落物生物量和细根C,N,P含量除了对土壤C,N,P含量有直接影响外,也会通过间接效应影响土壤C,N,P含量,林下植被根量、枯落物生物量和细根C,N,P含量对土壤C,N,P含量的间接效应系数分别为0.867,0.616,0.626(表2)。
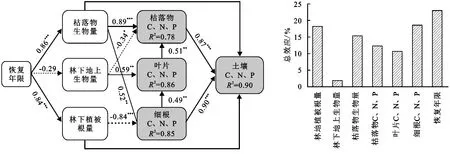
注:每个箭头的粗细和箭头上的数值分别代表路径系数及其大小,实线代表正相关,虚线代表负相关;***表示p<0.001,**表示p<0.01,*表示p<0.05。图6 植被恢复后土壤C,N,P含量影响因子的路径分析Fig. 6 Path analysis of influencing factors of soil C, N and P content after vegetation restoration
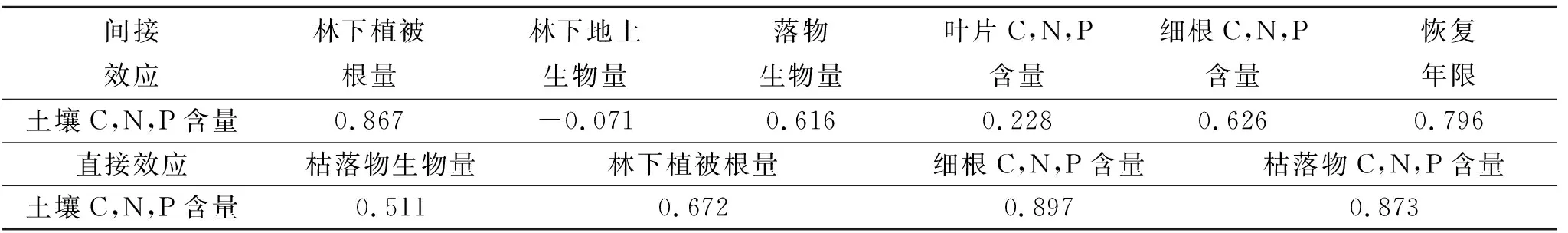
表2 路径分析的效应Table 2 Effects of Path Analysis
3 讨 论
3.1 植物-土壤C,N,P含量及化学计量演变特征
本研究中,不同恢复年限樟子松叶片的C含量为489.31~534.13 g/kg,高于我国黄土高原植被叶C含量(438 g/kg),高C代表具有高有机物含量[18]。叶片的N含量(17.06~19.45 g/kg)小于中国植物叶片平均N含量(20.24 g/kg)[19],植被恢复前46 a叶片的P含量从1.44 g/kg增长到1.69 g/kg,这与我国黄土高原植被叶片P平均含量为1.60 g/kg相符[18]。樟子松叶片的N,P含量显著高于其他组织,叶片是植物光合作用的器官,新陈代谢最旺盛的部位,故氮、磷含量较高[20]。枯落物是森林生态系统植物和土壤养分循环的桥梁[21],枯落物的C含量随着林龄的增加不断累积,这与樟子松叶片C含量的变化相关,叶片是枯落物的主要来源,枯落物的N,P含量明显低于叶片,这是叶片在衰落前养分再吸收的原因[22]。樟子松细根C含量随着恢复年限的增加而增加,这与彭文英等[23]在黄土高原的研究结果一致,说明随着樟子松林林龄的增加,植被根部的固碳能力增强。
土壤的C,N,P含量分别为1.51~9.57 g/kg,0.40~0.80 g/kg和0.23~0.40 g/kg均低于全国平均(11.12,1.06,0.65 g/kg)水平[24],表明研究区土壤C,N,P元素相对贫瘠。随着植被恢复年限的增加,樟子松林土壤C,N,P含量不断增加至35 a后没有显著变化,这与淑敏等[25]研究结果一致。Luyssaert等[26]的研究表明土壤有机碳的积累和林龄是正相关关系,土壤理化性质和凋落物等因素均会影响到土壤C,N,P含量,本研究中凋落物生物量从35 a后没有显著变化,从而使得土壤C,N,P含量变化减缓。
樟子松叶片的C∶N和 C∶P可以反映植物的养分利用效率[27],其与植物生长的速率呈负相关关系,较高的C∶N与C∶P代表植物对N,P的利用率较高[28],图2可以看出随着植被恢复年限的增加叶片C∶N和 C∶P不断增加且到35 a后增加不显著(p>0.05),说明樟子松林地在植被恢复初期生长速率更快,对N,P的养分利用效率更高,这也证实了植物在养分缺乏的情况下养分利用效率更高[27]。大量研究表明,叶片的N∶P比值可以用来揭示生态系统中的N限制(N∶P<14)、P限制(N∶P>16)以及N和P共同限制(14 樟子松植物组织与土壤C,N,P含量之间线性拟合关系看出,植被恢复后土壤C的增加与枯落物密切相关,土壤N,P含量的增加与细根养分的输入密切相关。任悦等[31]在东北沙地樟子松林的研究中也发现枯落物和土壤有机碳具有显著的相关关系,这也证明了枯落物是森林物质循环和能量流动的主要途径[32]。植物根系除了可以支撑植株、从土壤中获取养分外还可以通过死亡和分解向土壤输入养分。研究表明,由细根产生和分解向土壤中输入的N量高于枯落物,且细根死亡分解时还可以向土壤中输入K,P等营养元素。这与本研究结果一致,可见,细根对森林养分循环也具有重要意义。 土壤化学计量比的变化也是植被-土壤生态系统养分循环的主要环节,可以判断土壤限制性元素及养分调控因素[4]。通过对樟子松3个植物组织和土壤化学计量比的拟合关系(图5)可以看出,C∶P在叶、枯落物、根和土壤之间呈现出显著的线性相关关系(p<0.05)。这与章广琦等[33]在陕北黄土丘陵区油松人工林乔木、灌草、枯落物和土壤中相关性分析结果一致。可能由于樟子松林地中,造林前的沙土养分贫瘠,土壤P含量来源主要是沙土中沙的风化,P的养分积累较慢,凋落物分解进入土壤中的P素优先被林下植被先吸收利用,樟子松从土壤中得到的较少,久而久之,樟子松植物中的P含量也不断下降,而樟子松是常绿乔木C含量不断累积,因此植物和土壤的C∶P不断增加,且随着植被重建年限的增加协同演变。 土壤是植物生长发育的物质基础,其理化性质及化学计量会直接影响植物群落的结构特征和分布规律[5]。本研究中,随着植被重建年限的增加土壤C∶P和植物群落多样性指数与丰富度指数呈现负相关关系,这是因为土壤C∶P同P的有效性呈现负相关关系[4],而P素具有刺激植物形成强壮根系和促进植物持续生长发育的重要作用[34],因此随着土壤C∶P的增加,植物群落多样性呈现出减小的情况。 枯落物生物量、林下植被根量、枯落物C,N,P含量和细根C,N,P含量作为土壤C,N,P含量的主要直接影响因子,直接效应系数分别为0.511,0.672,0.873,0.897(表2),其随植被恢复年限的变化也将深刻地影响土壤C,N,P含量。植被恢复后枯落物的生物量以及林下植被根量的增加与土壤C,N,P含量的增加密切相关,这也与回归分析的结果基本一致(图4)。植被恢复后,除林下地上生物量,其余两种生物量与土壤C,N,P含量呈显著正相关关系,这说明随着植被恢复年限的增加,土壤C,N,P含量随着林下植被根量和枯落物生物量的增加而增加。此外,枯落物C,N,P含量和细根C,N,P含量对土壤C,N,P含量有极显著的直接影响,说明枯落物C,N,P含量和细根C,N,P含量是土壤C,N,P含量的直接影响因子。枯落物C,N,P含量和细根C,N,P含量除了对土壤C,N,P含量有较高的直接效应外,对其的间接影响系数分别为0.873,0.897(表2),说明枯落物生物量和林下植被根量是土壤C,N,P含量的重要影响因子,这是因为随着植被恢复年限的增加,植被生长逐渐趋于稳定,樟子松的细根通过死亡和分解向土壤输入养分,枯落物向土壤中的归化也会使土壤C,N,P含量显著增加。 虽然恢复年限对土壤C,N,P含量没有直接效应,但其对土壤C,N,P含量的间接效应系数和模型总效应较高,其值分别为0.796,23.0%(图6),这说明植被恢复年限也是引起土壤C,N,P含量变化的重要因素。枯落物生物量和林下植被根量对土壤C,N,P含量的总效应系数较高分别为15.4%和18.2%(图6),此外林下地上生物量对土壤C,N,P含量不管是间接效应还是总效应都较低,其值分别为:-0.071,1.9%。植被恢复后,植物的生长提高了枯落物生物量,促进了微生物对枯落物的分解,土壤腐殖质含量增加导致土壤C,N,P含量随之增加。并且林下细根生物量随着植被恢复年限的增加而增加,樟子松林生长趋于稳定后,向土壤中摄取的养分减少,死根的归化以及根系分泌物的释放导致土壤C,N,P含量随之增加。林下地上生物量的减少是因为随着植被恢复年限的增加其他植被受樟子松的抑制而逐渐消失,因此樟子松林下植被多样性降低。总而言之,植被恢复后枯落物生物量和林下植被根量的增加通过影响枯落物C,N,P含量和细根C,N,P含量从而使土壤C,N,P含量增加,枯落物生物量和林下植被根量是土壤C,N,P含量的重要影响因子;恢复年限通过影响枯落物生物量和林下植被根量而间接影响土壤C,N,P含量,同样是土壤C,N,P含量变化的重要影响因素。 (1) 榆林毛乌素沙地樟子松林各植物组织C,N,P含量及化学计量比存在显著差异,养分含量均以叶片最高,化学计量比则以枯落物最高,表明樟子松林各植物组织间养分需求与平衡关系显著不同。与半固定沙地相比,植被恢复显著改变了樟子松植物组织和土壤的C,N,P含量,随着恢复年限的增加,枯落物C,N含量、细根P含量以及土壤C,N,P含量呈增加趋势,可见枯落物和根与土壤间存在密切联系。回归分析表明,土壤C含量的增加主要来自枯落物的输入,土壤N,P含量的增加主要来自细根养分的输入。 (2) 与半固定沙地相比,植被恢复显著改变了樟子松植物组织和土壤的化学计量比,叶片和枯落物C∶N以及各组分的C∶P,N∶P均显著增加。随着恢复年限的增加,枯落物和细根C∶N、叶片与细根C∶P和N∶P呈降低趋势,叶片C∶N和枯落物C∶P,N∶P呈增加趋势,土壤的化学计量比呈相对稳定,可见植物和土壤化学计量特征间互相影响,并且C∶P是影响樟子松林地植物-土壤间养分交互的关键化学计量比。 (3) 植被恢复引起枯落物生物量和林下植被根量的增加从而导致土壤C,N,P含量的增加。3.2 植物-土壤化学计量特征之间的演变关系
3.3 植被恢复后土壤C,N,P含量影响因子
4 结 论

