农户田块尺度冬小麦不同产量水平土壤细菌群落差异
米 倩,陈鲜妮,徐晓峰
(河南科技大学农学院,河南洛阳 471000)
目前全球人口的持续增长要求提高粮食产量以满足社会需求,全球粮食生产正面临巨大挑战[1]。过去几十年时间,我国粮食产量提高是建立在大量施用化肥基础上的[2]。但是,过量的肥料施用不仅使作物不能增产[3],而且会引起硝酸盐淋洗、土壤污染、水体富营养化等问题[4, 5]。目前迫切需要新的策略来提高作物产量。土壤微生物是土壤生态系统的重要组成部分,在农业生产中扮演着重要角色[6]。细菌是土壤微生物中数量最大的类群,与土壤碳、氮循环关系密切[7],而且土壤细菌对植物健康和植物生长也有影响[8]。土壤细菌可以通过参与养分循环促进作物吸收养分以及维持作物健康和生长发育,为作物高产奠定基础[9]。
小麦在我国农业生产中占有重要地位,小麦产量提升对我国粮食安全起着重要作用[10]。有学者研究发现,土壤细菌与小麦产量存在联系。如,长期施肥条件下土壤细菌多样性与小麦产量呈显著正相关[11];小麦与苜蓿、豌豆、油菜间混作可增加土壤细菌数量,进而提升小麦产量[12]。值得注意的是现有研究大多采用田间试验探讨特定因子影响下土壤细菌对小麦产量的影响[11-13]。但我国的粮食生产主要依靠农民,田间试验很难反映我国农户农田经营实际情况,在指导农业生产方面有一定的局限性。此外,扬花期是冬小麦由营养生长转变为生殖生长的阶段,是决定麦穗籽粒数以及产量的关键时期[14, 15],这一时期小麦植株新陈代谢旺盛,需吸收大量养分满足生长需要[16],而细菌在土壤养分转化中发挥着重要作用,因此扬花期土壤细菌对决定小麦产量十分重要。刘晓丹等[13]研究发现,小麦扬花期土壤细菌数量与产量呈显著正相关,但是目前相关研究仍相对较少,扬花期土壤细菌群落与小麦产量之间的关系仍不清楚。本研究通过大田调查的方法,以小麦种植户田块为研究对象,采集扬花期麦田土壤样品,分析农户麦田土壤细菌群落特征及其与小麦产量的关系,以期为实现小麦持续稳定增产提供科学依据。
1 材料与方法
1.1 研究区域和样本采集
研究区位于黄淮海小麦主产区西侧河南省济源市,地处于南太行山前,属暖温带季风气候区,年平均气温14.5 ℃,年平均降雨量567.9 mm,土壤类型按地理发生分类为褐土。土壤养分平均含量:有机质19.42 g·kg-1、全氮1.11 g·kg-1、有效磷17.30 mg·kg-1、速效钾143.50 mg·kg-1[17]。本研究于2020年9月采用分层随机抽样法选取样本,在河南省济源市随机抽取2个乡镇,在抽取的各乡镇内随机抽取4~8个自然村,每个自然村内随机抽取1~3户小麦种植户,以其麦田作为研究对象,同时要求所选田块面积不小于0.1 hm2,以保证田块具有代表性。最终征集到19个田块(田块面积为3~50 hm2),采样田块位于五龙口镇(112°42'26.97"E,35°09'56.03"N)和梨林镇(113°14'54.77"E,35°13'15.47"N),样点信息见表1。
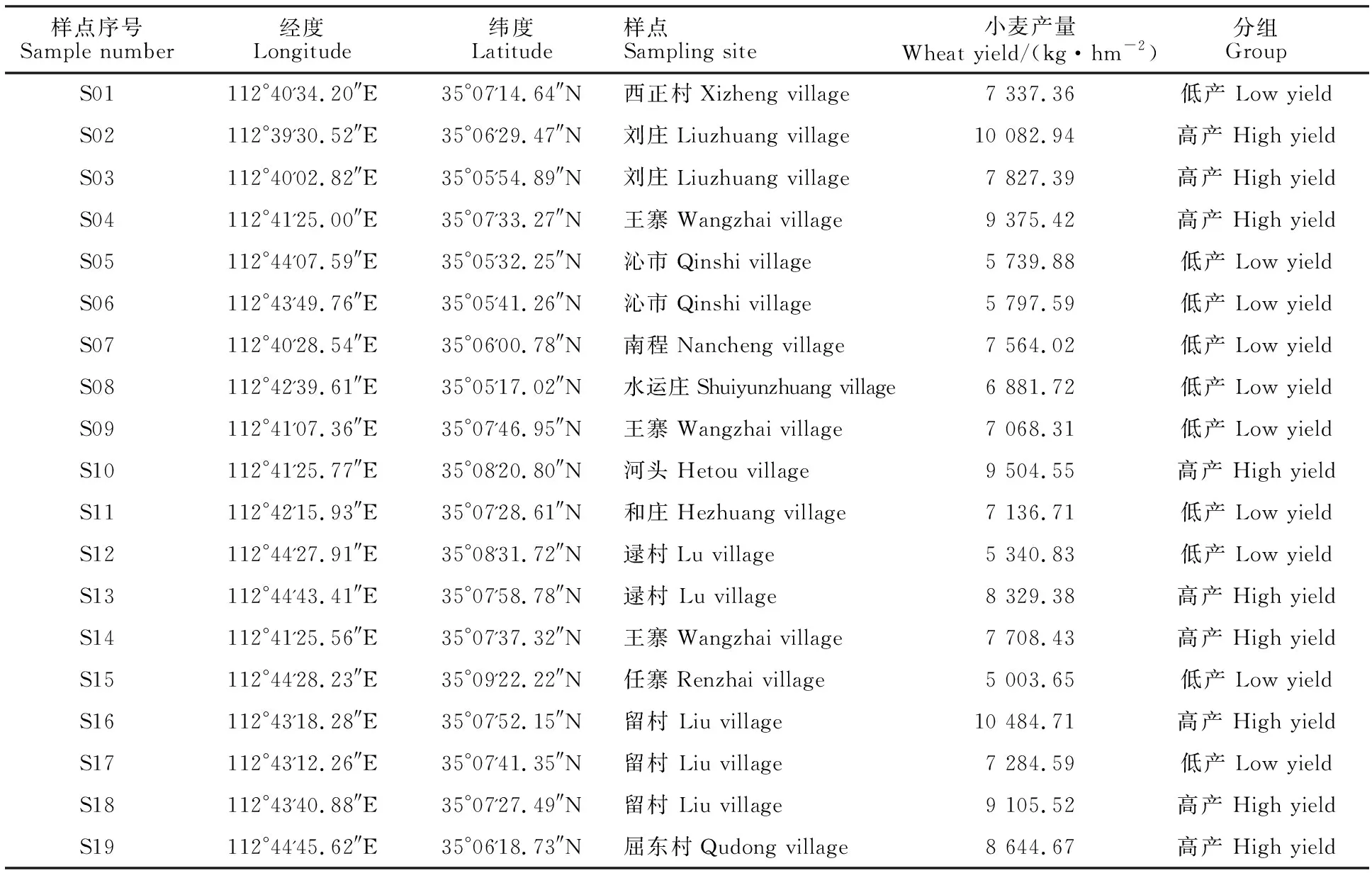
表1 采样点基本信息Table 1 Basic information of sampling sites
于冬小麦扬花期(2021年4月25日-5月1日)在每个田块随机选取3个样方(样方间距离较远且远离地头、地边和公路,以保证具有代表性),各个样方内用铁锹将耕层土壤混合均匀,进行土壤样品采集。土壤样品带回实验室去除植物根、石子等杂质后,将3个样方土壤样品混合均匀后作为该田块土壤分析样本。采用1 m双行测产法进行小麦产量测定。于小麦成熟期(2021年5月25日-5月26日)在每个田块随机选取3个采样点,每个采样点取20株长势均匀的小麦植株,带回实验室后将穗分离,杀青烘干至恒重后,脱粒称重,测定小麦穗粒数及千粒重;对每个田块的行距进行测定,并在每个田块选取3个长1 m且有代表性的采样段,调查统计小麦穗数。
1.2 土壤理化性质及土壤酶活性测定
土壤全氮(TN)含量以CuSO4为催化剂浓H2SO4消化,连续流动分析仪(AA3,德国SEAL)测定;土壤有机质(SOM)含量用重铬酸钾-外加热法测定;土壤硝态氮(NO3--N)含量用0.01 mol·L-1CaCl2提取,紫外可见分光光度计测定;土壤铵态氮(NH4+-N)含量用2 mol·L-1KCl提取,连续流动分析仪测定;土壤有效磷(AP)含量采用0.5 mol·L-1NaHCO3提取,连续流动分析仪测定;土壤速效钾(AK)含量用1 mol·L-1NH4OAc浸提,火焰光度法测定;土壤pH值采用土水质量比1∶2.5的0.01 mol·L-1CaCl2浸提,电位法测定[18]。
参照关松荫[19]等的方法测定土壤脲酶(URE)、过氧化氢酶(CAT)、酸性磷酸酶(ACP)、碱性磷酸酶(ALP)活性。脲酶活性采用苯酚-次氯酸钠比色法测定,其活性以培养24 h后1 g土壤中NH4+-N的毫克数表示。过氧化氢酶活性用紫外可见分光光度法测定,其活性以20 min内1 g土壤分解的H2O2的毫克数表示。磷酸酶活性用磷酸苯二钠比色法测定,其活性以1 h内1 g土壤产生的对硝基苯酚的毫克数表示。
1.3 产量数据处理
小麦理论产量=穗数×穗粒数×千粒重×0.8。
以平均产量为标准对样本进行不同产量水平的划分,高于平均产量的田块划为高产组,低于平均产量的田块划为低产组。本研究平均产量为7 695.67 kg·hm-2,高产组与低产组的田块数分别为9个和10个(表1)。
1.4 DNA提取和测序
使用TGuide S96磁珠法-土壤基因组DNA提取试剂盒完成核酸的提取。采用引物338F(5'-ACTCCTACGGGAGGCAGCA-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')进行细菌PCR扩增。将PCR产物用1.8 %琼脂糖凝胶电泳检测,使用Monarch DNA凝胶回收试剂盒切胶回收PCR产物。凝胶纯化后的PCR产物使用Illumina NovaSeq 6000进行测序分析,该测序平台由北京百迈客生物科技有限公司提供。使用Trimmomatic-0.33对原始序列进行质量过滤,用Cutadapt-1.9.1进行引物序列的识别与去除,使用Usearch-10进行序列拼接,使用Uchime-4.2鉴定并去除嵌合体序列,得到的高质量序列使用Usearch-10按照97%相似性将序列划分为不同的OTU。采用SILVA-138数据库进行细菌物种分类注释。
1.5 统计分析
采用SPSS-26对不同产量水平的数据进行正态性检验和方差齐性检验,并进行单因素方差分析,比较不同产量水平小麦产量、土壤理化性质以及酶活性差异。用R-4.1.0软件cor.test()函数“Spearman”算法对细菌门相对丰度、属相对丰度与小麦产量进行Spearman相关性分析。利用Origin-2022软件进行相关性热图绘制,明确对小麦产量有显著影响的细菌类群与环境因子的关系。使用SPSS-26的Kruskal-Wallis秩和检验对不同产量水平细菌α-多样性进行差异性分析。使用R-4.1.0软件“vegan”包进行基于Bray-Curtis距离的非度量多维尺度(non-metric multidimensional scaling,NMDS)分析,计算土壤细菌群落β-多样性;通过相似性分析(analysis of similarities,ANOSIM)检验不同产量水平之间β-多样性差异显著性。使用R-4.1.0软件cor.test()函数“Spearman”算法对β-多样性指数与土壤理化性质、酶活性进行Spearman相关性分析。
用R-4.1.0软件构建偏最小二乘路径模型(partial least squares path modeling,PLS-PM),评价土壤理化性质、土壤酶活性、细菌多样性以及物种丰度对小麦产量的影响。其中,细菌多样性用Chao1指数和香农指数表征,物种丰度用细菌属水平的相对丰度表征。用拟合优度指数(goodness-of-fit,GOF)评价模型的整体拟合度。
2 结果与分析
2.1 麦田土壤理化性质及酶活性
高产组和低产组的小麦产量均值分别为9 007.00和6 515.47 kg·hm-2(表2),两组间差异极显著(P<0.001)。高产组的土壤铵态氮含量显著高于低产组(P<0.05),土壤有机质含量、速效钾含量、有效磷含量、硝态氮含量、pH值在组间均无显著差异。高产组的酸性磷酸酶、碱性磷酸酶、脲酶和过氧化氢酶活性与低产组也均无显著差异(表3)。
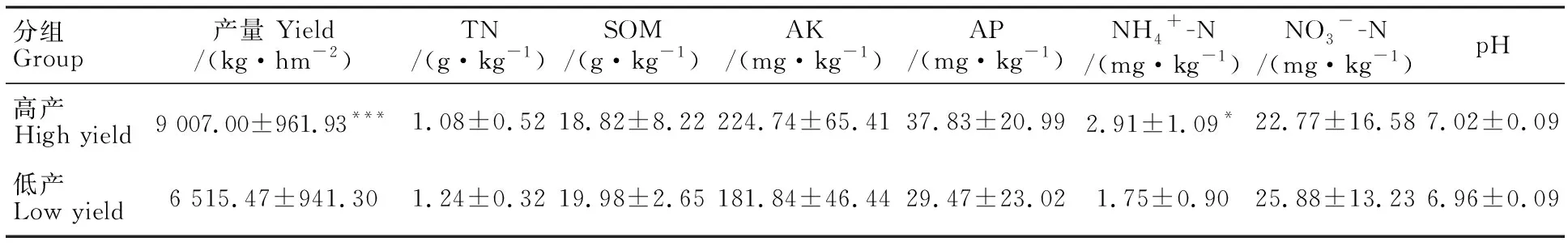
表2 不同产量水平下麦田土壤理化性质Table 2 Soil physicochemical properties in wheat field at different yield levels

表3 不同产量水平下麦田土壤酶活性Table 3 Soil enzyme activities in wheat field at different yield levels
2.2 麦田土壤细菌群落组成及多样性特征
从门水平看,麦田土壤细菌群落优势菌门为酸杆菌门(Acidobacteria,相对丰度21.89%~43.82%)和变形菌门(Proteobacteria,24.45%~37.40%),拟杆菌门(Bacteroidetes,4.34%~12.33%)、绿弯菌门(Chloroflexi,4.28%~7.85%)、芽单胞菌门(Gemmatimonadetes,4.72%~7.69%)、放线菌门(Actinobacteria,3.01%~8.85%)的相对丰度较高(图1a)。从属水平看,麦田土壤细菌群落优势菌属为uncultured_c_Subgroup_6(11.64%~29.10%),RB41(2.53%~12.85%)、鞘脂单胞菌属(Sphingomonas,1.47%~9.35%)、uncultured_f_Gemmatimonadaceae(2.44%~5.12%)、uncultured_c_Deltaproteobacteria(1.66%~4.60%)的相对丰度较高(图1b)。
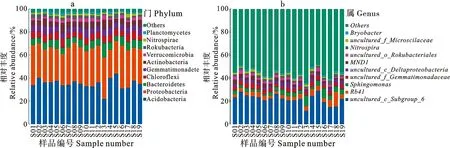
图1 麦田土壤细菌群落在门(a)和属(b)分类水平上的相对丰度
土壤细菌α-多样性用Chao1指数和香农指数表示。麦田土壤细菌OTU数量为1 529~1 741条,Chao1指数为1 641~1 792,香农指数为8.82~9.44。通过Kruskal-Wallis秩和检验发现,高产组的细菌OTU数量、Chao1指数以及香农指数与低产组都无显著差异(表4)。通过非度量多维尺度(NMDS)对土壤细菌β-多样性进行分析表明,拟合度较好(Stress<0.1)(图2),ANOSIM发现,高产组的细菌群落β-多样性与低产组差异显著(r=0.20,P<0.01)。
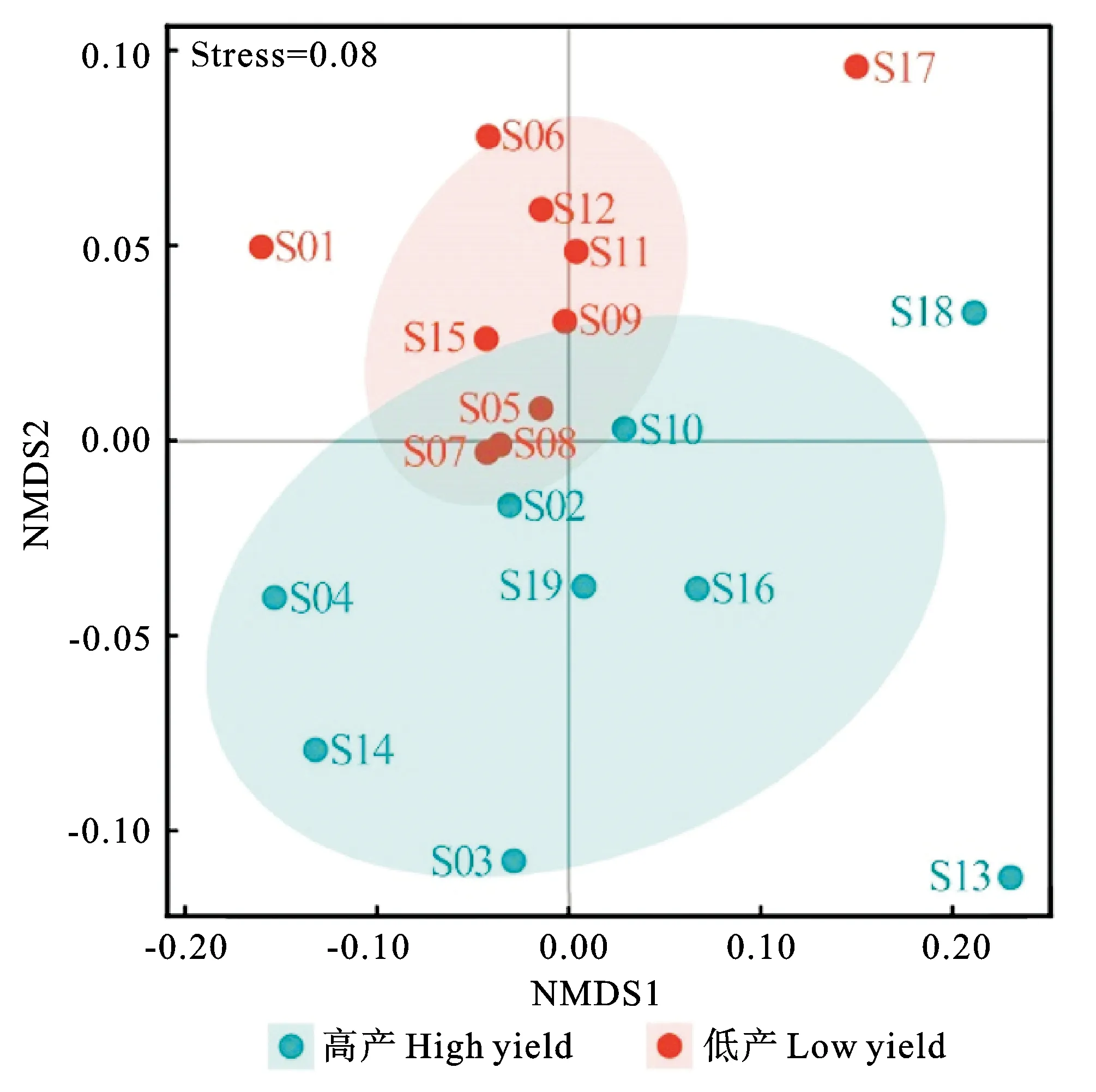
图2 不同产量水平下麦田土壤细菌β-多样性

表4 不同产量水平下麦田土壤细菌α-多样性Table 4 α-diversity of soil bacteria in wheat field at different yield levels
2.3 土壤细菌群落特征与小麦产量的关系
相关性分析(表5)表明,小麦产量与芽单胞菌门(Gemmatimonadetes)、装甲菌门(Armatimonadetes)、纤维杆菌门(Fibrobacteres)相对丰度呈显著正相关,与Latescibacteria、Dadabacteria相对丰度呈显著负相关。属水平上,有36个细菌属的相对丰度与小麦产量显著相关,其中Bryobacter、黄杆菌属(Flavisolibacter)、芽单胞菌属(Gemmatimonas)、丰佑菌属(Opitutus)、黏液杆菌属(Mucilaginibacter)相对丰度与小麦产量呈显著正相关,Dongia、Chryseolinea、Pantoea、陶厄氏菌属(Thauera)、多囊菌属(Polyangium)、Chitinophaga相对丰度与小麦产量呈显著负相关(剩余25个属因属于未鉴定的细菌未列出)。
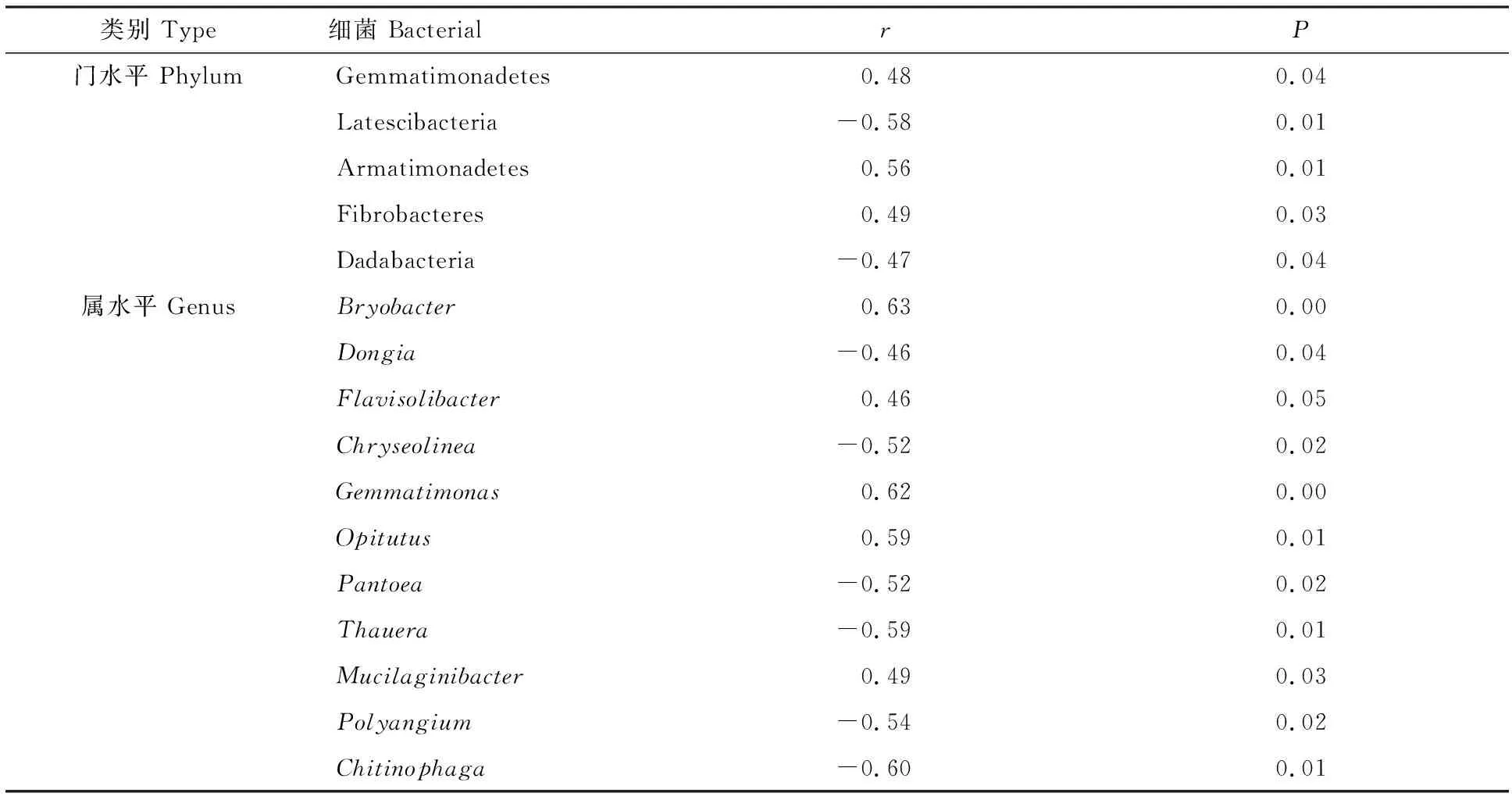
表5 小麦产量与土壤细菌门/属相对丰度的相关性Table 5 Correlation analysis of wheat yield with relative abundance of bacterial phylum/genus
2.4 土壤理化性质、酶活性与细菌群落的关系
为明确对小麦产量有显著影响的细菌类群与环境因子的关系,对细菌门和属水平相对丰度与土壤理化性质、酶活性进行相关性分析。结果(图3)表明,芽单胞菌门、纤维杆菌门相对丰度与铵态氮含量呈显著正相关,纤维杆菌门相对丰度还与过氧化氢酶活性呈显著负相关;Latescibacteria相对丰度与铵态氮含量呈极显著负相关,与全氮含量呈显著正相关。Dongia、Pantoea相对丰度与pH值呈显著负相关,Chryseolinea、陶厄氏菌属相对丰度与铵态氮含量呈极显著负相关;丰佑菌属相对丰度与铵态氮含量呈极显著正相关,与全氮、有机质含量以及碱性磷酸酶、脲酶、过氧化氢酶活性呈显著负相关;黏液杆菌属相对丰度与碱性磷酸酶、过氧化氢酶活性呈显著负相关。为明确影响细菌β-多样性的环境因子,对NMDS组分与土壤理化性质、酶活性进行相关性分析,其中NMDS1与铵态氮含量呈显著正相关,与全氮、有机质含量及酸性磷酸酶、碱性磷酸酶、脲酶、过氧化氢酶活性呈显著负相关,NMDS2与土壤理化性质以及酶活性无显著相关性(表6)。
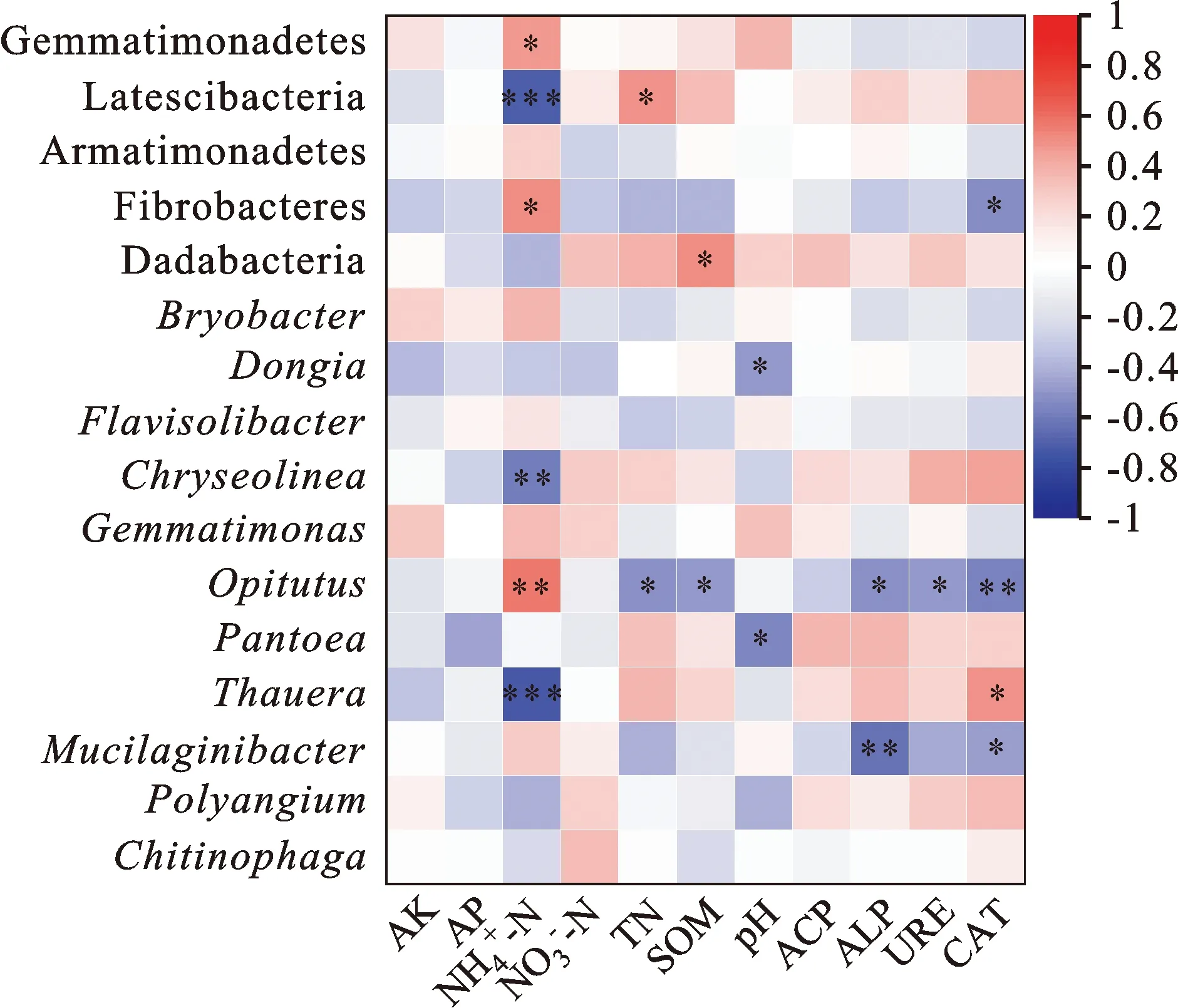
图3 细菌门和属水平相对丰度与土壤理化性质、酶活性的相关性
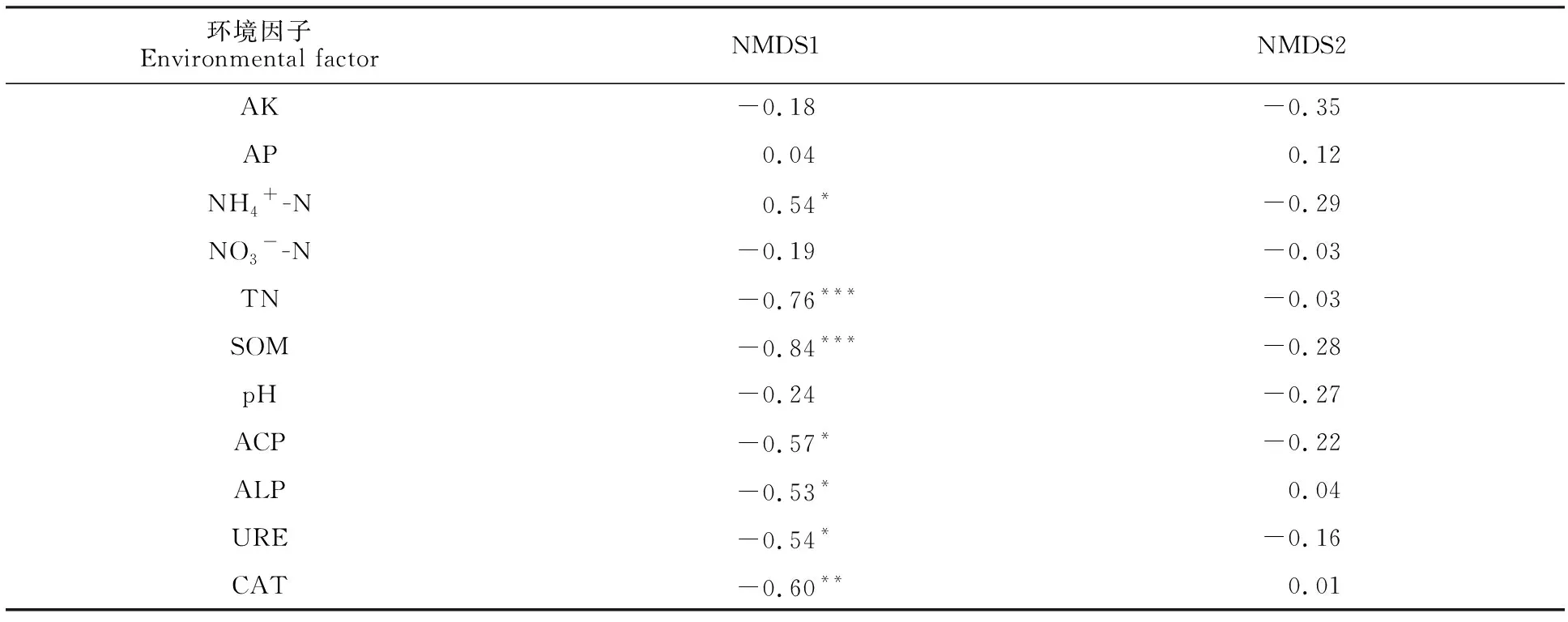
表6 细菌β-多样性与土壤理化性质、酶活性的相关性Table 6 Correlation of bacterial β-diversity with soil physicochemical properties and enzyme activities
2.5 土壤理化性质、酶活性、细菌群落与小麦产量的关系
为了更好地研究土壤理化性质、土壤酶活性、细菌多样性、物种丰度以及小麦产量之间的关系,构建偏最小二乘路径模型(PLS-PM,图4a)。模型解释了37%的小麦产量方差,模型拟合效果较好,拟合优度(GOF)为0.563。土壤理化性质(TN、SOM)和细菌物种丰度(属水平)对小麦产量有显著直接正向影响,酶活性(ACP、ALP、URE、CAT)对小麦产量有显著的直接负向影响(表6)。其中,土壤理化性质也可通过显著影响酶活性和细菌物种丰度来间接影响小麦产量。细菌多样性和物种丰度对小麦产量表现出总的正向影响,土壤理化性质和酶活性对小麦产量表现出总的负向影响(图4b)。
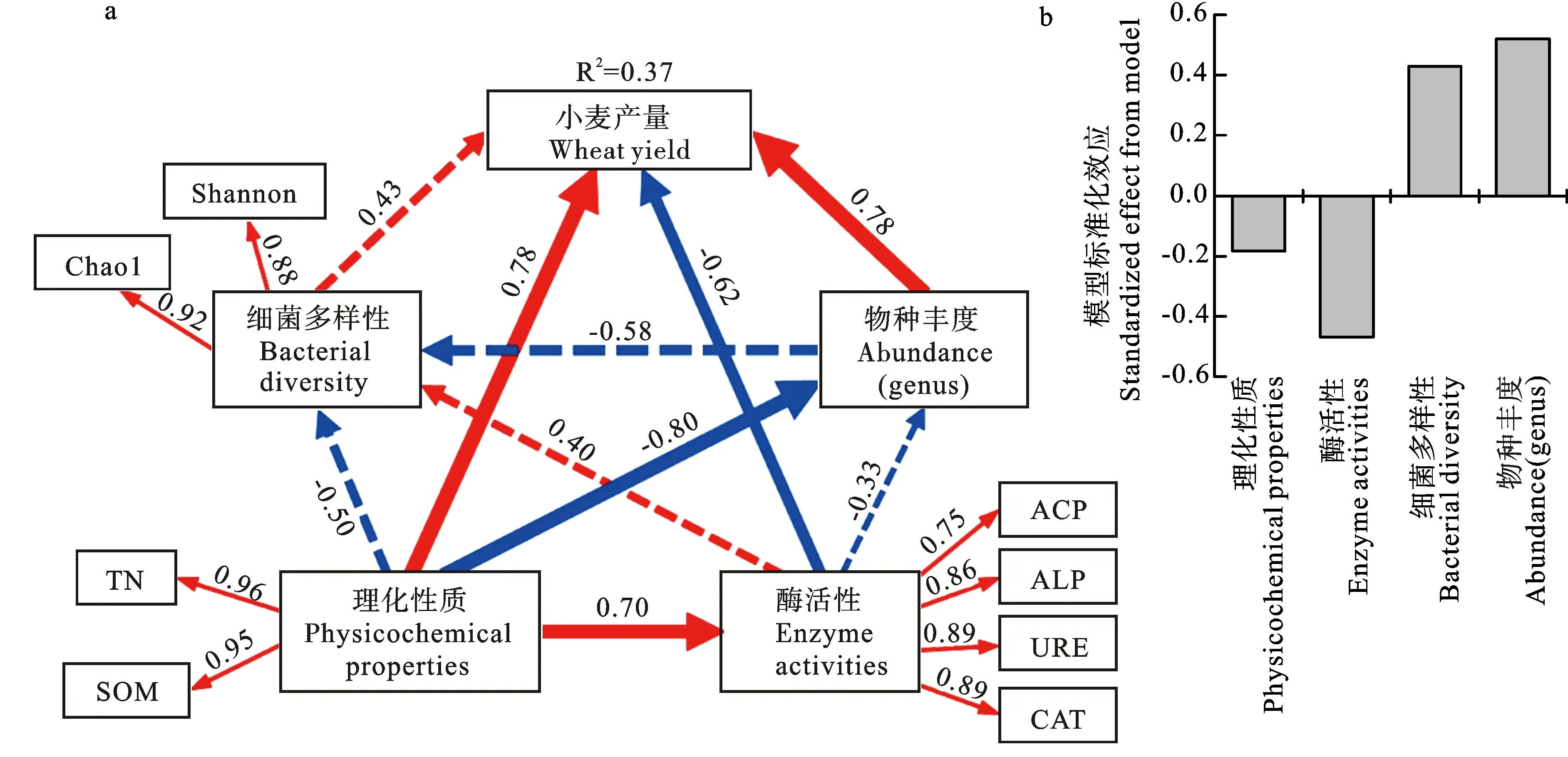
图4a中PLS-PM路径上的数字表示路径系数,箭头粗细与路径系数大小成正比。红色箭头表示系数为正,蓝色箭头表示系数为负。实线表示显著影响,虚线表示不显著的影响。模型拟合优度为0.563。图4b为PLS-PM标准化总效应(直接效应与间接效应的总和)。
3 讨论
3.1 土壤理化性质、酶活性对小麦产量的影响
硝态氮和铵态氮是植物能够直接吸收的主要氮素形态[20]。本研究中,小麦高产组和低产组之间土壤硝态氮含量无显著差异,高产组土壤铵态氮含量显著高于低产组(P<0.05),这可能与施肥有关[21]。PLS-PM表明,土壤理化性质(TN、SOM)对小麦产量具有显著直接正向影响(图4a)。Wu等[22]分析得出,土壤全氮和有机质含量与水稻产量显著相关,说明土壤全氮和有机质对作物产量十分重要。此外,脲酶在氮素转化中起着重要作用,磷酸酶可促进土壤磷素有效转化[23],过氧化氢酶能促进土壤过氧化氢分解[24],因此土壤酶可通过促进养分循环来影响作物产量。郭书亚等[25]、杨旸等[26]研究表明,作物产量与土壤脲酶、碱性磷酸酶活性呈显著正相关。而本研究认为,土壤酶活性对小麦产量具有显著的直接负向影响(图4a)。造成此结果的原因可能与部分田块存在氮肥过量施用现象有关(调查取样发现部分田块出现贪青晚熟、无效分蘖多的现象)。已有研究发现,土壤酶活性与氮肥用量呈显著正相关[27],大量施用氮肥可以增加土壤酶活性,但氮肥施用过多会引起无效分蘖增加,进而造成小麦减产[28],这可能是造成本研究酶活性对小麦产量产生负向影响的主要原因。
3.2 土壤细菌群落结构、多样性对小麦产量的影响
土壤微生物群落结构越复杂土壤生态系统越稳定[29];较高的土壤微生物多样性可以维持一个相对稳定和健康的土壤生态系统,有助于促进土壤养分循环[30],为作物生长发育提供充足养分。本研究发现,不同产量水平麦田土壤细菌β-多样性差异极显著(图2,P<0.01)。通过PLS-PM模型分析表明细菌物种丰度对小麦产量有显著正向影响(图4a)。目前有关土壤细菌对作物产量的影响研究结果存在差异,如Fan等[11]通过结构方程模型分析得出土壤细菌多样性对小麦产量有显著正向影响;Wu等[22]认为土壤细菌多样性以及属水平丰度对超级稻产量影响显著;Sun等[31]提出大豆产量与细菌丰度呈显著正相关,与细菌多样性无显著相关性。土壤细菌多样性受土壤类型、植被类型、气候类型等诸多因素影响[32],Fan等[11]、Wu等[22]、Sun等[31]的研究结果可能就是这些因素的差异导致与本研究不同。此外,土壤细菌对环境变化十分敏感。本研究中,土壤理化性质(TN、SOM)对细菌物种丰度影响显著(图4a,P<0.05),细菌β-多样性(NMDS1)与土壤全氮、有机质含量显著相关(表6)。Tian等[33]也发现土壤全氮、有机质对细菌多样性存在显著影响。因此,土壤有机质、全氮是影响土壤细菌群落的重要环境因子。
3.3 影响小麦产量的土壤细菌类群
本研究结果显示,小麦产量与装甲菌门、芽单胞菌门、纤维杆菌门相对丰度呈显著正相关(P<0.05),与Latescibacteria、Dadabacteria相对丰度呈显著负相关(表5,P<0.05)。芽单胞菌门、纤维杆菌门、Latescibacteria相对丰度与铵态氮含量显著相关(图3)。有研究表明,装甲菌门可促进土壤糖类降解以及参与氮循环[34, 35],芽单胞菌门能够代谢糖类以及氨基酸聚合物[36],纤维杆菌门可促进纤维素降解[37],Latescibacteria可降解蛋白质、脂质和多糖[38],Dadabacteria可将硝酸盐转化为亚硝酸盐,进而转化为氨参与氮循环[39],这些细菌可能通过参与土壤碳、氮循环影响作物吸收养分,进而对作物产量产生影响。Latescibacteria相对丰度与氮肥施用量显著相关[40]。本研究中Latescibacteria相对丰度与小麦产量呈负相关的原因可能与氮肥施用量有关。由于Dadabacteria主要存在于深达100 m的地下水中[41],目前有关其与作物产量的关系研究甚少,因此Dadabacteria相对丰度与小麦产量呈显著负相关的原因需进一步研究。本研究还发现,小麦产量与Bryobacter、黄杆菌属、芽单胞菌属、丰佑菌属、黏液杆菌属、Dongia、Chryseolinea、Pantoea、陶厄氏菌属、多囊菌属、Chitinophaga等细菌属的相对丰度显著相关(表5,P<0.05)。Chryseolinea、陶厄氏菌属在土壤氮循环中发挥着重要作用[42, 43]。本研究中,Chryseolinea、陶厄氏菌属相对丰度与铵态氮含量显著相关。丰佑菌属通过将硝酸盐还原为亚硝酸盐促进土壤氮循环[44],丰佑菌属相对丰度变化与铵态氮、全氮、有机质含量显著相关(图3)。已有研究认为,Bryobacter、芽单胞菌属、多囊菌属、Chitinophaga可能在抑制土壤病原菌方面发挥作用[45-48];黄杆菌属具有硝化能力,可参与土壤氮循环[49];黏液杆菌属可产生胞外多糖[50];Dongia可保护植物免受热胁迫[51];Pantoea在调节小麦根际水分含量方面发挥重要作用[52]。这些细菌可能通过影响土壤病原菌,参与碳、氮循环等途径影响小麦生长发育,进而影响产量。本研究结果可能为实际农业生产中研发微生物菌肥提供参考。
4 结论
不同产量水平的麦田土壤细菌β-多样性差异显著。土壤细菌物种丰度(属水平)对小麦产量影响显著,土壤理化性质可通过显著影响酶活性和细菌物种丰度,进而影响小麦产量。细菌门水平上,提高土壤芽单胞菌门、装甲菌门、纤维杆菌门相对丰度,以及降低Latescibacteria、Dadabacteria相对丰度,有助于实现小麦增产。细菌属水平上,提高Bryobacter、黄杆菌属、芽单胞菌属、丰佑菌属、黏液杆菌属相对丰度,以及降低Dongia、Chryseolinea、Pantoea、陶厄氏菌属、多囊菌属、Chitinophaga相对丰度,有利于小麦产量提高。

