燕麦植物激素信号转导通路中响应干旱胁迫的关键基因
崔思宇,张志芬,付晓峰,刘俊青,杨海顺
(内蒙古自治区农牧业科学院 特色作物研究所,内蒙古呼和浩特 010032)
燕麦主要种植在干旱和半干旱地区,干旱是限制燕麦产量的主要因素。短期(14 d)中度干旱胁迫对燕麦根系生长指标及活力有促进作用,重度干旱胁迫持续抑制此类根系指标[1]。干旱导致燕麦结实率下降,空的白色小穗增加[2],株高变矮,叶片数、主茎数、穗数减少,叶片失绿发黄及籽粒产量显著下降[3],因此,解析燕麦抗旱机制、挖掘抗性基因尤为重要。
转录组测序已被广泛用于解析高粱[4]、向日葵[5]和其他植物[6-10]的抗旱机制,研究结果能够提供植物对水分胁迫应答的信号通路和相关基因表达的信息。基于高粱转录组分析发现,植物激素信号转导通路相关差异基因的表达模式与生理指标变化趋势吻合[4]。基于大麻转录组分析,了解了烯效唑处理对大麻响应干旱胁迫下植物激素信号转导过程生长素、脱落酸基因表达水平所发生的变化[7]。基于转录组KEGG分析结果表明,ABA合成代谢的关键酶,9-顺式-环氧类胡萝卜素双加氧酶被显著富集,说明三七可能通过ABA相关合成酶的增加调控干旱应答[8]。与对照相比,山桃干旱处理组的样本有260个差异表达基因参与72条代谢途径,显著富集到淀粉和蔗糖代谢、植物激素信号转导通路。植物激素参与调节作物生长发育代谢进程,并在抵抗非生物胁迫中起着重要作用[11-12],因此认为植物激素信号转导通路为应答干旱胁迫的主要代谢途径之一。
重度干旱胁迫下(田间最大持水量45%),燕麦叶片ABA、JA和SA含量显著升高, IAA含量显著降低[13]。JA 参与了干旱胁迫下根系发育的调节,在 PEG 介导的干旱胁迫条件下,细胞分裂素反应的调节与木质部发育密切相关,与细胞分裂素相比,JA 和干旱胁迫促进木质部分化[14]。JA在抵抗环境胁迫的过程中与ABA、乙烯(ET)、SA等植物激素具有协同和拮抗作用[15]。ABA为胁迫反应激素,在抵御非生物胁迫中起着重要作用[16-17]。ABA、ET、SA、赤霉素 (GA)、IAA和油菜素内酯 (BR),它们与JA一起参与复杂的信号网络响应非生物胁迫[15]。油用向日葵干旱胁迫下,ABA代谢过程中涉及的转录因子均表现为上调[18]。目前关于干旱对燕麦内源激素含量的影响报道较多,但关于干旱对燕麦植物激素信号转导通路中关键基因挖掘的报道较少。本研究将利用转录组测序,研究燕麦植物激素信号转导通路中响应干旱胁迫的关键基因,为燕麦抗旱机制解析提供依据,也为将来燕麦抗旱基因克隆、验证奠定基础。
1 材料与方法
1.1 植物材料和处理
选用抗旱燕麦品种皮燕麦“蒙燕1号”为材料,采用盆栽进行培养,基质为陶粒,室温培养,出苗7 d后,进行干旱胁迫处理,3个处理,分别为正常水分条件(CK)、轻度干旱胁迫(QD,10%PEG6000)和重度干旱胁迫(ZD,20%PEG6000),每个处理6盆。处理7 d后取叶,缓冲液清洗后,用滤纸吸干水分,立即投入液氮中,-80 ℃下储存备用, 每个处理3次生物学重复。
1.2 RNA-Seq 测序及分析
Trizol法提取总 RNA,质检合格后建库测序,对原始数据进行质控后得到clean reads用于后续分析。根据HISAT2的比对结果,利用Stringtie重构转录本,Stringtie有效利用转录本的丰度信息,能够组装出更多的转录本,组装结果也更为准确[19]。并利用RSEM[20]计算每个样本中所有基因的表达量,筛选FDR<0.05 且|log2FC|>1的基因为显著差异基因。参考基因组为2020 年 6 月 23 日公开发布的六倍体皮燕麦基因组,网址为 https://wheat.pw.usda.gov/jb/data=/ggds/oat-ot3098-pepsico[21]
1.3 实时荧光定量 PCR(qRT-PCR)分析
为验证RNA-seq 测序检测到 DEGs,本研究对8个重点基因进行 qRT-PCR 分析。燕麦Pepsico2_Contig1856.path1 [过氧化物酶体 (S)-2-羟基酸氧化酶基因,GLO1]为内参基因,该基因不同处理表达量均较高,而且相对稳定。引物序列如表1所示,用2-ΔΔCT方法计算试验样本中各基因相较于对照样本中各基因的相对表达量变化,使用GraphPad Prism7.0进行SD及P值分析。

表1 qRT-PCR 所用引物Table 1 Primers for qRT-PCR
2 结果与分析
2.1 干旱胁迫下差异表达基因(DEGs)鉴定
基于差异分析结果(图1),筛选FDR<0.05且|log2FC|>1的基因为显著差异基因(DEGs),与正常水分相比,轻度干旱胁迫下共获得624个DEGs,258个上调,366个下调,重度干旱下共获得13 063个DEGs,其中6 564个上调,6 499个下调。CK vs QD、CK vs ZD和QD vs ZD共有28个基因表达相同。282个基因只被轻度干旱胁迫诱导,不能被重度干旱诱导,5 925个基因只被重度干旱胁迫诱导,不能被轻度干旱诱导。
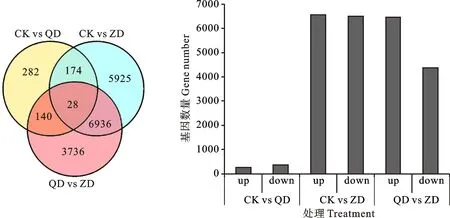
CK表示正常水分条件,QD表示轻度干旱胁迫,ZD 表示重度干旱胁迫。下图同。
对所有 DEGs 进行 GO 功能注释,如图2所示,将这些 DEGs 分为生物过程(biological process)、细胞组分(cellular component)和分子功能(molecular function)3 个子类。生物过程主要富集在代谢过程、细胞过程和单细胞生物过程等。细胞组分主要富集在细胞、组织和膜。分子功能主要富集在催化活性、结合、转运蛋白活性、核酸结合转录因子活性和分子功能调控。
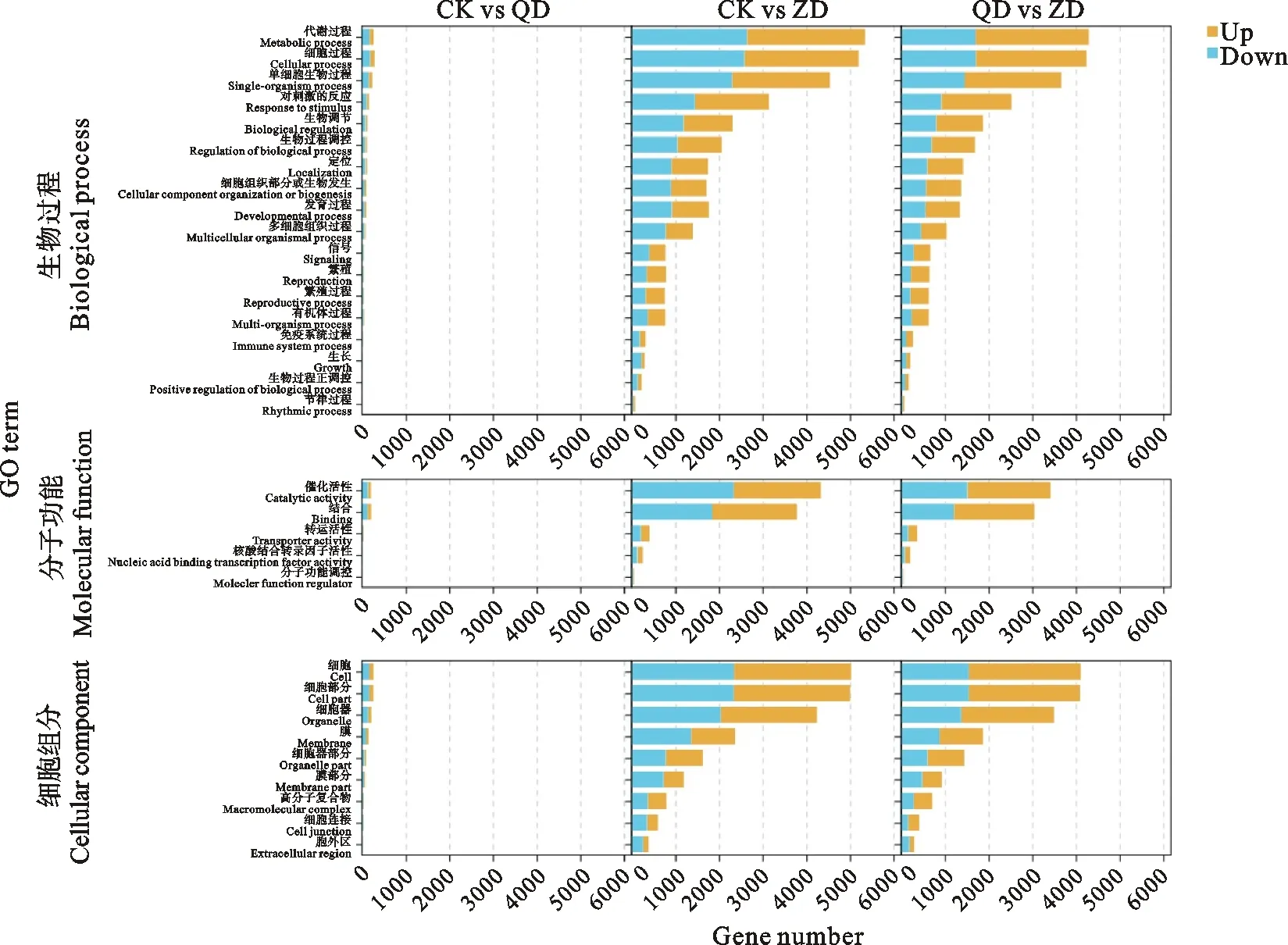
图2 不同处理间差异基因表达的GO分析
为探索响应干旱的基因功能分类和代谢途径,在 KEGG 数据库中对 DEGs 功能进行注释,如图3所示。
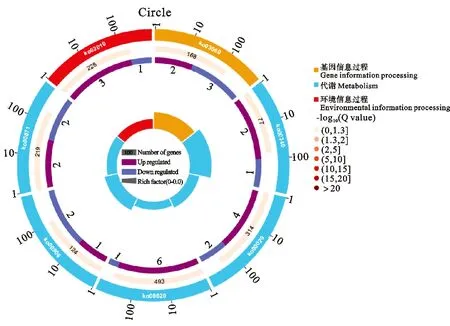
图3 燕麦轻度干旱胁迫显著富集的通路
QD vs CK,植物激素信号转导通路没有显著富集(P>0.05;Q>0.05),共有7个基因表达发生显著变化,其中生长素信号转导通路中AFR基因Pepsico1_Contig30676. Pat h1(ARF9)显著下调,表达量较高。细胞分裂素信号转导途径2个CRE1基因Pepsico1_Contig10314. path2和Pepsico1_Contig20676.path2表达下调,表达量较高。
ZD vs CK,KEGG富集分析结果表明DEGs显著富集在24个通路(P<0.05;Q<0.05)。如图4所示,22个为代谢途径,次生代谢物的生物合成和苯丙素生物合成2个代谢途径,-log10(Q值)>20,极显著富集,次生代谢物的生物合成通路350基因表达上调,398个下调;苯丙素生物合成通路41个基因表达上调,105个下调。基因信息过程只有1个通路显著富集DEGs,该通路为真核生物中的核糖体生物发生(Ko03008),富集70个DEGs,其中69个上调;环境信息过程1个通路显著富集DEGs,为植物激素信号转导(Ko04075),富集133个基因,其中44个上调,89个下调。
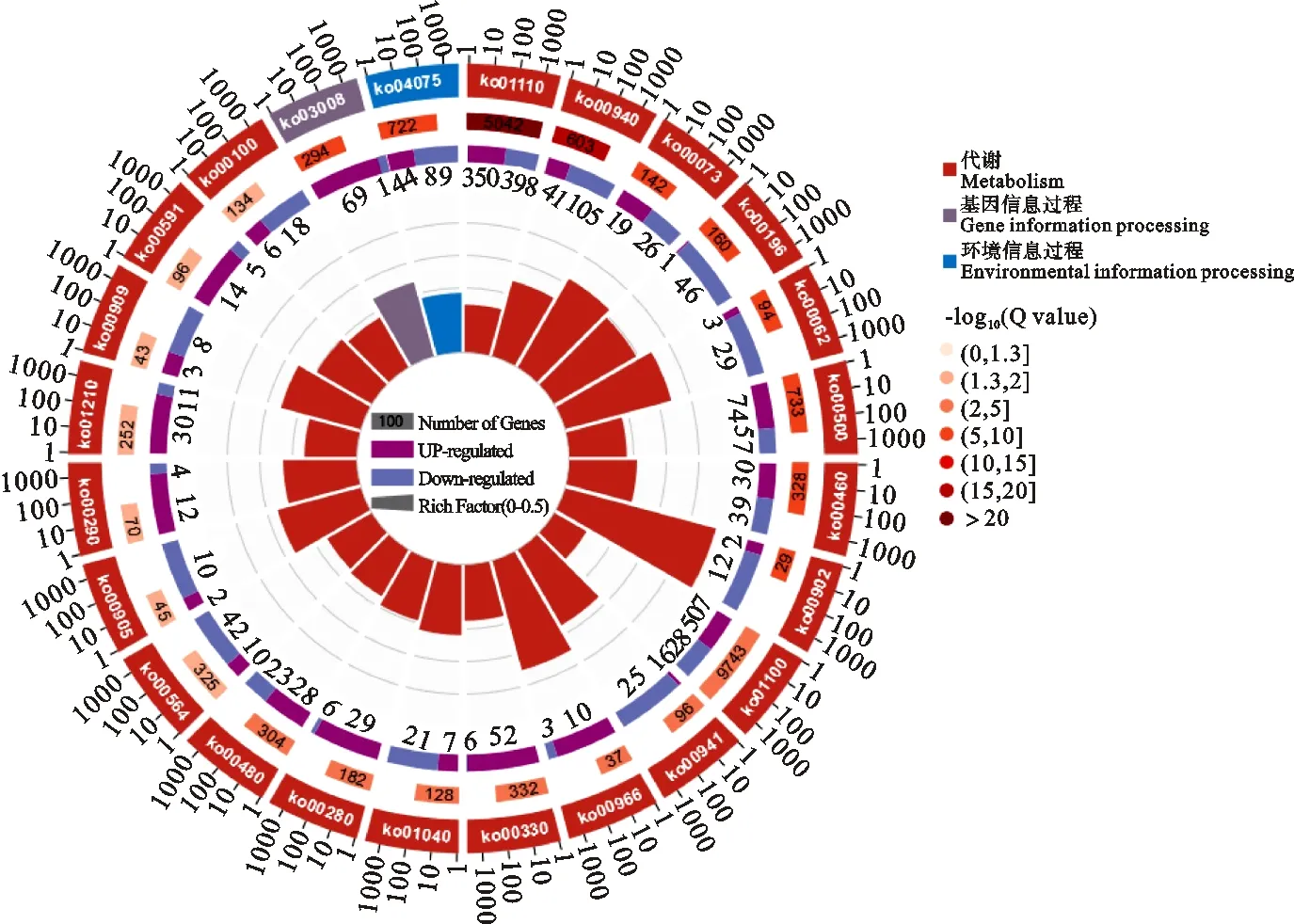
图4 燕麦重度干旱胁迫KEGG富集显著差异的通路
2.2 激素信号传导途径相关差异表达基因
图5显示,ZD vs CK,植物激素信号转导途径富集144个DEGs。生长素信号转导富集34个DEGs,其中29个下调,5个上调,5个AUX1、22个AUXIAA、1个SAUR下调,2个GH3上调,4个ARF基因,其中3个上调,1个下调, Pepsico1_Contig30676.path1(ARF9)和Pepsico1_Contig15350.path2(ARF9)表达量最高。
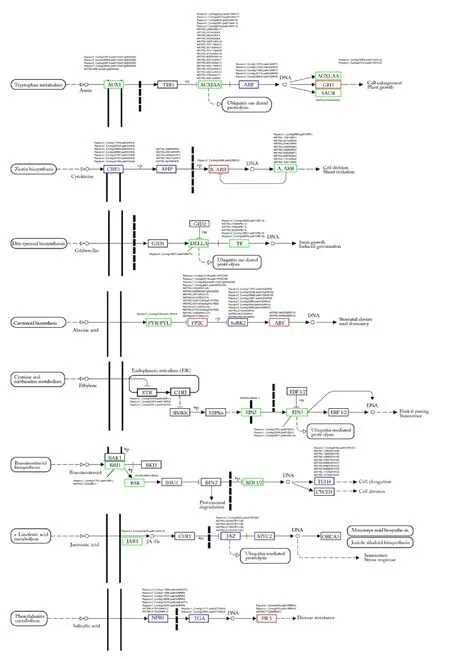
图5 燕麦激素信号转导相关 DEGs 表达模式
细胞分裂素信号转导富集23个DEGs,7个CRE1,其中 5个下调,2个上调;5个AHP,其中4个下调,1个上调。1个B-ARR上调和10个A-ARR下调。CRE1基因Pepsico1_Contig30644.path2(HK3)和Pepsico1_Contig17818.path2(HK3)表达量较高。
赤霉素信号转导富集7个DEGs,包括1个DELLA和6个TF,均下调,所有DEGs表达量均不高。
脱落酸信号转导富集27个DEGs,23个上调,4个下调。1个PYL下调,14个PP2C上调,10个SnRK2,3个下调,7个上调, 2个ABF上调,ABF基因Pepsico1_Contig22851.path2(SAPK8)和Pepsico1_Contig11915.path2(SAPK8)表达量较高。
乙烯信号转导富集8个DEGs,其中7个下调,1个上调。3个ETR,其中2个下调,1个上调,1个EIN2下调,4个EIN3下调。Pepsico1_Contig16364.path2(ERS1)和Pepsico1_Contig30011.path2(EIL1A)表达量较高。
油菜素甾醇信号转导富集14个DEGs,11个下调,3个上调。2个BRI1、1个BSK、1个BZR1/2均下调,10个TCH4,其中7个下调,3个上调,MSTRG.60886(XTH22)表达量较高。
茉莉酸信号转导富集6个DEGs,2个下调,4个上调。1个JAR1下调,5个JAZ1,其中1个下调,4个上调,表达量均不高。
水杨酸信号转导富集14个DEGs,其中8个下调,6个上调。8个NPR1,其中7个下调,1个上调,4个PR-1均上调,2个TGA,1个上调,1个下调。 Pepsico1_Contig13131.path2(TGAL6)和Pepsico1_Contig23941.path1(TGAL6)表达量较高。
2.3 EGs的qRT-PCR验证
Pepsico1_Contig2520.path2(ARF,ADP核糖基化因子)、Pepsico2_Contig10105.path1(GH3.5,茉莉酸-酰胺合成酶JAR1亚型X2)、Pepsico2_Contig12697.path1(MPK6, 丝裂原活化蛋白激酶)、Pepsico1_Contig 30614.path1(ACX1,过氧化物酶体酰基辅酶A氧化酶1异构体X1)、Pepsico1_Contig24949.path1(GID1,赤霉素不敏感基因dwarf 1)、Pepsico2_ Contig 11866. path1(MFP2,乙二醛脂肪酸β-氧化多功能蛋白MFP-a异构体X1)和Pepsico1_Contig26945.path2(EBF2,EIN3结合F-box蛋白)在重度干旱胁迫下均显著上调,Pepsico2_Contig15385.path1(BZR2,油菜素内酯信号转导的核心转录因子)显著低于轻度干旱胁迫和对照,转录组测序和qRT-PCR基因表达变化一致(表2)。
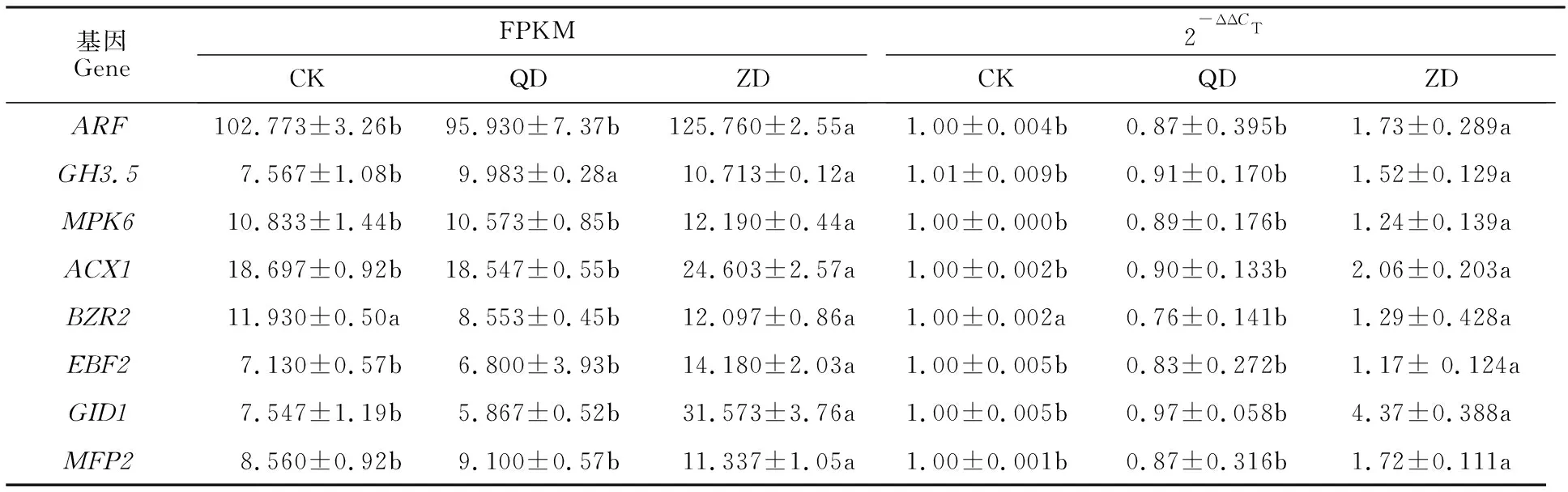
表2 8个基因的实时定量 PCR 和 RNA-seq 结果Table 2 Real-time quantitative PCR and RNA-seq analysis of the eight genes
3 讨论
与CK相比,重度干旱胁迫燕麦叶片核糖含量增加5.78%,蔗糖含量增加83.08%,差异显著(P<0.05,下同);内源酸性激素ABA、JA和SA含量显著升高,IAA含量显著降低[12],轻度干旱胁迫变化不显著。本研究表明轻度干旱胁迫没有显著富集的代谢通路,植物激素信号转导途径富集7个DEGs,其中ARF和CRE1表达量较高;重度干旱胁迫下有24条代谢途径显著富集,环境信号过程只有植物激素信号转导途径显著富集DEGs,说明转录组表现和生理表现一致。
内源激素是对外界环境刺激变化最显著的途径,本研究表明在重度干旱胁迫下,IAA信号转导通路和ABA信号通路富集较多的DEGs,分别占激素信号转导通路总DEGs的20.7%和15.9%,茉莉酸信号转导中富集较少的DEGs,表达量低。IAA信号转导通路中生长素反应因子(ARFs)是一种转录因子,通过与其启动子区域的生长素反应元件(Aux REs)结合,激活或抑制初级/早期生长素反应基因的表达[21]。CaARFs的转录谱揭示了它们在辣椒幼苗下胚轴插条不定根中的作用[22]。本研究发现在轻度干旱胁迫下,生长素信号转导中ARF基因Pepsico1_Contig30676.path1(ARF9)下调,表达量较高;该基因在重度干旱胁迫下发生变化同轻度干旱胁迫;重度干旱胁迫下Pepsico1_Contig 15350.path2(ARF9)表达上调,可能为该通路中响应干旱胁迫的关键基因。
关于ABA的信号转导通路对非生物胁迫的研究已有较多的报道,本研究发现燕麦在重度干旱胁迫下,ABA信号转导通路共富集27个DEGs,主要为PP2C和SnRK2。PP2Cs(2C type protein phosphatases)是一种单体丝氨酸/苏氨酸蛋白磷酸酶,在真核生物中,PP2Cs在ABA、JA、SA等激素信号传导途径中起着重要的调控作用[23]。对花生中35个受盐胁迫诱导表达的PP2C研究发现,绝大多数PP2C基因的启动子存在多种胁迫响应元件,如与干旱诱导相关的MYB转录因子结合[24]。从小麦中克隆了第一个PP2C基因TaPP2C59,实时荧光定量PCR分析表明,该基因的表达显著受ABA、低温和高盐胁迫抑制,因此,胡 伟等[25]推测TaPP2C59可能作为负调控因子参与ABA信号及非生物逆境胁迫应答。本研究发现在重度干旱胁迫下14个PP2C基因表达均显著上调,其中MSTRG.2451(PP2C51)表达量相对高。SnRK2是ABA信号转导途径中的正调控因子,广泛参与了植物的生长发育和非生物胁迫等多种信号的应答反应,从番茄中分离了3个SnRK2基因,并进行克隆验证,发现转基因植株呈叶片早衰的现象[26]。本研究表明重度干旱胁迫下,燕麦ABA信号转导途径10个SnRK2显著富集,其中Pepsico1_Contig22851. path2(SAPK8)和Pepsico1_ Contig11915. path2(SAPK8)基因表达显著上调,且表达量较高。ABF(ABRE binding factors)转录因子是能够特异识别ABA响应元件(ABA-responsive element,ABRE)的一类碱性亮氨酸拉链蛋白,参与调控ABA响应基因的表达,在植物响应非生物胁迫的过程中具有重要作用[27]。转录因子基因SiABF3在干旱胁迫初期的快速表达可能与谷子抗旱性有着紧密的联系[28]。 本研究表明,在重度干旱胁迫下,2个ABF表达上调,但表达量较小。 因此认为 2个SnRK2为响应重度干旱胁迫的关键基因。
细胞分裂素在植物生长发育和抵御环境胁迫过程中均扮演着重要的角色,其信号是由细胞分裂素受体组氨酸激酶、组氨酸磷酸转运蛋白(HPs)以及反应调节因子组成的复杂的双元组分系统进行传递的[29]。CRE1是细胞分裂素受体,本研究表明,轻度干旱胁迫下,2个CRE1基因表达下调,表达量较高,可能为响应轻度干旱胁迫关键基因;重度干旱胁迫下,7个CRE1和5个AHP表达发生显著变化,其中2个CRE1基因Pepsico1 _Contig30644.path2(HK3)和Pepsico1_Contig17818. path2(HK3)表达上调,且表达量较高,可能为该信号转导通路中响应重度干旱胁迫的关键基因。
当油菜素甾醇存在时,其可与BRI1和BAK1的胞外结构域结合,激活后的BRI1磷酸化激活BSKs,BSKs通过蛋白互作激活BSU1,激活的BSU1可去磷酸化失活负调元件BIN2, 从而解除BIN2对下游转录因子BZR1的磷酸化抑制,非磷酸化的BZR1进入细胞核调控[30]。本研究表明重度干旱胁迫下,该通路中的4个基因均显著下调。At XTH23的缺失赋予了拟南芥植株抗冷性、干旱及ABA敏感性,而在突变体Atxth23中恢复表达大豆同源基因Gm XTH22后的恢复植株可以缓解突变体拟南芥的这些响应胁迫的表型[31]。本研究发现,重度干旱胁迫下,10个TCH4基因表达发生显著变化,其中MSTRG.60886(XTH22)表达最高。
番茄PR-1和PR-5基因主要在衰老叶片、B期果实和根部表达,干旱抑制了这两个基因的表达,复水和乙烯诱导其表达[32]。本研究发现在重度干旱胁迫下8个NPR1发生显著变化,其中7个表达下调;重度干旱胁迫下4个PR-1表达均显著上调。HAC和NPR1形成一个共激活复合物,并在SA信号后通过TGAs被招募到PR染色质,最后HAC-NPR1-TGA复合物通过组蛋白乙酰化介导的表观遗传重编程激活PR转录[33]。本研究发现在重度干旱胁迫下 2个TGA,Pepsico1_ Contig13131.path2(TGAL6)和Pepsico1_Contig 23941. path1(TGAL6)表达量较NPR1和PR-1高,因此认为上述2个基因可能为该通路响应重度干旱胁迫的关键基因。
ET是植物生理的关键元素,因此ET的研究对基础研究和农业都具有重要意义[34]。克隆芒果乙烯受体ETR1和ERS1基因(Mi ETR1和Mi ERS1),并进行生物信息学分析,结果表明ET受体在芒果成熟和衰老过程中发挥调控作用[35]。ET信号通路转录因子EIL1能够阻碍生长素从果柄向子房运输,授粉受精或下调表达EIL1均能解除这种阻碍,提高子房IAA水平,形成果实[36]。在突变体中,EIL1基因显著表达,ET含量增加,影响部分根区干燥下ABA 信号传导[37]。本研究发现重度干旱胁迫诱导燕麦ET信号转导中ETR基因Pepsico1_ Contig16364.path2(ERS1)表达显著上调,EIN3基因Pepsico1_Contig30011.path2(EIL1A)表达显著下调,且上述2个基因表达量较高,可能为响应重度干旱的关键基因。
4 结论
本研究分析了干旱胁迫对燕麦转录组的影响,轻度干旱胁迫下,所有代谢通路没有发生显著变化,而重度干旱胁迫下,24条代谢通路显著富集DEDs,其中环境信息过程只有1个代谢途径显著变化,为植物激素信号转导通路,其中以IAA和ABA信号转导通路表达显著变化的基因数量较多,在重度干旱胁迫下,筛选出表达量较高的基因12个,分别为Pepsico1_Contig30676.path1、Pepsico1_Contig15350.path2、MSTRG.2451(PP2C51)、Pepsico1_Contig22851.path2(SAPK8)、Pepsico1_Contig11915.path2(SAPK8)、Pepsico1_Contig30644.path2(HK3)、Pepsico1_Contig17818.path2(HK3),MSTRG.60886(XTH22)、Pepsico1_Contig13131.path2、Pepsico1_Contig23941.path1(TGAL6)、Pepsico1_Contig16364.path2(ERS1)和Pepsico1_Contig30011.path2(EIL1A),可能为植物信号转导通路响应干旱胁迫的关键基因。

