放线菌剂使用方法对晚播冬小麦生长及光合性状的影响
张东旭,胡丹珠,闫金龙,冯丽云,邬志远,杨斌,李岩华,张俊灵
(1.山西农业大学谷子研究所,山西长治 046011;2.黄土高原特色作物优质高效生产省部共建协同创新中心,山西太谷 030800;3.山西农业大学小麦研究所,山西临汾 041000)
小麦是我国主要粮食作物之一,其产量丰欠关系到国家粮食安全和社会稳定[1-2]。山西小麦种植历史悠久,其消费量因为丰富的面食文化远大于其他粮食作物,占粮食消费总量的56.5%,但由于生态条件、种植制度等因素的限制,山西小麦平均产量远低于全国平均水平,总产远不能满足自身需求,供需矛盾突出。近年来,随着气候变化和种植制度的改革,小麦复播技术大面积推广应用,但由于极端气候变化和经营主体劳动力紧缺等原因,小麦茬口变晚、播种推迟的现象时常出现。晚播对冬小麦的幼穗分化、穗部性状、农艺性状、产量等方面均有不同程度的影响[3-4],对小麦高产非常不利。为减少晚播小麦带来的产量损失,生产中往往加大化肥的施用量,盲目过量施用化肥导致肥料利用效率大幅降低,造成土壤板结及肥力下降、土壤生物多样性减少、土壤和地下水污染等严重的环境问题[5-8]。因此,如何采用科学合理的方法,在改善土壤现状、提高土壤质量的基础上,充分提高此类小麦的抗逆性能,促进小麦自身生长发育,实现绿色与高效协同发展越来越受到广泛关注。
植物根际促生菌(PGPR)是对植物生长有促进或对病原菌有拮抗作用的有益微生物统称。近年来,有关PGPR的研究日益受到人们的关注,澳大利亚、美国、欧共体组织和日本等国家都开展了PGPR专项研究。PGPR协助寄主抗逆是近期研究的热点,国外对PGPR协助小麦抗逆的研究主要集中在抗盐胁迫、高温等方面,其中尤以抗盐胁迫最多。研究表明,部分植物根际促生菌不仅对寄主植物具有促生作用,也能够协助寄主植物抵御干旱、盐胁迫等非生物胁迫[9-11]。国内研究人员对烟草研究发现,PGPR可通过诱导脯氨酸等渗透调节物质在烟草中的积累来降低水势,维持根系从土壤吸水的水势差,并且这种诱导能力一般具有特异性,需要干旱胁迫与PGPR的双重诱导[12]。在遭受干旱胁迫时大量活性氧会在小黑麦植株体内产生,并对膜结构造成损伤,而接种PGPR可以提高寄主过氧化氢酶、抗坏血酸氧化酶、超氧化物歧化酶等抗氧化酶活性[13],以减轻过氧化对植株的危害。木霉与青霉菌剂与土壤按一定比例混合时,对小麦生长有良好的促进作用,在贫瘠土壤中仍可促进小麦株高及叶绿素含量的提高[14]。放线菌作为土壤中三大类群微生物之一,在促进植物生长、减轻作物病害和增强植物抗逆性等方面发挥着重要的作用[15]。采用适宜浓度的放线菌剂进行种子包衣对小麦生育前期生物学特性影响显著,能提高小麦叶片酶活性与光合能力,加速小麦穗分化进程,通过增加穗粒数提高小麦产量[16]。目前关于放线菌剂在作物上的使用方法多为种子包衣,少见放线菌剂不同使用方法对作物生长影响的报道,尤其是在晚播小麦上尚未见相关文献。本研究选用娄彻氏链霉菌(Streptomycesroche,D74)的放线菌剂,通过对晚播小麦种子包衣、在小麦生长的不同时期进行叶面喷施等方法,比较分析放线菌剂不同使用方法对晚播小麦产量和生理性状的影响,以期为放线菌剂在小麦生产中的科学使用以及晚播小麦高产栽培提供参考。
1 材料与方法
1.1 试验区概况
田间试验于2021-2022年在山西农业大学谷子研究所小麦试验基地进行。试验地点位于36°12′N、113°8′E,海拔926.5 m。试验地为多年雨养旱地,未实施过人工灌溉,土壤类型为壤土,土壤0~20 cm耕层有机质、速效氮、速效磷和速效钾含量分别为28.6 g·kg-1、126 mg·kg-1、17.2 mg·kg-1和251 mg·kg-1。小麦生育期年平均降水量302.7 mm,本年度降水量597.1 mm,仅2021年9月、10月降水量就达451.7 mm,详情如图1所示,罕见秋汛致使本年度小麦播种较往年适播期晚播近一个月。

图1 2021-2022年度小麦生长期降水量
1.2 试验设计
供试品种为长6990,由本课题组选育提供。供试放线菌剂为娄彻氏链霉菌D74,由山西农业大学小麦研究所提供。D74菌剂中的有效活菌数为3.5×1010cfu·g-1,菌剂按种子质量的5%用量对小麦种子进行包衣,菌剂发酵液按6 000 mL·hm-2,稀释200倍在小麦花后不同时期的傍晚进行叶面喷施。试验共设5个处理,分别为T1(种子包衣+拔节期、灌浆期喷施D74菌剂)、T2(种子包衣+拔节期喷施D74菌剂,灌浆期喷施清水)、T3(种子包衣+拔节期、灌浆期喷施清水)、T4(种子不包衣+拔节期、灌浆期喷施D74菌剂)和CK(种子不包衣+拔节期、灌浆期喷施清水)。试验田前茬为小麦,收获后深耕一次,播前旋耕二次和耙耢一次,播前一次性施入复合肥(N-P2O5-K2O:20-15-10)915 kg·hm-2。试验于2021年10月25日进行播种,随机区组排列,三次重复,小区面积37 m2(2 m×18.5 m),行距20 cm,采用转盘式精密播种机播种。
1.3 测定项目与方法
1.3.1 产量与表型性状
每小区标记代表性样点2个,在苗期、分蘖期和成熟前期调查基本苗、最高总茎数、成穗数,收获前每小区在样点内取样20株调查株高、穗长、穗粒数、千粒重,小区全部收割,晒干后测其产量。
1.3.2 光合速率测定
采用CIRAS-2光合速率仪(PP SYSTEMS,美国)于晴天上午9:00-11:00测定旗叶的光合速率(Pn),每小区测定3片旗叶,取其均值用于统计分析。
1.3.3 旗叶叶绿素含量、氮含量测定
使用便携式植物营养测定仪于晴天上午9:00-11:00 对小麦旗叶(从叶尖起1/3部位)进行叶绿素含量、氮含量测定,每小区测定5片旗叶,取其均值用于统计分析。
1.3.4 群体叶面积指数(LAI)测定
使用SunScan植物冠层分析仪(DELTA-T,英国)分别在灌浆期不同时期测定LAI值。测定时,探杆位于小麦根部,并保持镜头水平不动,同时尽量避免太阳光直射,每小区测定3个样点,取其均值用于统计分析。
1.3.5 干物质积累与运转相关指标测定
于开花后0 d(开花期)、7 d、14 d、21 d、28 d、35 d和成熟期,每个小区分别取20个单茎,105 ℃杀青,80 ℃烘干至恒重后称干重。按公式计算如下各指标:
花前贮存干物质转运量=开花期干重-成熟期营养器官干重;
花前干物质转运量对籽粒产量的贡献率=花前储藏干物质转运量/成熟期籽粒干重×100%;
花后干物质积累量=成熟期总干重-开花期干重;
花后干物质积累对籽粒产量的贡献率=花后干物质积累量/成熟期籽粒干重×100%。
1.4 数据分析
采用Excel2010和SPSS19.0进行数据整理和统计分析。
2 结果与分析
2.1 放线菌剂使用方法对晚播小麦群体数量、产量及构成要素的影响
从表1可以看出,使用放线菌剂对晚播小麦的基本苗、最高茎数、成穗数和成穗率均有显著的影响。CK和T4处理的晚播小麦基本苗数均显著高于T1、T2、T3处理,在CK与T4处理之间及T1、T2、T3处理之间差异均不显著。最高茎数、成穗数也表现出类似的趋势,其中T4处理的穗数最高,与CK差异显著,与其他处理差异不显著。成穗率则表现为T1、T2、T3、T4处理高于CK,其中T4与CK差异显著。这说明放线菌剂种子包衣抑制了晚播小麦出苗,降低群体起点,虽后期群体调节能够提高成穗率,但总体对群体数量有一定的负效应,而拔节期和灌浆期叶面喷施放线菌剂不仅出苗好,还会显著增加穗数。

表1 放线菌剂不同使用方法对晚播小麦产量及其构成要素的影响Table 1 Effects of different application methods of actinomycetes on yield and its components of late-sown wheat

表2 放线菌剂不同使用方法对晚播小麦干物质积累与运转的影响Table 2 Effects of different application methods of actinomycetes on dry matter accumulation and translocation of late-sown wheat
使用放线菌剂对晚播小麦株高影响不显著,但显著影响穗长、穗粒数、千粒重及产量。T1、T4处理的穗长、穗粒数及千粒重均显著高于CK,T2处理的穗粒数、千粒重也显著高于CK,T3处理与CK间无显著差异。使用放线菌剂对晚播小麦增产效应显著,T1~T4处理产量较CK分别增加17.65%、14.71%、7.35%和25.0%,其中T1和T4处理与CK差异显著,T1与T4处理间及T3处理与CK间差异均不显著。这说明使用放线菌剂种子包衣对晚播小麦的穗发育及产量无明显影响,而叶面喷施放线菌剂可促进晚播小麦穗发育,增加穗粒数和粒重,提高产量,其中拔节期和灌浆期叶面喷施放线菌剂效果明显。
2.2 放线菌剂不同使用方法对晚播小麦旗叶净光合速率(Pn)的影响
花后0~7 d,不同处理之间晚播小麦旗叶Pn没有显著差异(图2)。花后14 d,T1处理的Pn显著高于CK,增幅13.24%,其余处理与CK差异均不显著。花后21 d,所有处理的Pn开始大幅度下降,且不同处理间无显著差异。花后28 d,T1~T4处理的Pn均显著高于CK,增幅分别为50.72%、28.26%、26.09%和54.35%。花后35 d,T1和T4处理的Pn均显著高于CK,增幅分别为69.57%和68.12%,其余处理与CK差异不显著。由此可见,使用放线菌剂能够使晚播小麦旗叶光合能力在灌浆后期保持较高水平,其中使用放线菌剂种子包衣和仅拔节期叶面喷施的效果较弱,而拔节期和灌浆期叶面喷施放线菌剂的效果较明显。
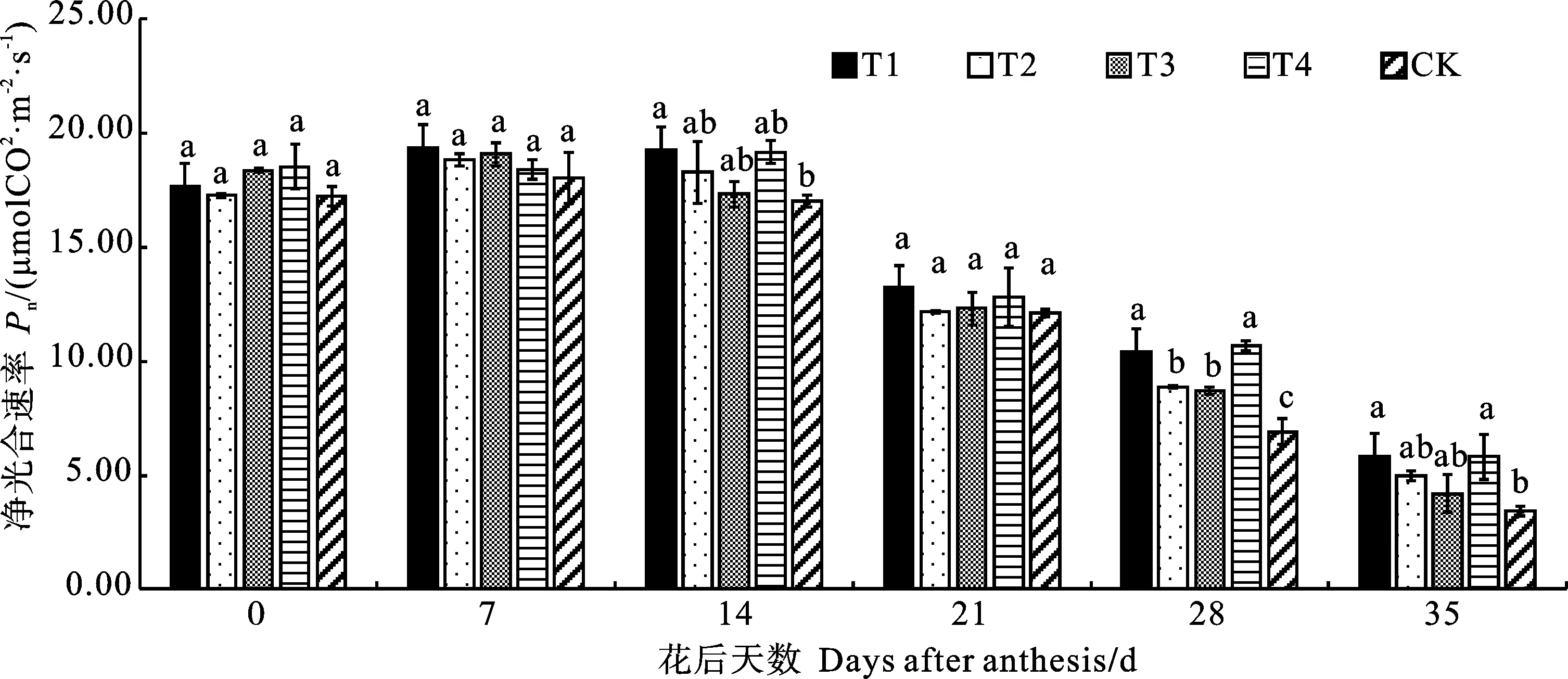
图中不同小写字母表示同一生育时期各处理间在 0.05 水平上差异显著。下图同
2.4 放线菌剂不同使用方法对晚播小麦旗叶叶绿素相对含量(SPAD值)和氮含量的影响
花后0~21 d,不同处理处理间晚播小麦旗叶SPAD值和氮含量均无显著差异(图3、图4)。花后28和35 d,各处理的SPAD值和氮含量均快速下降,T1、T2、T3、T4处理的SPAD值和氮含量均显著高于CK。其中,花后28 d,T1、T2、T3、T4处理的SPAD值增幅分别为54.02%、49.89%、34.25%和55.17%,氮含量增幅分别为50.00%、46.17% 31.70%和51.06%;花后35 d的SPAD值增幅分别为47.08%、38.52%、25.68%和43.97%,氮含量增幅分别为41.44%、33.90% 、22.60%和38.70%。由此表明,使用放线菌剂能够提高晚播小麦旗叶灌浆后期的叶绿素和氮素含量,减缓叶片衰老,有利于光合作用,其中叶面喷施放线菌剂的效果更好。

图3 不同处理下小麦花后不同时期的旗叶SPAD值
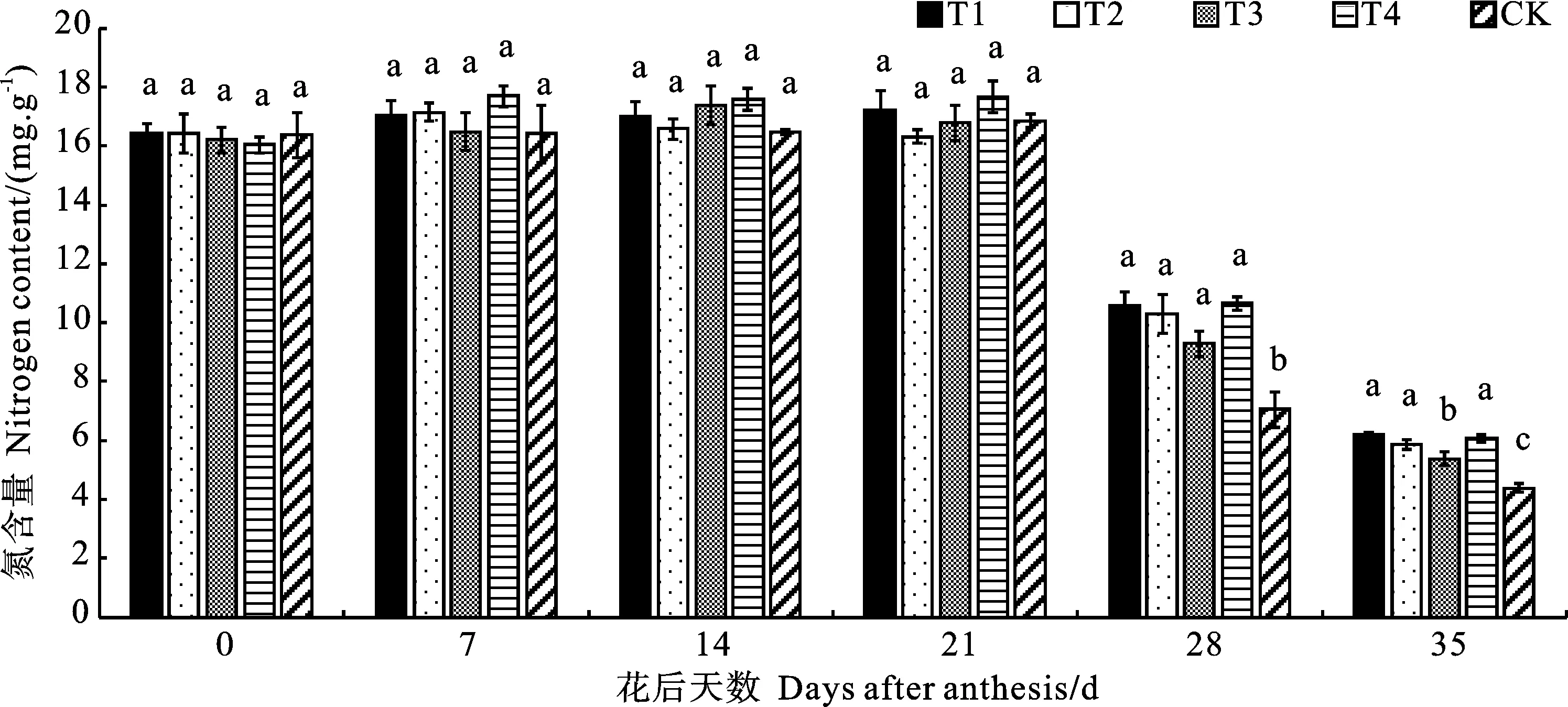
图4 不同处理下小麦花后不同时期的旗叶氮含量
2.5 放线菌剂不同使用方法对晚播小麦叶面积指数(LAI)的影响
晚播小麦LAI在花后0~21 d保持相对稳定,之后快速下降(图5)。使用放线菌剂显著影响晚播小麦花后21~35 d的LAI。花后0~14 d不同处理间LAI无显著差异;花后21 d,T4处理的LAI显著高于CK,增幅13.54%,其他处理与CK间无显著差异;花后28、35 d,T1、T2、T4处理的LAI均显著高于CK,花后28 d增幅分别为41.67%、25.00%和44.44%,花后35 d增幅分别为52.94%、41.18%和58.82%,T3处理在花后28 d的LAI也显著高于CK,增幅22.22%。这说明使用放线菌剂能够使晚播小麦在灌浆中后期保持较大的光合面积,有利于光合作用,其中叶面喷施放线菌剂的作用更突出。

图5 不同处理下小麦花后不同时期的叶面积指数(LAI)
2.5 放线菌剂使用方法对晚播小麦干物质积累与转运的影响
各处理晚播小麦灌浆期间的干物质积累量均呈上升趋势(图6)。使用放线菌剂显著影响花后各时期晚播小麦的干物质积累量。花后0~35 d,T4处理的干物质积累量较CK均显著提高,增幅分别为3.36%、5.92%、6.34%、9.21%、9.17%和11.59%;T1处理在花后21~35 d才显著高于CK,增幅分别为4.82%、5.08%和6.35%; T2处理仅在花后35 d显著高于CK,增幅为4.91%;T3处理在花后0~35 d与CK差异均不显著。由此说明,使用放线菌剂种子包衣对晚播小麦干物质积累无明显影响,而叶面喷施放线菌剂可促进晚播小麦干物质积累,其中拔节期和灌浆期叶面喷施效果较明显。

图6 不同处理下小麦花后不同时期的干物质积累量
使用放线菌剂对晚播小麦的花前干物质转运量及其对籽粒产量的贡献率、花后干物质对籽粒产量的贡献率影响均不显著,对花后干物质积累量有显著正向效应。在使用放线菌剂处理中,T1、T2和T4处理较CK显著增加,增幅分别为37.93%、29.42%和50.92%,而T3处理与CK差异不显著。这进一步说明使用放线菌剂可促进晚播小麦的花后干物质积累,有利于产量形成,其中放线菌剂种子包衣效果不明显,而叶面喷施放线菌剂效果明显。
3 讨论
3.1 放线菌剂不同使用方法对晚播小麦产量的影响
放线菌是一类革兰氏阳性、高(G + C)含量(>55%)的细菌,在自然界中分布广泛,能够产生多种次生性代谢物质,对于植物促生、增产、提质、防病有重要意义[17-20]。研究表明,增施放线菌能促进甜瓜、樱桃、生菜、番茄等植物的生长[21-25]。放线菌ZZ-9发酵液与腐植酸钠混施,能够显著增加小麦株高、根长以及PLA、PPO活性和叶绿素含量,对小麦具有非常好的促生效果[26]。通过用D74放线菌剂对小麦进行接种或种子包衣试验证实,放线菌剂可提高小麦苗期叶片酶活力,能加速小麦穗分化过程[16,27]。本研究发现,在大田条件下,使用放线菌剂可使晚播小麦增产7.35%~25.00%,且产量结果表现为T4>T1>T2>T3>CK,其中T1和T4处理增产效果显著,表明叶面喷施放线菌剂对晚播小麦的增产效果优于使用放线菌剂种子包衣,其中拔节期和灌浆期叶面喷施放线菌剂的效果明显。原因可能是由于本年度播前降水较多,土壤板结透气性差,且因播种太迟,气温下降,放线菌随种子包衣施入土壤,供氧量不足及低温抑制了放线菌的活性与繁殖,未能有效发挥菌剂的功能,而叶面喷施放线菌剂能够通过作物直接吸收,避免了土壤的抑制,充分发挥其促生、抗逆等功效。由此可见,放线菌对小麦的生长发育及产量有积极的作用,但受环境、土壤条件、使用方法及与作物的亲和性等多种因素的影响,要想达到理想的效果,需根据实际情况选用正确的使用方法及技巧。
3.2 放线菌剂不同使用方法对晚播小麦群体结构和干物质积累的影响
合理的群、个体结构是小麦高产的基础。晚播条件下,温度等因素会影响小麦分蘖,导致单株分蘖数减少,影响有效穗数[28]。在群体较少时,合理运用调控手段,通过增强个体发育,进一步挖掘群体生产力,是实现晚播小麦高产的主要途径。研究表明,通过提高小麦单穗质量与结实率可增加产量[29]。本研究中,使用放线菌剂对晚播小麦的群体有显著影响,T4处理和CK的基本苗、最高总茎数和穗数相对较高,而T1、T2、T3处理相对较低,且在基本苗、最高总茎数上T4处理与CK间及T1~T3处理间均差异不显著;成穗数和成穗率仅T4处理显著高于CK,其余处理间也无显著差异。在个体发育方面,使用放线菌剂叶面喷施的T1、T2和T4处理穗粒数和千粒重都要显著高于CK,而仅使用放线菌剂种子包衣的T3处理的穗长、穗粒数和千粒重与CK间均无显著差异。小麦产量形成实质上是光合产物的积累及向籽粒的运转和分配的过程。花前干物质积累对小麦产量有一定的贡献,但小麦产量的高低往往主要取决于花后干物质的积累和转移[30]。本研究中,使用放线菌剂对晚播小麦花前干物质转运量及其对籽粒产量的贡献率以及花后干物质积累的贡献率均无显著影响,但对小麦的花后干物质积累具有促进效应,且同样表现为T4处理效果最好,其次是T1和T2处理,而T3处理效果不明显。这表明,使用放线菌剂种子包衣对晚播小麦的群体有一定的负效应,对个体发育也无明显的促进作用,而叶面喷施放线菌剂可促进晚播小麦分蘖成穗和花后干物质积累,提高穗数、穗粒数和千粒重,从而实现晚播小麦高产,其中拔节期和灌浆期叶面喷施放线菌剂效果最好。
3.3 放线菌剂不同使用方法对晚播小麦光合特性和冠层结构的影响
叶片净光合速率、叶绿素含量和LAI可反映了作物植株光合能力[31-34]。研究发现,在灌浆初期,链霉菌包衣可显著提高小麦旗叶的净光合速率[16]。本研究中,使用放线菌剂对晚播小麦旗叶净光合速率和叶绿素含量及LAI的影响主要表现在灌浆中后期,T1~T4处理的三个指标在灌浆前期与CK差异不明显,并保持稳定,在灌浆后期相较于CK下降缓慢,保持了较高水平,其中T4处理均最高,且与CK显著,其次是T1和T2处理,表明使用放线菌剂能够延缓晚播小麦灌浆后期功能叶片衰老,扩大光合面积和提高光合能力,促进小麦生育后期同化物生产和积累,说明放线菌剂种子包衣的效果不明显,而叶面喷施放线菌剂的效果较佳。
4 结论
使用放线菌剂能够有效增加晚播小麦的光合持续能力,延缓叶片衰老,促进花后干物质积累和穗部发育,增加穗数、穗粒数和千粒重,进而提高产量,但影响程度在不同使用方法间存在差异。本试验条件下,放线菌剂种子包衣效果不明显,叶面喷施放线菌剂效果较突出,其中拔节期和灌浆期叶面喷施放线菌剂的效果最佳。

