建构模型 突破原电池问题
■湖北省英山县长冲高级中学 张进华
原电池和化学电源是化学学科核心知识,也是高频考点。它侧重考查原电池工作原理、电极判断、电极反应式和总反应方程式的书写、电流(或电子流动)方向、离子移动方向、根据反应式进行相关化学计算等。原电池和化学电源考题常以社会生活和科技前沿等热点问题为背景,题目图表符号多,信息丰富,命题往往“源于教材而又高于教材”,要求考生有较强的陌生情境下信息获取能力和分析解决问题能力,从而成为考生学习和考试的一个难点。那么如何学好原电池和化学电源知识,这里笔者从化学学科五大核心素养中的“证据推理与模型认识 ” 角度进行初步探究。
模块一:建立模型认知
1.原电池建模。
原电池是一种将化学能转变为电能的装置。其实质是依据一定条件,将氧化还原反应中还原剂失去的电子经过导线传给氧化剂,使氧化反应和还原反应分别在负、正两极进行。形成条件有:①有两种活泼性不同的金属(或一种是非金属导体)作电极;②有电解质溶液(一般与活泼的电极发生自发的氧化还原反应);③形成闭合回路。
2.从电极的角度认知原电池模型。
(1)电极:较活泼的金属为负极,较不活泼的金属(或非金属导体)为正极。
(2)反应:负极发生氧化反应,正极发生还原反应。
(3)电子:电子流出(电流流入)的为负极,电子流入(电流流出)的为正极。正、负极通过的电子的量相等(电子守恒)。电子只能在导线中流动,不能在电解质溶液里流动(电子不下水)。
(4)离子:原电池工作时阳离子向正极运动,阴离子向负极运动。
(5)介质:在酸性介质的电极反应式中不出现OH-,在碱性介质的电极反应式中不能有H+出现。
模块二:典例讲解
例1根据反应2Ag++Cu══Cu2++2Ag,设计如下页图1所示原电池,下列说法错误的是( )。
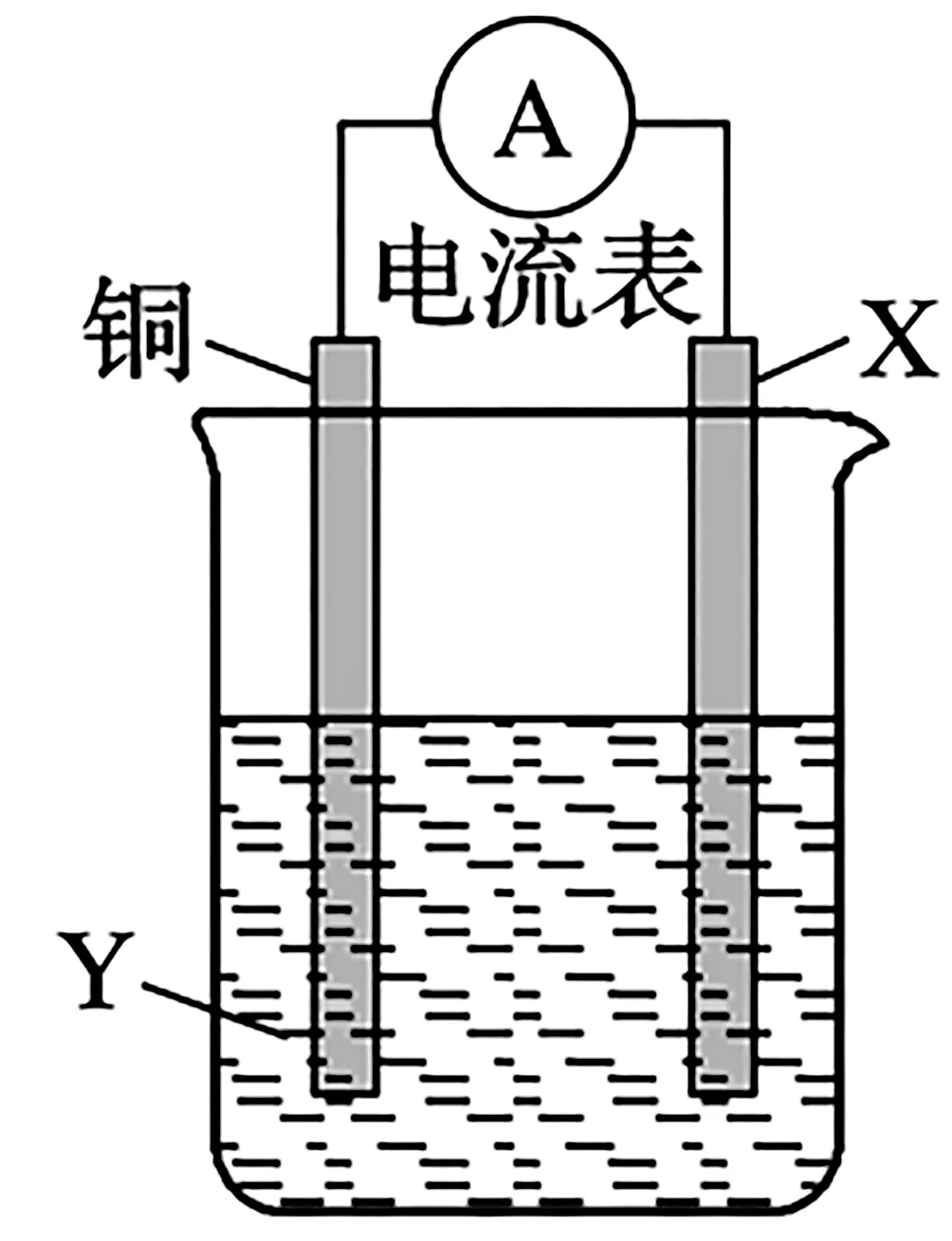
图1
A.X 可以是银或石墨
B.Y 是硫酸铜溶液
C.电子从铜电极经外电路流向X 电极
D.X 极上的电极反应式为Ag++e-══Ag
解析:由电池反应2Ag++Cu══2Ag+Cu2+可知,铜作负极,电极反应为Cu-2e-══Cu2+;X 为正极,可以是比铜不活泼的银或石墨等,电极反应为Ag++e-══Ag。电解质溶液中需含有Ag+,故B项说法错误。
答案:B
例2一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O ══CH3COOH+4H+。下列有关说法正确的是( )。
A.检测时,电解质溶液中的H+向负极移动
B.若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气
C.电 池 反 应 的 化 学 方 程 式 为CH3CH2OH+O2══CH3COOH+H2O
D.正极上发生的反应为O2+4e-+2H2O ══4OH-
解析:在原电池中,阳离子要往正极移动,故A 项错误。因电解质溶液是酸性的,不可能存在OH-,故正极的反应式为O2+4H++4e-══2H2O,D 项错误。转移4 mol电子时消耗 1 mol O2,则转移0.4 mol电子时消耗2.24 L 标准状况O2,故B 项错误。电池反应式即正、负极反应式之和,将两极的反应式相加可得CH3CH2OH + O2══CH3COOH+H2O,故C项正确。
答案:C
例3一种熔融碳酸盐燃料电池原理示图2所示。下列有关该电池的说法正确的是( )。
B.电极A 上H2参与的电极反应为H2+2OH--2e-══2H2O
D.电极B 上发生的电极反应为O2+
解析:A 项则该反应中每消耗1 mol CH4转移6 mol电子,错误。B 项,该电池的传导介质为熔融的碳酸盐,所以A电极即负极上H2参与的电极反应为H2-,错误。C 项,原电池工作时,阴离子移向负极,而B 极是正极,错误。D 项,B 电极即正极上O2参与的电极反应为正确。
答案:D
例4微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图3所示。下列有关微生物电池的说法错误的是( )。
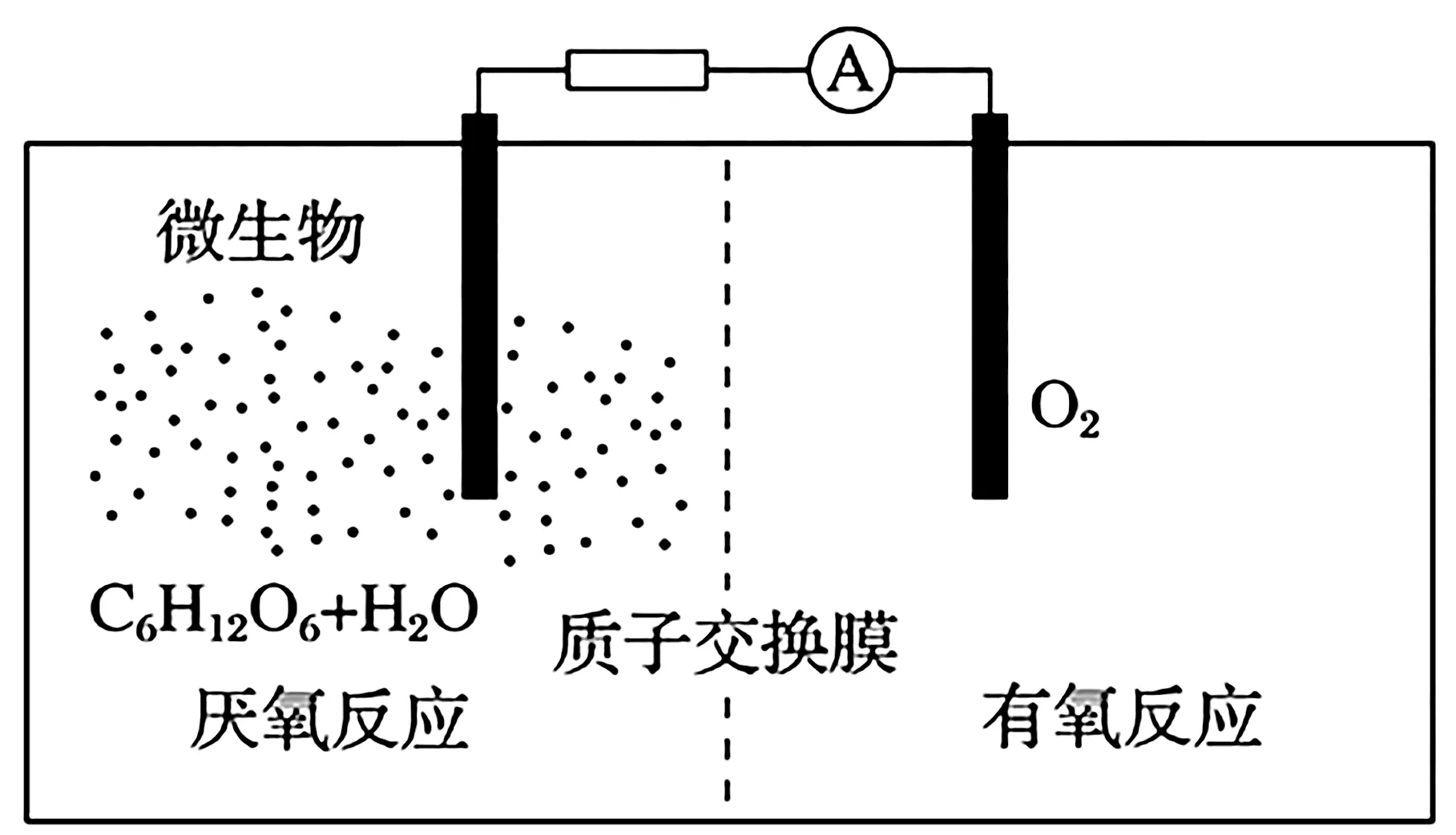
图3
A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2══6CO2+6H2O
解析:由题意可知,氧气在正极反应,由于质子交换膜只允许H+通过,则正极反应为O2+4e-+4H+══2H2O,正极没有CO2生成,A 项错误。微生物电池的原理是在微生物作用下O2与C6H12O6发生氧化还原反应,将化学能转化为电能,B 项正确。负极发生反应C6H12O6-24e-+6H2O ══6CO2+24H+,H+在负极区生成,移向正极区,在正极被消耗,C 项正确。电池总反应为C6H12O6+6O2══6CO2+6H2O,D 项正确。
答案:A
例5酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是由碳粉、MnO2、ZnCl2和NH4Cl等组成的糊状填充物。该电池放电过程产生MnOOH。
(1)该电池的正极反应式为_____,电池反应的离子方程式为_____。
(2)维持电流强度为0.5 A,电池工作5 min,理论上消耗锌____g。(已知F=96 500 C·mol-1)
解析:(1)根据酸性锌锰干电池的构造可知,放电时,负极Zn 失去电子生成Zn2+,正极MnO2得到电子生成MnOOH,从而可写出正极和负极的电极反应式,然后在遵循电子守恒的前提下将两极反应式加合可得电池反应的离子方程式。
(2)电池工作5 min,通过的电量Q=0.5 A×5 min×60 s·min-1=150 C,因此通过电子的物质的量
答案:(1)MnO2+e-+H+══MnOOH
Zn+2MnO2+2H+══Zn2++2MnOOH
(2)0.05
模块三:训练与提高
1.由我国科学家研发成功的铝锰电池是一种比能量很高的新型干电池,以氯化钠和稀氨水混合溶液为电解质,铝和二氧化锰-石墨为两极,其电池反应为Al+3MnO2+3H2O ══3MnO(OH)+Al(OH)3。下列有关该电池放电时的说法不正确的是( )。
A.二氧化锰-石墨为电池正极
B.负极反应式为Al-3e-+3NH3·H2O══Al(OH)3+3NH+4
C.OH-不断由负极向正极移动
D.每生成1 mol MnO(OH)转移1 mol电子
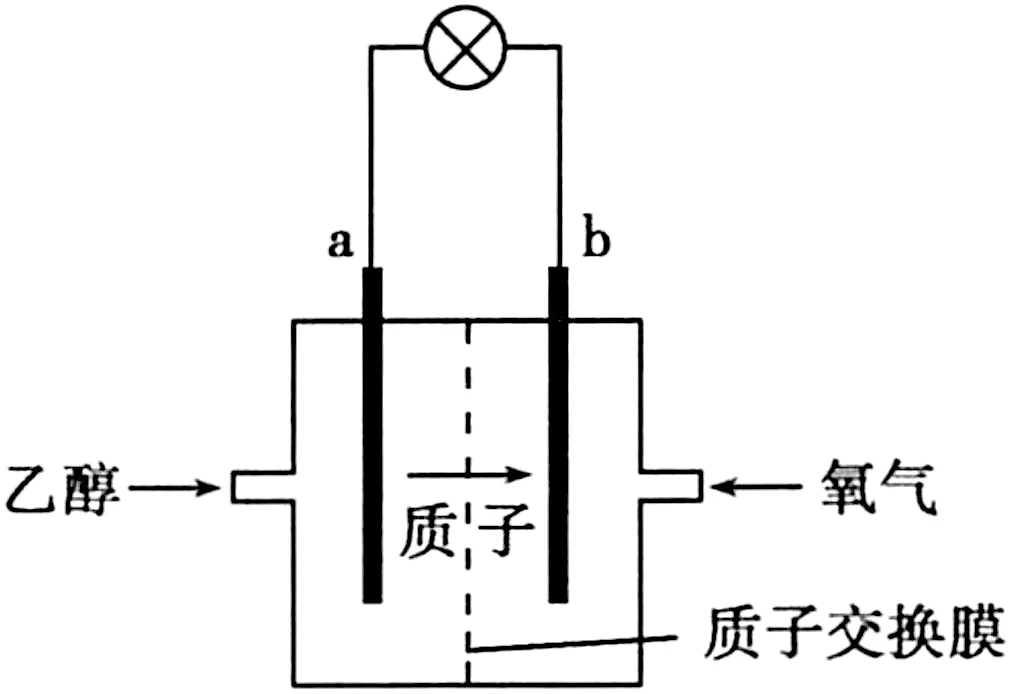
图4
A.a极为电池的正极
B.电池工作时电流由a极沿导线经灯泡再到b极
C.电池负极的电极反应为4H++O2+4e-══2H2O
D.电池工作时,1 mol乙醇被氧化时有12 mol电子转移
3.锌铜原电池装置如图5 所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )。
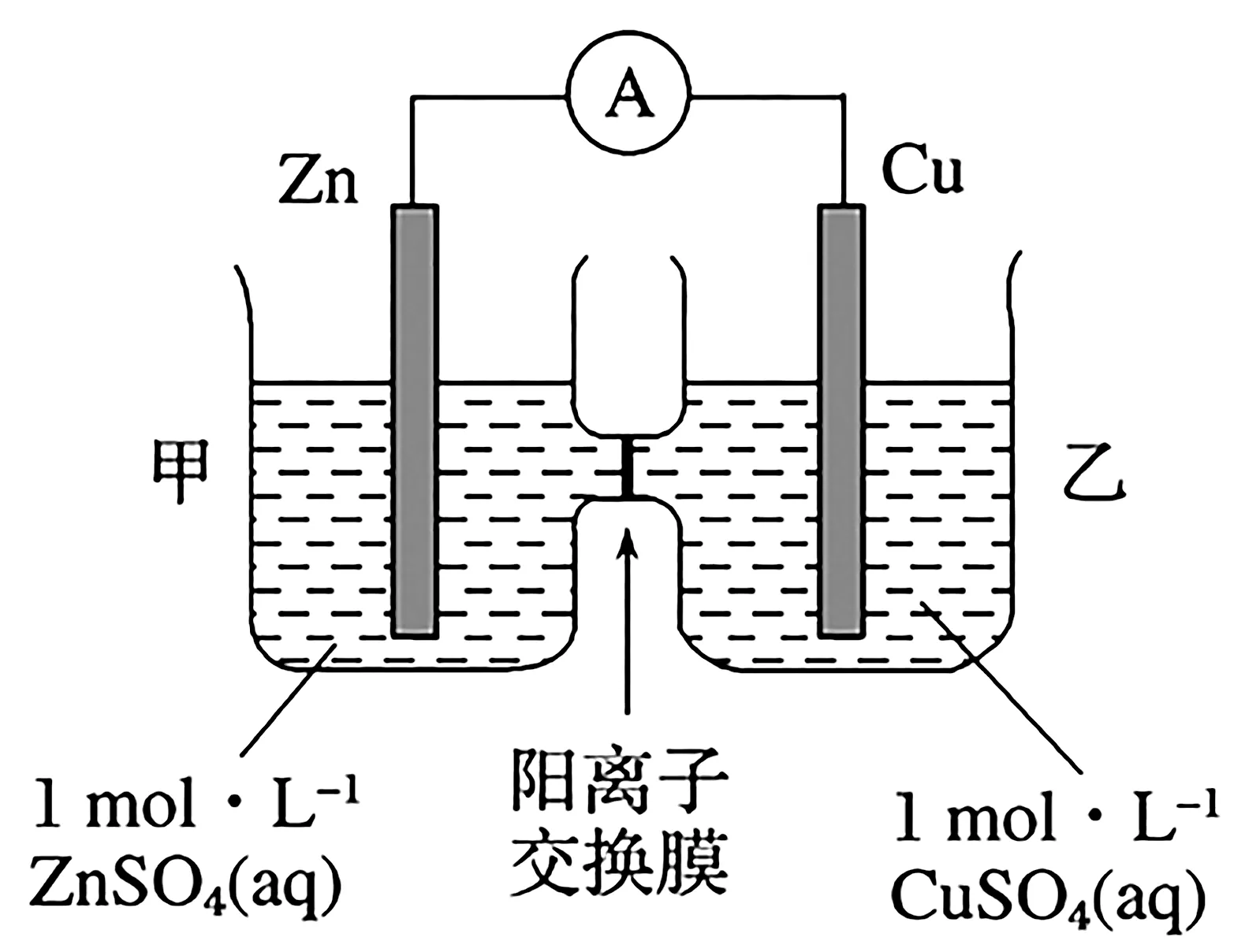
图5
A.铜电极上发生氧化反应
C.电池工作一段时间后,乙池溶液的总质量增加
D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
参考答案:1.C 2.D 3.C

