腐皮镰刀菌病原致病性及苜蓿品种抗病性研究
陈博,牛艺帆,刘晓宇,张苏晗,牛军鹏,郭志鹏,刘超齐,郭永鹏,郭玉霞*
(1. 河南农业大学动物科技学院,河南 郑州 450046;2. 西北农林科技大学草业与草原学院,陕西 咸阳 712100)
苜蓿(Medicago sativa)是世界上栽培最早的多年生高产优质豆科牧草,具有营养价值高、适口性好、种植面积大、分布范围广等特点,素有“牧草之王”的美誉[1-3]。紫花苜蓿根系发达,在寒、旱、盐碱等特殊土壤环境中仍具有较好的生长能力。紫花苜蓿还可改善土壤特性,防止水土流失,具有良好的生态效益[3-4]。2012 年至今,中央一号文件多次提及要加快“草牧业”的发展,我国的苜蓿产业因此得到重视,发展空前迅速,种植面积逐年增加[5]。但是随着苜蓿种植面积的增加和种植年限的延长,苜蓿根腐病的发生也越发严重,且已成为致使苜蓿衰败和产量下降的主要病害,成为威胁我国苜蓿产业发展的重要因素之一[6-7]。苜蓿根腐病是世界性的土传根部病害[8-9],在国内外各个苜蓿种植区常有发生,因此该病害的防治研究对苜蓿产业的发展尤为重要。
腐皮镰刀菌(Fusarium solani)是世界范围内广泛存在的土传病原菌,可侵染多种农作物并引起多种病症,如苜蓿根腐病[10-12]、烟草(Nicotiana tabacum)根腐病[13]、红薯(Ipomoea batatas)根腐病[14]、花生(Arachis hypogaea)褐根腐病[15]、西葫芦(Cucurbita pepo)根腐病[16]、花椒(Zanthoxylum bungeanum)根腐病[17]、生姜(Zingiber officinale)枯萎病等[18-19]。由腐皮镰刀菌引起的苜蓿根腐病一直以来严重地威胁着国内外苜蓿产业的发展,Staten 等[20]报道了腐皮镰刀菌可以引起苜蓿根腐病;McDonald[21]在加拿大的苜蓿种植区鉴定出了腐皮镰刀菌;Uddin 等[22]报道了腐皮镰刀菌为美国内华达州主要致病菌之一。在我国,陈雅君等[11]在东北苜蓿种植区也分离鉴定出了腐皮镰刀菌,随后腐皮镰刀菌引致的苜蓿根腐病在内蒙古[23-24]、甘肃[25-26]、河北[27-28]、河南[29]、黑龙江[30]等地均有报道。孔前前等[27]对镰孢菌的生物学特性进行了研究,结果表明对于腐皮镰刀菌,最适培养基为马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)和查氏培养基(Czapek dox medium),最适温度为26~28 ℃,最适pH 为7~8;阮柳等[28]对河北地区的苜蓿根腐病样品进行了病原的分离鉴定、致病性测定和室内毒力测定,结果表明腐皮镰刀菌是致病性最强的病原菌之一;王多成等[25]对甘肃张掖、酒泉地区的苜蓿根腐病进行了调查,当地发病的苜蓿根部出现病斑,表皮腐烂,地上部叶片发黄枯萎,对发病样品上分离的病原物进行鉴定和致病性测定,结果证明腐皮镰刀菌为当地主要病原,且致病性最强,可达60%;王慧菲[31]在2019 年对云南腾冲地区的紫花苜蓿根腐病进行研究,结果表明当地根腐病发病率可达70%,腐皮镰刀菌作为主要病原物,主要分布于苜蓿根部的根皮层,且通过致病性测定发现腐皮镰刀菌对苜蓿的株高、地上干重和根干重以及蒸腾速率、净光合速率、叶片气孔导度均有显著的降低效果。
以往对苜蓿根腐病的研究多集中于病原菌的鉴定,对于腐皮镰刀菌致病性和苜蓿种苗抗病性等方面的系统性研究较少。本研究以腐皮镰刀菌在不同培养基质上的致病性,以及腐皮镰刀菌对22 个苜蓿品种幼苗致病性的差异为着手点,对紫花苜蓿和腐皮镰刀菌的相互作用机制进行研究,对于苜蓿抗性分析和抗病育种均具有重要意义,以期为培育新的苜蓿抗性品种和提高苜蓿产业发展提供科学依据。
1 材料与方法
1.1 试验材料
本试验于2021 年12 月15 日在陕西咸阳试验基地苜蓿田采用“W”五点取样法采样,取样深度为表土耕作层0~30 cm。编码标记后带回实验室置于4 ℃冷藏箱中备用。供试菌株为腐皮镰刀菌(为本试验分离菌株,本试验分离到的其他菌种菌株,另文发表)。供试苜蓿品种详见表1。试验采用的马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)成分为马铃薯200 g、葡萄糖20 g、琼脂粉15 g、蒸馏水1 L;水琼脂(water agar,WA)培养基成分为琼脂粉15 g、蒸馏水1 L。
表1 参试苜蓿品种及其来源Table 1 Testing alfalfa varieties in the experiment and their sources
1.2 研究方法
1.2.1 病原菌的分离 采用常规组织分离法对采集的苜蓿根部病样进行分离。用自来水清洗附着在根部样品的泥土,后将根系切成约2 mm×2 mm 的方块,将根部组织置于75%酒精表面消毒2 min、1% NaClO 表面消毒5 min,再用无菌水冲洗3 次,在无菌滤纸(130 ℃烘箱烘烤5 h)上吸干黏附水分,用无菌镊子将消毒后的根部组织切块均匀放置于含有青霉素、链霉素各100 mg·L-1的PDA 培养基上培养,每皿10 个根段。将培养皿移入20 ℃黑暗恒温培养箱中培养3 d 后及时将分离到的真菌菌落分别转接到PDA 培养基上于20 ℃下进行纯化培养。对产孢的真菌菌落,采用单孢分离法[32]获得纯培菌株,对不易产孢的真菌菌落,用接种针挑取菌落上的先端菌丝,接种在PDA 培养基上培养,获得菌株纯培养用于鉴定。
1.2.2 病原菌的形态学鉴定 纯培菌株于20 ℃黑暗培养7 d,观察并记录纯培养物的菌落形态学特征,并利用显微镜对病原菌的分生孢子和菌丝体形态进行观测和拍照。根据《半知菌属图解》[33]《常见镰刀菌鉴定指南》[34]《植物病原真菌学》[35]《镰刀菌属》[36]、Fusariumspecies:an illustrated manual for identification[37]等资料的描述,对其进行鉴定。
1.2.3 病原菌的生物分子学鉴定 用接种针在菌落边缘挑取一小块带有菌丝的培养基,转入PDA 平板中央,20 ℃恒温黑暗培养7 d 后收集菌丝,按照真菌DNA 提取试剂盒说明书提取菌株基因组DNA,并利用超微量分光光度计(Thermo Scientific NANODROP 2000 美国)测定分离菌株基因组DNA 的质量和浓度,当OD260 nm/OD280 nm 的值为1.8~2.0 时,采用ITS 真菌通用引物ITS5(5′-GGAAGTAAAAGTCGTAACAAGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)对菌株基因组DNA 进行PCR 扩增,引物由河南尚亚生物技术有限公司合成。PCR 反应体系50 μL:2×TaqPCR 预混液25 μL、5 μmol·L-1引物对ITS5/ITS4 共2 μL、100 ng·μL-1DNA 模板1 μL、ddH2O 22 μL。扩增ITS 的反应程序为:94 ℃预变性5 min;94 ℃变性30 s,55 ℃复性30 s,72 ℃延伸1 min,35 个循环;72 ℃延伸10 min。反应结束后,取PCR 产物在1%琼脂糖凝胶电泳中进行检测。PCR 扩增产物委托生工生物工程(上海)股份有限公司进行纯化和测序。将测序结果通过NCBI BLAST 数据库和MEGA-X 邻接法构建系统发育树,最终结合形态学鉴定结果共同鉴定菌种的生物学分类地位。
1.2.4 病原菌对紫花苜蓿致病性的测定 将分离得到的腐皮镰刀菌接种于PDA 培养基上,在20 ℃恒温培养箱黑暗条件下培养7 d,作为参试菌种。再用经过灭菌的直径为8 mm 的打孔器在菌落边缘钻取3 个直径8 mm 的菌饼,将菌饼分别接种于PDA、WA 培养基上培养一周供接种用(接菌组,inoculation group)。将各个苜蓿品种的种子浸泡在75%酒精表面消毒2 min、1% NaClO 表面消毒5 min,再用无菌水冲洗种子5 次,用无菌滤纸将种子表面水分吸干后均匀放置于已培养好菌落的培养皿中,每皿20 粒,每处理设3 个重复(培养皿),以未接种菌株的培养皿为空白对照(对照组,control group)。接种后将培养皿放置在培养箱中,20 ℃黑暗下培养。在接种种子后第14 天统计苜蓿种子发芽数、根长、苗长和病情指数,根据如下公式计算[38]:
相对发芽率(%)=各处理每个重复的实际发芽率/对照3 个重复的发芽率平均值×100
相对根长=各处理取10 个重复的实际根长/对照每皿随机取10 株苜蓿苗根长的平均值
相对苗长=各处理取10 个重复的实际苗长/对照每皿随机取10 株苜蓿苗的苗长平均值
相对根苗长度比=各处理取10 个重复的根长与苗长之比/对照每皿随机取10 株苜蓿苗的根长与苗长之比
根据如下标准统计每株幼苗上的病情指数级别[39]:0. 无肉眼可见症状;Ⅰ. 根变细;Ⅱ. 根部小于1/2 的面积出现病斑;Ⅲ. 根部大于1/2 的面积出现病斑;Ⅳ. 全株腐烂;Ⅴ. 种子烂死,根据如下公式计算病情指数:
病情指数=∑(病级株数×代表数值)/(株数总和×发病最重级的代表数值)×100
1.3 综合评价
采用隶属值函数标准差系数赋予权重法进行综合评价[40-43],具体步骤参考李彦忠等[43]的研究:利用公式(1)和公式(2)计算各指标的隶属函数值[如果指标与抗病性呈正相关时用公式(1)计算该指标的隶属函数值,若指标与抗病性呈负相关时用公式(2)进行反隶属函数转换,计算该指标的隶属函数值],利用公式(3)计算标准差系数(Vj),利用公式(4)计算各个指标的权重系数(Wj),最后采用公式(5)计算各个品种的综合评价值(D),D值越大,抗病越强。
式中:μ(Xj)代表第j个指标的隶属函数值;Xj表示第j个指标值;Xmin表示第j个指标的最小值;Xmax则表示第j个指标的最大值。=表示第j个指标的平均值;Xij表示公式中第i个品种的j指标的隶属函数值;Vj代表第j个指标的标准差系数;Wj表示第j个指标的权重。
1.4 数据分析
用Microsoft Excel 进行数据处理,用IBM SPSS Statistics 25 软件对数据进行平均值的计算和差异显著性分析,对不同接种处理的相对发芽率、相对根长、相对苗长、相对根苗长度比和病情指数进行统计分析(Duncan)。
2 结果与分析
2.1 病原菌的鉴定
通过形态学的初步鉴定,共分离到12 种真菌,对形态上鉴定为腐皮镰刀菌的菌株进行进一步观察并选取代表性菌株进行进一步研究。
2.1.1 腐皮镰刀菌形态学鉴定 把分离得到的腐皮镰刀菌代表性菌株NL-342-C 在显微镜下进行观察。在PDA 培养基上菌落为圆形,初期菌丝稀疏,不在培养基中产生色素,紧贴培养基表面生长,后期菌丝较为浓密,菌落正面气生菌丝为白色,中间紧致,边缘稀疏,表面粗糙干燥,从菌落背面可以观察到棕绿色色素,大型分生孢子粗壮,稍弯曲为镰刀形,具有3~5 个横隔,小型分生孢子多为单细胞,椭圆形到肾形,厚垣孢子有单生、对生和簇生(图1)。
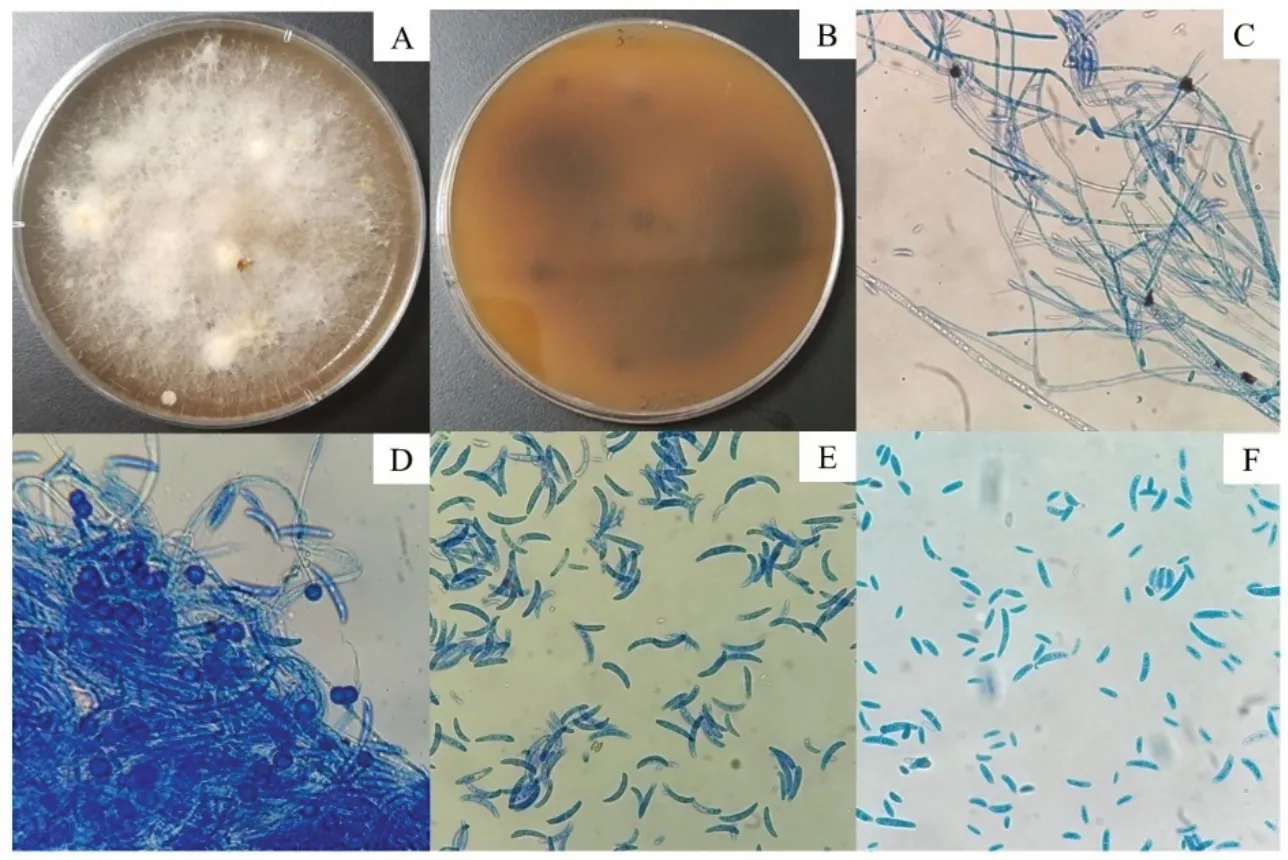
图1 紫花苜蓿根中分离的腐皮镰刀菌形态特征Fig. 1 Morphological characteristics of F. solani isolated from alfalfa roots
2.1.2 腐皮镰刀菌分子生物学鉴定 利用真菌通用引物ITS5/ITS4 对腐皮镰刀菌(NL-342-C)rDNA 的ITS区进行扩增,将获得片段大小正确的条带进行测序。将测序所得到的序列提交至GenBank 数据库获得登录号OP753727,在NCBI 通过BLAST 搜索核酸数据库进行比对和同源性分析,下载相似度高的序列以及地理位置距离不同的腐皮镰刀菌序列,以木贼镰刀菌(KX576658.1)为外群用MEGA-X 邻接法构建系统发育树(图2)。结果表明,NL-342-C 菌株与 GenBank 登录号为 ON329814.1、MH879587.1、ON329813.1、ON090323.1、ON090325.1、MN658459.1 的腐皮镰刀菌聚为一支,且置信度为99%,由此分析可以看出在地理位置上距离较近地区的菌株序列具有较高的相似性。再结合以上形态学特征,将菌株NL-342-C 鉴定为腐皮镰刀菌。

图2 腐皮镰刀菌ITS 系统发育树Fig.2 Phylogenetic tree for F. solani rDNA-ITS gene sequences
2.2 腐皮镰刀菌对紫花苜蓿致病性的测定
2.2.1 腐皮镰刀菌对22 个紫花苜蓿品种相对发芽率的影响 从表2 可以看出,接菌组和对照组相比,无论是在WA 培养基还是PDA 培养基,腐皮镰刀菌对22 个苜蓿品种的相对发芽率均有一定的抑制作用。
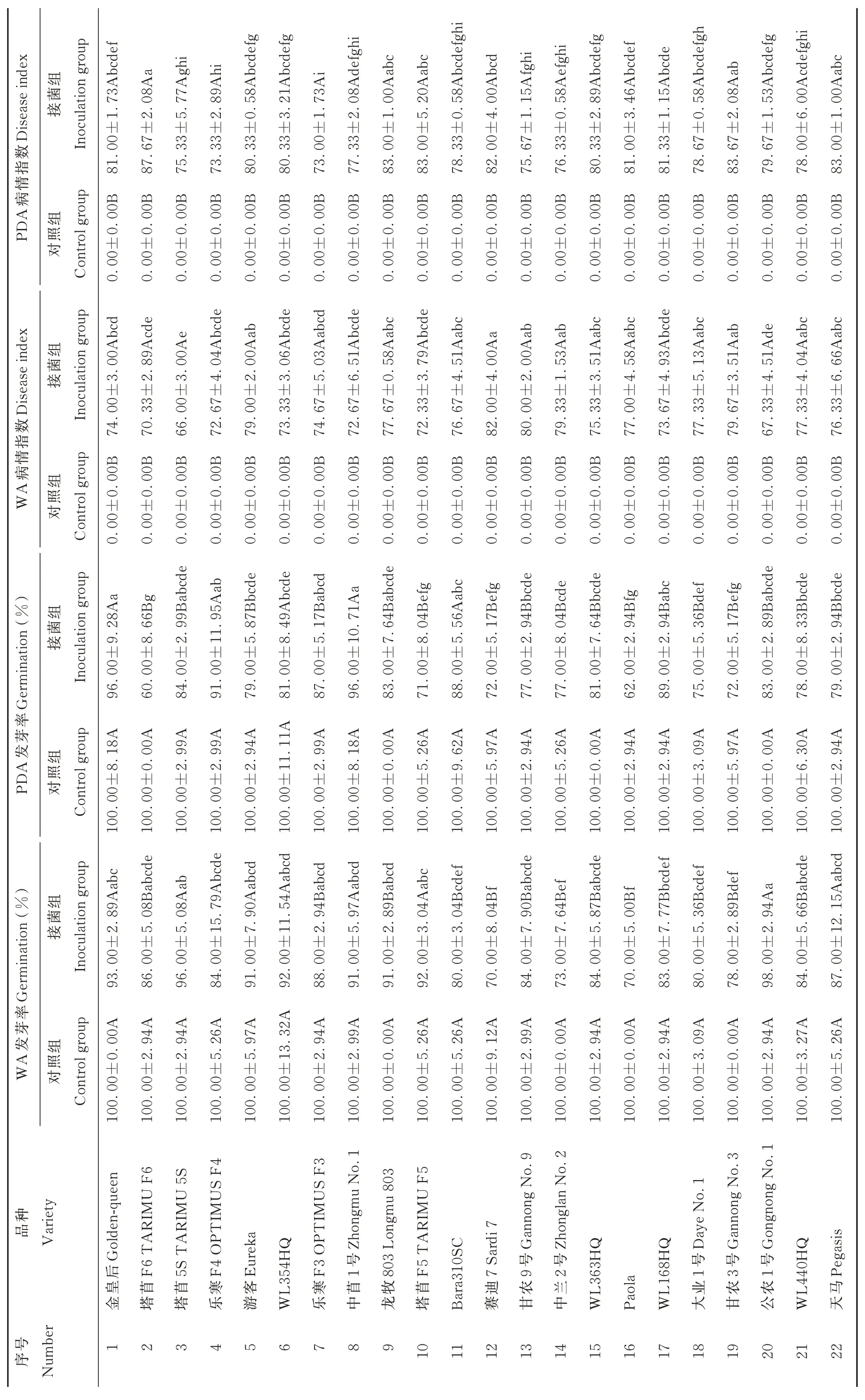
表2 腐皮镰刀菌对 22 个紫花苜蓿品种相对发芽率和病情指数的影响Table 2 Effects of F. solani on relative germination percentage and disease index of 22 alfalfa cultivars
以22 个紫花苜蓿品种接菌后的相对发芽率来看,在两种培养基上,不同苜蓿品种之间的相对发芽率均存在差异。在WA 培养基上公农1 号的抗性最强,相对发芽率最高(98.00%),显著高于Bara310SC、赛迪7、中兰2 号、Paola、WL168HQ、大业1 号和甘农3 号(P<0.05);赛迪7 和Paola 在WA 培养基上的抗性最弱,相对发芽率最低(均为70.00%),显著低于除Bara310SC、中兰2 号、WL168HQ、大业1 号和甘农3 号外的15 个苜蓿品种(P<0.05)。在PDA 培养基上金皇后和中苜1 号的抗性最强,相对发芽率最高(均为96.00%),且显著高于除塔苜5S、乐寒F4、乐寒F3、龙牧803、Bara310SC、WL168HQ 和公农1 号外的13 个苜蓿品种(P<0.05);塔苜F6 在PDA 培养基上的抗性最弱,相对发芽率最低(60.00%),显著低于除塔苜F5、赛迪7、Paola 和甘农3 号外的17 个苜蓿品种(P<0.05)。两种培养基对同一苜蓿品种的相对发芽率的抑制作用也有所差异,金皇后、乐寒F4、中苜1 号、Bara310SC、赛迪7、中兰2 号和WL168HQ 在PDA 培养基上的相对发芽率均大于在WA 培养基上的相对发芽率,而剩余15 个品种在WA 培养基上的相对发芽率更高。
以22 个苜蓿品种在两种培养基上的相对发芽率来评价对腐皮镰刀菌的抗性,抗性最强的是金皇后,抗性较强的是中苜1 号、公农1 号、塔苜5S 和乐寒F4,抗性较弱的是中兰2 号、甘农3 号、塔苜F6 和赛迪7,抗性最弱的是Paola。
2.2.2 腐皮镰刀菌对22 个紫花苜蓿品种病情指数的影响 从表2 可以看出,两种培养基上接菌组和对照组相比,腐皮镰刀菌对22 个苜蓿品种均有显著的致病性(P<0.05)。且从整体上看,22 个苜蓿品种在WA 培养基上的病情指数范围为66.00~82.00,而在PDA 培养基上的病情指数范围为73.00~87.67,所以腐皮镰刀菌在PDA 培养基上的致病性强于其在WA 培养基上的致病性。
以22 个紫花苜蓿品种接菌后的病情指数来看,在相同的培养基质上,不同苜蓿品种之间的病情指数存在差异。在WA 培养基上塔苜5S 的抗性最强,病情指数最小(66.00),显著低于除塔苜F6、乐寒F4、WL354HQ、中苜1 号、塔苜F5、WL168HQ 和公农1 号外的14 个苜蓿品种(P<0.05);赛迪7 在WA 培养基上的抗性最弱,病情指数最大(82.00),高于其余21 个苜蓿品种。在PDA 培养基上,乐寒F3 的抗性最强,病情指数最小(73.00),显著低于除塔苜5S、乐寒F4、中苜1 号、Bara310SC、甘农9 号、中兰2 号和WL440HQ 外的14 个苜蓿品种(P<0.05);塔苜F6 在PDA 培养基上的抗性最弱,病情指数最大(87.67),且显著高于除龙牧803、塔苜F5、甘农3 号和天马外的17 个苜蓿品种(P<0.05)。两种培养基对同一苜蓿品种病情指数的影响也存在一定的差异,在WA 培养基上抗性最强的塔苜5S,其在PDA 上的病情指数为75.33,高于乐寒F4(73.33)、乐寒F3(73.00);在WA 培养基上抗性最弱的赛迪7 在PDA 上的病情指数为82.00,显著低于塔苜F6(87.67)(P<0.05),同时也低于龙牧803(83.00)、塔苜F5(83.00)、甘农3 号(83.67)和天马(83.00)。
以22 个苜蓿品种在两种培养基上的病情指数来评价其对腐皮镰刀菌的抗性:抗性最强的苜蓿品种是塔苜5S,抗性较强的是乐寒F4、公农1 号、乐寒F3 和中苜1 号,抗性较弱的是天马、游客、龙牧803 和甘农3 号,抗性最弱的是赛迪7。
2.2.3 腐皮镰刀菌对22 个紫花苜蓿品种相对苗长与相对根长的影响 由图3 和图4 可以看出:在两种培养基上,腐皮镰刀菌均降低了22 个苜蓿品种的相对苗长和相对根长。且总体上看,腐皮镰刀菌在PDA 培养基上对22个苜蓿品种的致病性强于WA 培养基。
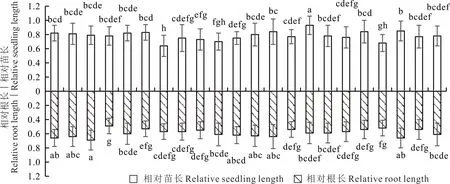
图3 WA 培养基上腐皮镰刀菌对22 个紫花苜蓿品种生长的影响Fig.3 Effects of F. solani on the growth of 22 alfalfa cultivars in WA medium

图4 PDA 培养基上腐皮镰刀菌对22 个紫花苜蓿品种生长的影响Fig.4 Effects of F. solani on the growth of 22 alfalfa cultivars in PDA medium
以22 个紫花苜蓿品种接菌后的相对苗长来分析,在相同培养基上不同的苜蓿品种对腐皮镰刀菌的抗性有所不同,其相对苗长被腐皮镰刀菌抑制的程度有所不同。在WA 培养基上,WL363HQ 的相对苗长最大(0.93),且显著大于其余21 个苜蓿品种(P<0.05),所以其在WA 培养基上对腐皮镰刀菌的抗性最强;乐寒F3 的相对苗长最小(0.64),且显著小于除塔苜F5 和甘农3 号外的19 个苜蓿品种(P<0.05),所以其在WA 培养基上对腐皮镰刀菌的抗性最弱。在PDA 培养基上,Bara310SC 的相对苗长最大(0.73),且显著大于除中苜1 号、中兰2 号、WL363HQ、大业1 号和天马以外的16 个苜蓿品种(P<0.05),所以其在PDA 培养基上对腐皮镰刀菌的抗性最强;塔苜F5 的相对苗长最小(0.51),且显著小于除塔苜5S、WL354HQ、乐寒F3、龙牧803、Paola、甘农3 号、公农1号和WL440HQ 外的13 个苜蓿品种,所以其在PDA 培养基上对腐皮镰刀菌的抗性最弱。相同的苜蓿品种在不同的培养基上抗病性也有所差异,在WA 培养基上对腐皮镰刀菌抗病性最强的苜蓿品种WL363HQ,在PDA 培养基上的相对苗长为0.66,虽对腐皮镰刀菌的抗病性较好,但还是弱于Bara310SC(0.73)、天马(0.70)、中苜1 号(0.69)、大业1 号(0.68)和中兰2 号(0.67);在WA 培养基上对腐皮镰刀菌抗病性最弱的苜蓿品种乐寒F3,在PDA 培养基上的相对苗长为0.56,对腐皮镰刀菌的抗性强于塔苜5S(0.54)、塔苜F5(0.51)、龙牧803(0.51)和WL354HQ(0.51)。
以22 个紫花苜蓿品种接菌后的相对根长来分析,不同苜蓿品种在相同培养基上对腐皮镰刀菌的抗性有所差异,其相对根长被抑制的程度有所不同,在WA 培养基上,22 个苜蓿品种中塔苜5S 的相对根长最大(0.69),显著大于除金皇后、塔苜F6、Bara310SC、赛迪7、甘农9 号和公农1 号以外的15 个苜蓿品种(P<0.05),所以其在WA培养基上对腐皮镰刀菌的抗性最强;乐寒F4 的相对根长最小(0.49),所以其在WA 培养基上对腐皮镰刀菌的抗性最弱。在PDA 培养基上,Bara310SC 和大业1 号的相对根长最大(均为0.31),其在PDA 培养基上对腐皮镰刀菌的抗性最强;Paola 和公农1 号的相对根长最小(均为0.22),在PDA 培养基上对腐皮镰刀菌的抗性最弱。同一苜蓿品种在不同培养基上的抗性也有所差异,在WA 培养基上对腐皮镰刀菌抗性最强的苜蓿品种塔苜5S,在PDA 培养基上的相对根长为0.29,对腐皮镰刀菌的抗病性弱于中苜1 号(0.30)、Bara310SC(0.31)和大业1 号(0.31);在WA 培养基上对腐皮镰刀菌抗病性最弱的苜蓿品种乐寒F4,在PDA 培养基上的相对根长为0.27,对腐皮镰刀菌的抗性强于除塔苜F6(0.28)、塔苜5S(0.29)、游客(0.28)、WL354HQ(0.28)、乐寒F3(0.29)、中苜1号(0.30)、Bara310SC(0.31)、WL168HQ(0.27)、大业1 号(0.31)、天马(0.29)外的其余11 个品种。
从22 个苜蓿品种在两种不同培养基上的相对苗长来分析,抗性最强的苜蓿品种是WL363HQ,抗性较强的是大业1 号、Bara310SC、天马和中苜1 号,抗性较弱的是塔苜5S、甘农3 号、龙牧803 和塔苜F5,抗性最弱的是乐寒F3。从22 个苜蓿品种在两种不同培养基上的相对根长来说,抗性最强的苜蓿品种是塔苜5S,抗性较强的是Bara310SC、塔苜F6、金皇后和天马,抗性较弱的是WL354HQ、中兰2 号、龙牧803 和乐寒F4,抗性最弱的是甘农3 号。
2.2.4 腐皮镰刀菌对22 个紫花苜蓿品种相对根苗长度比的影响 从表3 可以看出,在PDA 培养基上,腐皮镰刀菌显著降低了所有参试苜蓿品种的根苗长度比(P<0.05),而在WA 培养基上,除乐寒F3 以外的21 个参试苜蓿品种也均显著降低(P<0.05)。从相同苜蓿品种接菌组的相对根苗长度比的数值来看,腐皮镰刀菌在WA 培养基上致病性相对较弱,在PDA 培养基上致病性相对较强。
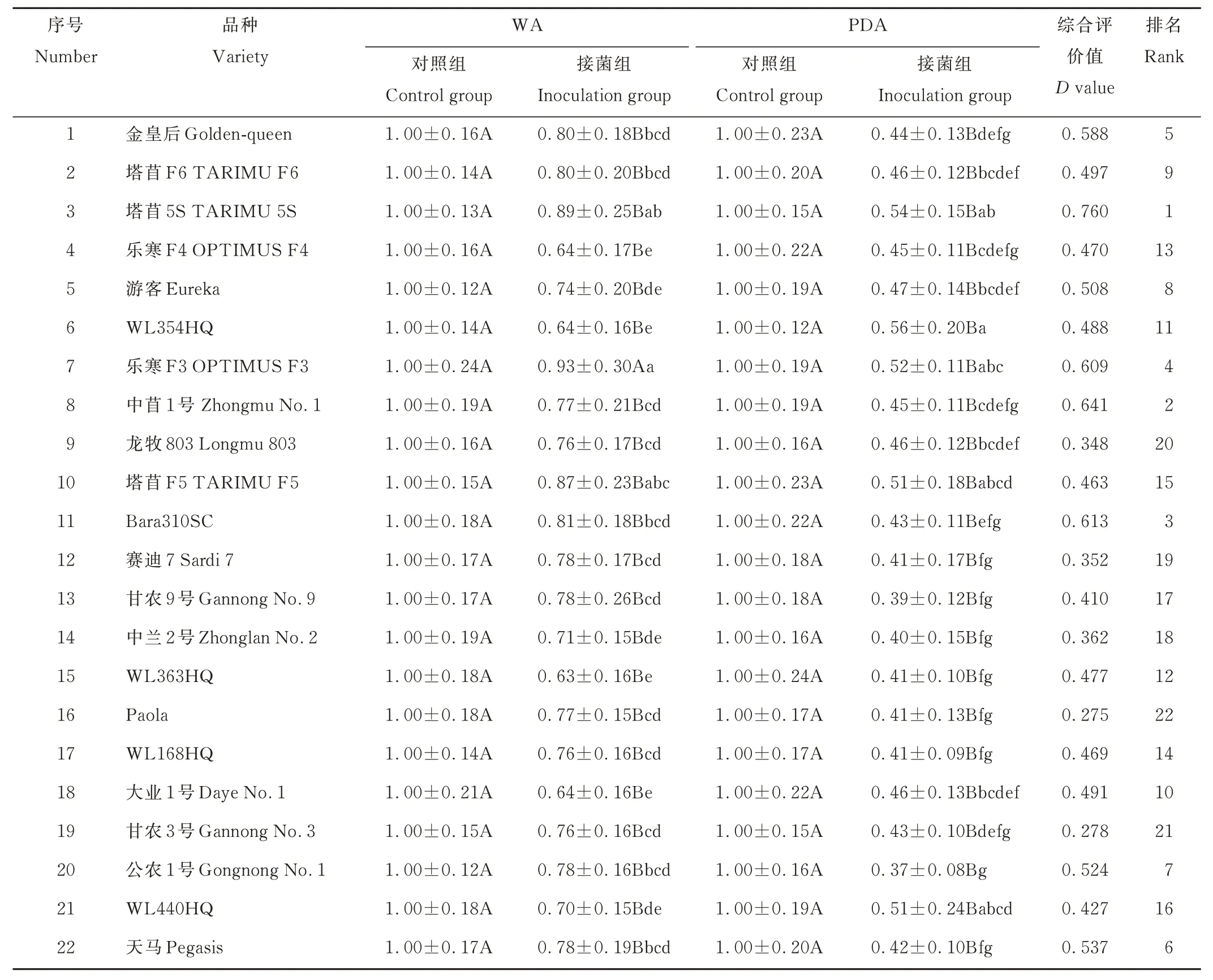
表3 腐皮镰刀菌对22 个紫花苜蓿品种相对根苗长度比的影响及综合评价Table 3 Effects of F. solani on relative root-shoot ratio of 22 alfalfa cultivars and comprehensive evaluation
以22 个紫花苜蓿品种接菌后的相对根苗长度比来看,相同培养基上,腐皮镰刀菌接种于不同的紫花苜蓿品种,对相对根苗长度比的影响有所差异。在WA 培养基上接菌后,对乐寒F3 的相对根苗长度比的影响最小,相对根苗长度比为0.93,显著高于除塔苜5S 和塔苜F5 外的其余19 个苜蓿品种(P<0.05);对WL363HQ 的相对根苗长度比影响最大,相对根苗长度比为0.63。在PDA 培养基上接菌后,对WL354HQ 的相对根苗长度比影响最小,相对根苗长度比为0.56,显著高于除塔苜5S、乐寒F3、塔苜F5 和WL440HQ 外的17 个苜蓿品种(P<0.05);对公农1 号的影响最大,相对根苗长度比为0.37,低于其余的21 个苜蓿品种。同一苜蓿品种在不同培养基质上表现出的抗性也有所差异,在PDA 培养基上接菌组的相对根苗长度比最大的苜蓿品种为WL354HQ,其在WA 培养基上相对根苗长度比为0.64,显著低于除乐寒F4、游客、中兰2 号、WL363HQ、大业1 号和WL440HQ 以外的其余15 个苜蓿品种(P<0.05);在PDA 培养基上相对根苗长度比最小的苜蓿品种为公农1 号,其在WA 培养基上相对根苗长度比并非最小,相对根苗长度比为0.78。
因此,以相对根苗长度比结合两种培养基来评价22 个苜蓿品种的抗性,抗性最强的是乐寒F3,抗性较强的是塔苜5S、塔苜F5、塔苜F6 和金皇后,抗性较弱的是公农1 号、中兰2 号、大业1 号和乐寒F4,抗性最弱的是WL363HQ(图5)。

图5 接种腐皮镰刀菌后的苜蓿苗的长势及病情指数分级标准Fig. 5 The growth and grading standard of disease index of alfalfa seedlings inoculated with F. solani
2.3 不同紫花苜蓿对腐皮镰刀菌抗病性综合评价
对22 个不同品种的紫花苜蓿进行隶属函数综合评价,以综合评价值的大小来评价苜蓿品种的抗病强弱。综合评价值越大,则该苜蓿品种的抗病性越强,综合评价值越小,则该苜蓿品种的抗病性越弱。以22 个不同品种紫花苜蓿的综合评价值进行排比,评分最高的苜蓿品种为塔苜5S,抗病性最强;其次为中苜1 号、Bara310SC、乐寒F3 和金皇后,抗病性较强;评分最低的苜蓿品种为Paola,抗病性最弱;其次评分较低的苜蓿品种为中兰2 号、赛迪7、龙牧803 和甘农3 号,抗病性较弱(表3)。
3 讨论
3.1 腐皮镰刀菌的致病性
本研究发现从苜蓿根部分离得到的腐皮镰刀菌在WA 培养基和PDA 培养基上对参试的22 个苜蓿品种均有致病力,对全部参试苜蓿品种的相对根长、相对苗长和病情指数均有一定的致病性,对大多数参试苜蓿品种的相对根苗长度比和相对发芽率也有显著的影响,这说明腐皮镰刀菌是致使苜蓿根腐病发生的重要致病菌,也是当地苜蓿种植区的重要致病菌。Turner 等[40]报道了美国尤他州主要致病菌为腐皮镰刀菌;陈雅君等[11]在黑龙江省进行了苜蓿根腐病的调查,结果表明腐皮镰刀菌为当地病害的优势菌种;安欢乐[26]将从苜蓿根部分离的腐皮镰刀菌和其他真菌回接于苜蓿根部,结果表明腐皮镰刀菌的致病性仅次于异茎点霉,对苜蓿有较强的致病性,是苜蓿根腐病的重要致病菌,本研究与以上对腐皮镰刀菌致病性的研究结果相一致。本研究还发现腐皮镰刀菌在PDA 培养基上的致病力略强于WA 培养基,这说明碳源作为真菌重要的营养物质,对真菌的致病性有着一定的影响,贵晓荷[41]的研究结果表明,腐皮镰刀菌在WA 培养基上不产孢,在PDA 培养基上能产孢,说明在PDA 培养基上腐皮镰刀菌的生长情况较好,对苜蓿的致病力也较强;Bailey 等[42]指出在土壤区系中不同的碳源会造成土壤微生物种类的差别,本研究结果与其相类似。
3.2 苜蓿品种的抗病性
单用某一种指标来评价苜蓿品种的抗病性是不可靠的,采用多个指标评判的综合结果才更加全面。李彦忠等[43]通过发病率和病情指数对48 个苜蓿品种进行多种病害的抗病性评价,发现各苜蓿品种间的抗病性存在差异;支旭欣等[44]采用水培接菌法,对58 份供试苜蓿材料进行苗期根腐病抗性评价,结果表明不同苜蓿品种之间抗病性差异显著,本研究结果与以上两个研究结果相类似。郭玉霞[45]通过多个抗性指标来评价不同品种苜蓿对腐皮镰刀菌的抗病性,结果发现苜蓿幼苗的相对根长、相对苗长降低,病情指数升高,部分品种的相对发芽率降低,不同菌种对同一苜蓿品种的致病性存在差异,不同苜蓿品种对同一菌种的抗病性也存在差异;丁守彦[46]以发病率和病情指数通过室内盆栽法对30 个苜蓿品种进行了苗期的抗病性鉴定,结果表明30 个苜蓿品种的发病率为55.56%~100.00%,病情指数为29.17~74.31,对腐皮镰刀菌的抗病性有所差异,本研究以相对根长、相对苗长、相对根苗长度比、相对发芽率和病情指数5 个指标综合评价得出,不同苜蓿品种对腐皮镰刀菌的抗病性有所差异,与上述苜蓿根腐病的研究报道结果相一致。
另外,紫花苜蓿根腐病的发生,导致苜蓿根部腐烂,引致地上部分的生物量降低,甚至植株萎蔫死亡,这一系列表现都是病原菌侵入寄主后,寄主产生生理生化反应的综合结果[47]。苜蓿根腐病的发生十分复杂,影响因素较多[48-49],目前,除了苜蓿有抗霜霉病(downy mildew)、疫霉根腐病(Phytophthoramedicaginis)、炭疽病(Colletotrichum trifolii)和壳多胞叶斑病(Stagonospora meliloti)的品种之外[2],还没有见到其他有关苜蓿抗病虫的报道。对于苜蓿根部病害防治最有效的方法是利用抗病品种[50-51],但由于存在新的病原菌生理小种的分化,抗病品种也不能长期有效,故应根据当地生理小种培育出相应的抗病品种;化学防治病害固然可取但要与经济价值、环境风险相结合。目前,对于苜蓿根腐病的研究多处于病原菌鉴定阶段,而在筛选、培育抗性品种方面的研究较少,不同苜蓿品种之间抗病性差异的分子机制也有待进一步研究。本试验通过对22 个苜蓿品种间的抗病性研究,以期为日后的抗性品种培育、抗性机制的研究和根腐病的防治提供依据。
4 结论
依据本试验对22 个供试苜蓿品种的相对苗高、相对根长、相对根苗长度比、相对发芽率和病情指数5 项指标综合评定,得出腐皮镰刀菌对22 个供试苜蓿品种均有致病性,且在PDA 培养基上的致病性强于WA 培养基;塔苜5S 的抗病性最强,中苜1 号、Bara310SC、乐寒F3 和金皇后的抗病性较强,中兰2 号、赛迪7、龙牧803 和甘农3号的抗病性较弱,Paola 的抗病性最弱。

