基于管电流自动调制模式的儿童头颅CT体型特异性剂量的快速估算
张见,刘鹏,张晓军
南京医科大学附属儿童医院 放射科,江苏 南京 210000
引言
随着CT 检查的临床应用日益增加,随之而来的辐射剂量问题受到越来越多的关注[1-2]。有研究表明,幼年时期接受过多的X 射线照射,成年后其血液疾病及脑肿瘤发病概率明显增加。因儿童是特殊群体,其身体组织器官对X 射线的敏感性远远高于成人,故而其辐射危害更应受到重视[3-5]。目前,容积CT 剂量指数(Volume CT Dose Index,CTDIvol)是衡量CT 检查辐射剂量最常用的指标。CTDIvol根据直径为16 cm 或32 cm 的标准体模计算而来,表示扫描体积范围内的平均辐射剂量,其大小受检查参数的影响,主要反映CT 设备的辐射输出剂量。由于标准体模尺寸与儿童检查部位尺寸差异较大,均不能准确地反映患者的大小,并且在对患者辐射剂量的估计中存在较高的不确定性[6-8]。为进一步准确衡量辐射剂量,美国医学物理学家协会(American Association of Physicists in Medicine,AAPM)于2019 年发布了293 号报告,使用基于水当量直径(Water Equivalent Diameter,WED)的体型特异性剂量估算值(Size-Specific Dose Estimate,SSDE),即SSDEWED,来校准CTDIvol,有效弥补了CTDIvol未考虑检查部位尺寸及组织器官密度对X 射线衰减不同等因素对辐射剂量影响的缺陷,是一个更为合理的辐射参数[9]。有研究表明,SSDEWED对头颅辐射的衡量更为准确[8]。本研究通过对儿童头颅CT 影像学资料进行分析,探讨CTDIvol与SSDEWED在衡量辐射剂量上的差异并探讨快速计算SSDEWED的方法。
1 资料与方法
1.1 临床资料
回顾性分析2021 年1—12 月儿童头颅CT 影像学资料1136 例,年龄从3 个月至15 岁不等,平均年龄(6.97±4.47)岁,其中男童651 例、女童485 例,纳入的影像资料均满足诊断要求,且经医院伦理委员会审批通过(201908224-1)。
纳入标准:① 检查体位标准;② 头颅颅骨无缺损且表面无巨大占位性包块;③ 颅内组织无中等及以上程度脑积水及巨大囊性病变;④ 颅内无金属植入物。排除标准:① 颅骨骨质因病变导致密度明显增高;② 数据测量层面有钙化灶或密度异常的实性占位;③ 横断面头颅外形明显异变。
1.2 检查条件
检查设备使用Philips Brilliance 128 iCT。患儿自主或口服镇静剂进入深睡眠后仰卧于检查床,头颅置于头颅颈托内呈标准检查体位。依据患儿年龄将其分为A(年龄≤0.5 岁)、B(0.5<年龄≤3 岁)、C(3<年龄≤6岁)及D(>6岁)4组,其中A组53名,平均年龄(0.41±0.07)岁;B组243名,平均年龄(1.55±0.78)岁;C 组2 1 0 名,平均年龄(4.4 4±0.8 5)岁;D 组630名,平均年龄(10.47±2.48)岁。检查参数:管电压,A、B组100 kVp,C、D组120 kVp;管电流采用自动管电流曝光控制技术,螺距0.296,球管旋转速度0.40 r/s,成像矩阵512×512,探测器宽度64×0.625 mm,使用头颅正侧双定位像定位扫描,扫描范围为颈1椎体下缘至颅顶,扫描基线为听上眶线;扫描后采用iDose4算法重建层厚及层间距均为5 mm的轴位骨窗和脑组织窗图像。
1.3 辐射剂量的计算
记录检查结束后CT 设备自动生成的辐射剂量表中的CTDIvol及其年龄。基于AAPM 293 号报告[9]计算SSDEWED。计算方法:选取扫描部位图像最中间层面,手动勾画包括所有解剖结构的最小椭圆形感兴趣区(Region of Interest,ROI),记录其面积(Area of ROI,AROI)及平均CT 值(CT Value of ROI,CTROI),计算WED、转换因子(Conversion Factor,f)及SSDEWED。计算方式如公式(1)~(3)所示[9]:
式中,a 为4.378094;e 为自然底数;b 为 -0.04331144。
1.4 图像的质量评价
图像质量评价采用主观评价方式,由两名医师对原始及重建图像使用5 分制评价,评分经协商后达成一致意见。评分标准:5 分为优秀,图像质地细腻均匀,解剖结构及病灶、灰白质分界及脑沟脑回均显示清晰,无明显噪声、伪影;4 分为良好,图像质地较为细腻均匀,解剖结构及病灶显示较清晰、灰白质及脑沟脑回显示较清楚,噪声及伪影不明显;3 分为尚可,图像质地细腻均匀度尚可,解剖结构及病灶显示可辨认,灰白质分界及脑沟脑回显示可辨识,有噪声、伪影但不影响诊断;2 分为较差,图像质地较为模糊,解剖结构及病灶显示不清,灰白质分界及脑沟脑回显示亦不清晰,有明显噪声、伪影而影响诊断结论;1 分为不可用,图像不能用于诊断。3 分及以上图像认为可满足诊断要求。
1.5 统计学分析
采用SPSS 25.0 软件进行统计学分析。正态分布数据采用±s表示,偏态数据以中位数(四分位间距)[M(Q1,Q3)]表示。正态分布且方差齐性数据采用配对t检验进行检验,方差不齐则采用Wilcoxon 配对样本秩和检验;两名医师的主观评价一致性验证采用Kappa检验,Kappa 值>0.4 为一致性好;组间图像主观评价采用非参数秩和检验,以P<0.05 为差异有统计学意义;使用标准差、变异系数、全范围间距和四分位间距分别衡量CTDIvol与SSDEWED的离散程度;采用Pearson 分析二变量正态分布数据相关性,采用最小二乘法线性分析建立回归模型。
2 结果
2.1 CTDIvol与SSDEWED间差异
1136 例患儿行头颅CT 检查,其平均CTDIvol为(9.52±1.32)mGy,平均SSDEWED为(8.30±0.67)mGy,二者间差异有统计学意义(t=60.10,P<0.001)。A组CTDIvol<SSDEWED,其余组均CTDIvol>SSDEWED,且组内差异有统计学意义(P<0.001),见表1。各组组内CTDIvol的变异系数、全范围间距及四分位间距均大于SSDEWED,具体组间差异及离散度如表2所示。
表1 4组组内CTDIvol与SSDEWED差异比较结果(±s,mGy)
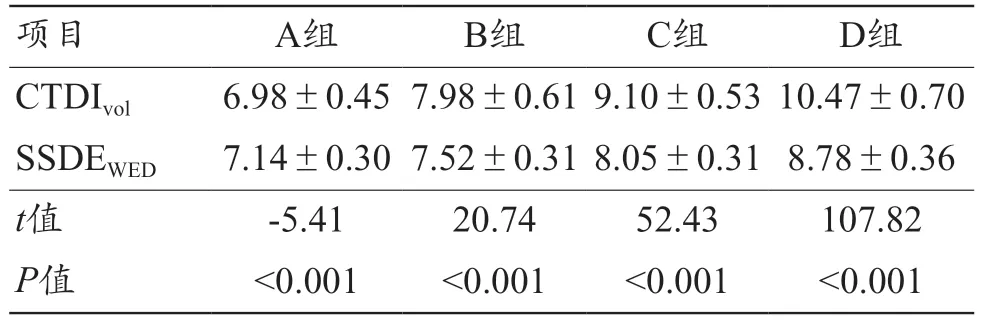
表1 4组组内CTDIvol与SSDEWED差异比较结果(±s,mGy)
注:CTDIvol:容积CT剂量指数;SSDEWED:基于水当量直径的体型特异性剂量估算值。
项目A组B组C组D组CTDIvol6.98±0.45 7.98±0.61 9.10±0.53 10.47±0.70 SSDEWED7.14±0.30 7.52±0.31 8.05±0.31 8.78±0.36 t值-5.4120.7452.43107.82 P值<0.001<0.001<0.001<0.001
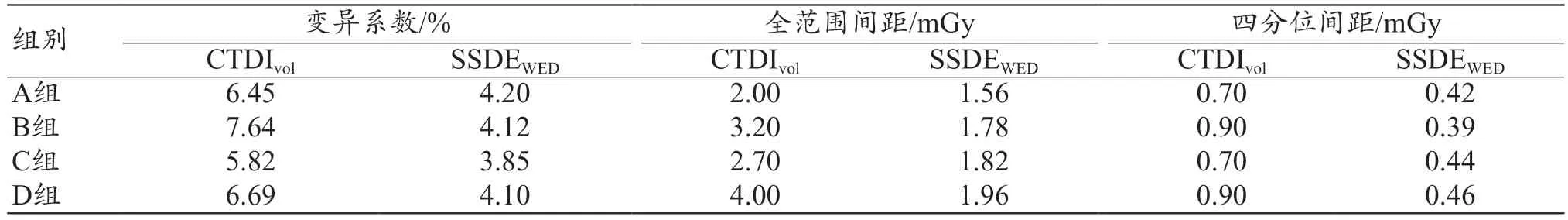
表2 各分组组间差异及离散度比较结果
2.2 CTDIvol与管电流、WED相关性
Pearson 相关性分析显示:CTDIvol与管电流具有较强的正向相关性(100 kVp:r=1.00,P<0.001;120 kVp:r=0.99,P<0.001);CTDIvol与WED 亦具有较强的正向相关性(100 kVp:r=0.95,P<0.001;120 kVp:r=0.87,P<0.001)。具体各管电压下CTDIvol与管电流、CTDIvol与WED 散点分布及拟合曲线如图1 所示。
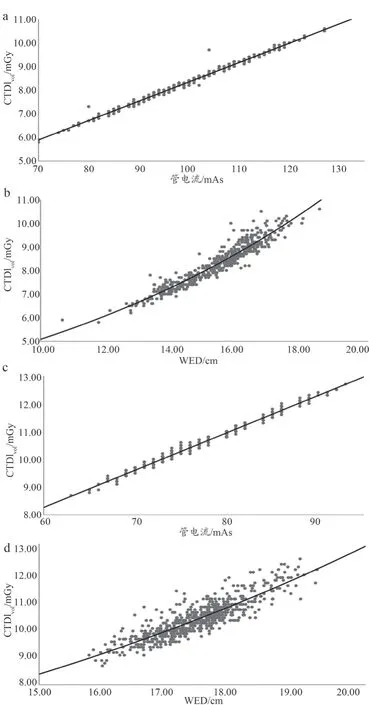
图1 不同管电压下CTDIvol与管电流、CTDIvol与WED散点分布及拟合曲线
2.3 SSDEWED与管电流、WED相关性
Pearson 相关性分析显示:SSDEWED与管电流具有较强的正向相关性(100 kVp :r=0.95,P<0.001 ;120 kVp :r=0.91,P<0.001);SSDEWED与WED在100 kVp 管电压条件下具有较强的正向相关性(r=0.82,P<0.001),在120 kVp 管电压条件下与WED具有中等强度的相关性(r=0.61,P<0.001)。具体各管电压下SSDEWED与管电流、SSDEWED与WED 散点分布及拟合曲线如图2 所示。

图2 不同管电压下SSDEWED与管电流、SSDEWED与WED散点分布及拟合曲线
2.4 WED、f 与年龄的回归模型
WED 及f均随着年龄的变化而变化,在幼儿出生早期,其曲率变化较快,其后曲率变化逐渐趋于平缓。WED、f与年龄分布图如图3 所示。
2.5 图像质量主观评价
4 组患儿图像主观评分分别为(4.89±0.38)分、(4.94±0.29)分、(4.88±0.40)分及(4.94±0.31)分,组间评分差异无统计学意义(Z=0.97,P>0.05),医师评分一致性系数Kappa 值分别为0.78、0.74、0.77、0.72,一致性好,所有图像评价分级均在3 分及以上,均能满足诊断需要。
3 讨论
衡量CT 辐射剂量最直观、最方便的指标是CTDIvol,其直接生成于检查结束后的辐射剂量表中。CTDIvol表示在特定扫描参数下的标准体模的平均辐射剂量,并且极易受到扫描协议的影响,并不能真实反映患者检查部位的大小和组织对X 射线衰减的影响。但是,辐射剂量的大小和真实部位尺寸及组织与X 射线衰减密切相关。SSDEWED使用f对CTDIvol进行校正,克服了CTDIvol无法反映患儿检查部位体型及对X 线衰减影响的缺陷,除了患者的几何形状和扫描位置的组织衰减外,f还与扫描方案选择的体模尺寸有关,AAPM 220 报告中的f以直径为16 cm 的头部体模为参考进行计算[10]。WED 假设人体是由椭圆截面组成的,可以用一个X 射线衰减相当的圆柱形水模来表示,水模的横截面积代表患者的几何大小,CT 值代表组织结构对X射线的平均衰减,因此,基于几何外形和组织衰减特征的f可以更准确地校正患儿辐射剂量[11]。本研究通过建立WED 与年龄回归模型,当患儿年龄为3 岁左右时,其WED 与体模直径相当,而其f约为0.89;f随年龄分布拟合图显示,在患儿约6 月龄时f=1,而WED约为13.90 cm。f=1 时其WED 直径与标准体模直径并不一致,其原因在于头颅组织与胸腹部不同的结构特点[12]:胸腹部由较为均匀的软组织构成,而脑组织则包裹于颅骨之中,颅骨内外板之间的板障海绵体对X 射线有一定的屏蔽作用,为脑组织提供了一个固定的屏蔽源,减少了脑组织实际接受的X 射线,因而在相同的WED 下,脑组织所接受的辐射剂量低于胸腹部,这与Hardy 等[13]的研究结果一致。因此,即使几何尺寸相等,使用具有均匀结构的体模测算而来的CTDIvol与真实辐射仍有一定的偏差。本研究结果亦表明:6 月龄内患儿CTDIvol<SSDEWED,CTDIvol高估其辐射剂量;大于6 月龄患儿CTDIvol>SSDEWED,CTDIvol低估其辐射剂量。SSDEWED的变异系数、全范围及四分位数范围均小于CTDIvol,说明使用SSDEWED能更可靠地反映辐射剂量。
辐射剂量最重要的影响因素为管电压及管电流[14]。在本研究中,管电压的使用以年龄为分组条件,≤6 岁使用100 kVp,>6 岁则使用120 kVp。管电流则采用自动曝光控制技术,其能够根据检查部位左右径及前后径的大小自动调节输出管电流:在颅底等尺寸、组织衰减较大部位会自动增加管电流输出,而在颅顶等部位则会减小管电流的输出,能够最大程度减少辐射剂量[15]。在相同管电压下,管电流的大小与检查部位尺寸及组织密度相关[16]。本研究结果表明:CTDIvol与管电流具有较强的正相关性,CTDIvol与WED 具有较强的正相关性;SSDEWED与管电流具有较强的正相关性,SSDEWED与WED 在100 kVp 管电压条件下具有较强的正相关性,在120 kVp 管电压条件下与WED 具有中等强度的相关性。CTDIvol与管电流、WED 相关性大于SSDEWED与管电流、WED 相关性,说明管电流、WED 对CTDIvol与SSDEWED的影响并不完全相同。二者的区别在于CTDIvol的计算基于一致衰减和恒定直径的标准体模,其变化只与检查参数有关,而SSDEWED是CTDIvol与f的乘积,考虑了扫描参数和检查部位特征对辐射的影响,二者的叠加影响使得其相关性减弱。WED 与年龄、年龄与f都有着强相关性,因而可以建立f与年龄间的回归模型快速计算SSDEWED,以更准确地对辐射剂量进行衡量。
本研究也存在以下局限性:① 本数据仅在1 台CT设备上采集,其有效性未在更多设备上进行验证;② 对于管电压的使用以6 岁为分界点,有待于对图像进行客观评价后进一步得出更合理、更具科学性的分界点;③ 对于小于3 月患儿样本数较少,加之新生儿头颅大小随年龄变化速度较快,回归模型对其适用性需进一步验证;④ 仅研究了扫描范围内的SSDEWED,未对更真实反映患儿吸收辐射的有效剂量进行分析,今后可进一步研究。
综上所述,CTDIvol未考虑检查部位因素对辐射剂量的影响,使得其对6 月龄内幼儿低估辐射而对于大于6 月龄幼儿及儿童高估辐射。而SSDEWED同时考虑了扫描参数及检查部位对X 射线衰减对辐射剂量的影响,且其具有更小的标准差(6 月龄内幼儿除外)、变异系数、全范围及四分位间距,可以更准确可靠地衡量儿童头颅CT 检查辐射剂量。通过建立f与年龄间的回归模型,有助于儿童患者较少的医疗机构确定儿童头颅CT 检查辐射剂量标准。

