非洲猪瘟病毒数字PCR检测方法的建立及比较
赵晓娜,谭笑,朱忠武,周萍,祝贺,陆冠亚,史敏,沈炜,唐泰山*,祝长青,孔繁德
(1. 南京海关,江苏 南京 210019;2. 长沙海关,湖南 长沙 410004;3. 南京晓庄学院,江苏 南京 211171;4. 厦门海关,福建 厦门 361013)
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)引起的猪急性接触性传染病,以全身出血、呼吸障碍和神经症状为主要特征,其感染导致的发病率和死亡率可高达100%,对生猪养殖行业危害极大[1]。ASF是世界动物卫生组织(WOAH)法定报告的动物疫病,我国将其列为一类动物疫病。
目前,ASFV实验室检测方法主要有血清学和分子生物学方法。血清学方法主要包括酶联免疫吸附试验(ELISA)、直接荧光试验(FAT)和间接免疫荧光试验(IFA)等[2],分子生物学方法主要为PCR、荧光PCR、数字PCR等[3]。PCR技术简单方便,但是灵敏度不够。荧光PCR技术更为灵敏,但常遇到样品病毒含量低,Ct值较大而不能确认检测结果的情况。数字PCR(ddPCR)技术,作为一种核酸检测绝对定量的新技术,与荧光PCR相比,具有可检测痕量病毒样品、灵敏度高、特异性强的优点[4]。目前,该技术已经在医学诊断、病原体检测、食品安全等越来越多的领域得到应用[5-7]。
本研究在之前建立的荧光PCR方法基础上,建立和优化了可用于定量检测ASFV的数字PCR方法。
1 材料与方法
1.1 主要材料
猪伪狂犬病病毒(PRV)、猪圆环病毒2型(PCV-2)、猪繁殖与呼吸综合征病毒(PRRSV)、猪瘟病毒(CSFV)、猪流感病毒(SIV)毒株由本课题组保存;猪水泡病病毒(SVDV)核酸由广州千寻生物公司生产;ASFV阳性猪肉样品核酸由本课题组保存。
1.2 试验方法
1.2.1 引物和探针的设计和筛选
从GenBank中下载74株ASFV的全基因序列,其中来自非洲21株,欧洲41株,亚洲12株,含11个基因型,其中基因Ⅰ型22株,基因Ⅱ型33株。用DNAStar软件进行同源性分析,选取同源性较高的CP2475L、B602L基因作为目的片段,用Primer Express 3.0软件设计3套数字PCR引物和探针C1、C2、B1,其中探针的5′ 端标记FAM,3′ 端标记BHQ1(表1)。所有引物与探针由南京金斯瑞公司合成。
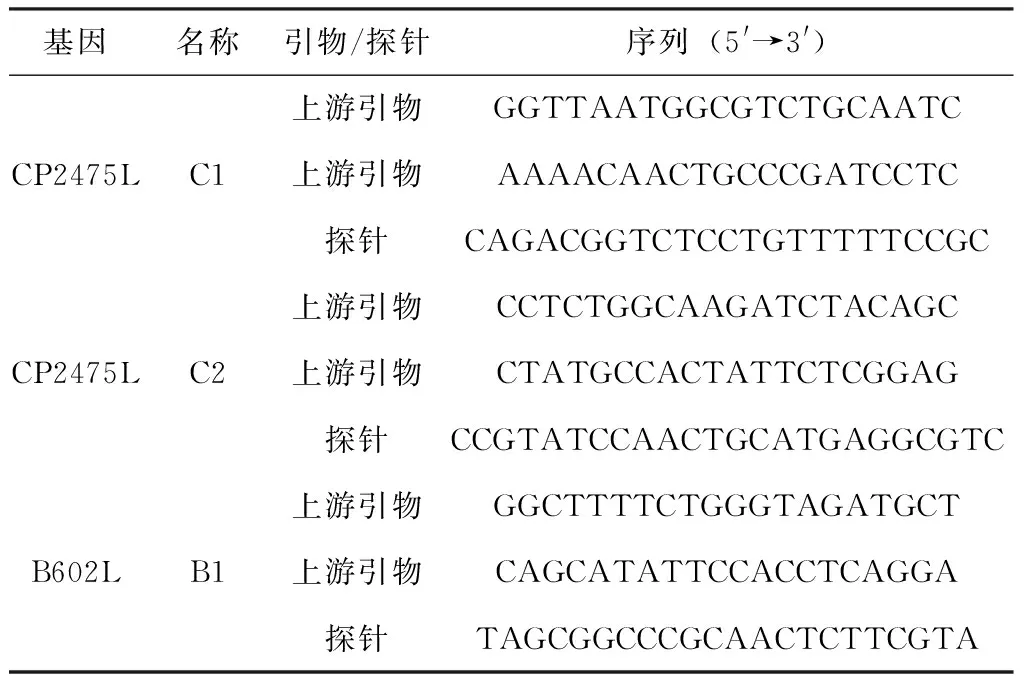
表1 数字PCR引物和探针
1.2.2 荧光PCR扩增
选取不同来源的ASFV核酸8份作为模板进行荧光PCR扩增,荧光PCR反应体系为:qPCR Master Mix(Applied Biosystems)12.5 μL,上下游引物(20 μmol/L)各0.5 μL,TaqMan探针(20 μmol/L)0.125 μL,DNA模板5 μL,补水至25 μL。扩增程序为预变性95 ℃ 10 min;95 ℃ 15 s,60 ℃ 1 min,扩增40个循环。筛选到C1用于下一步的试验。
1.2.3 荧光PCR特异性和灵敏度
制备ASFV、PRV和PCV-2的DNA,以及PRRSV、CSFV、SIV和SVDV的cDNA,制备家猪、野猪、牛、羊、鸡样品核酸作为动物组织背景,进行荧光PCR扩增,验证方法的特异性。
取ASFV核酸,用C2上游引物、C1下游引物进行PCR扩增,扩增目的片段大小为1 535 bp,是CP2475L基因的长片段,可用于2种引物的特异性和灵敏性检测。用PCR产物纯化试剂盒(TaKaRa)对PCR产物进行纯化,测序比对确认序列的准确性。双链DNA用超微量分光光度计进行定量,计算拷贝数后进行10倍倍比稀释。取10倍倍比稀释的双链DNA进行荧光PCR扩增,测试方法的灵敏度。
1.2.4 数字PCR体系和反应条件
在C1荧光PCR方法的基础上建立数字PCR方法,其过程包括体系配置、微滴生成、PCR扩增、读取微滴。配置反应体系:2×Supermix for Probes(Bio Rad)10 μL,上、下游引物终浓度为0.9 μmol/L,探针终浓度为0.25 μmol/L,模板1 μL,补水至20 μL。转移20 μL反应液至微滴生成卡,在生成卡对应位置加入70 μL微滴生成油,在微滴生成仪中生成微滴。随后转移微滴至96孔PCR反应板,封膜后置于PCR仪中扩增,反应条件为:95 ℃ 10 min;95 ℃ 15 s,退火/延伸1 min,40个循环;98 ℃ 10 min。扩增结束后,用微滴读取仪(Bio-Rad,QX200)读取微滴荧光信号,在QuantaSoft Droplet Reader 软件(V1.7.4)中分析结果。
1.2.5 数字PCR特异性和灵敏度
取上述7种病毒核酸,5种动物组织核酸(同1.2.3),进行数字PCR扩增,观察阳性微滴的分布及荧光信号强度,判断数字PCR方法的特异性。
取10倍倍比稀释后浓度范围为104~10-1copies/μL的双链DNA作为模板,每个浓度设立3个重复,测试方法的灵敏度,绘制标准曲线并进行线性分析。
1.2.6 空白检测线(LOB)与最低检测线(LOD)测定
参考美国临床实验室标准化委员会标准和测定指南(NCCLS EP17-A2)[8],用数字PCR对6份阴性样品进行60次检测,测定数字PCR的LOB;对4份含低拷贝ASFV核酸的样品进行40次检测,每个反应中ASFV核酸含量为2~3 copies,测定数字PCR的LOD。
1.2.7 临床样品检测
收集50份不同来源的猪组织或含猪组织样品,分别用建立的数字PCR、C1荧光PCR方法及WOAH荧光PCR、WOAH常规PCR方法进行检测[9],比较分析不同方法的检测结果。
2 结果
2.1 引物探针筛选
用设计的3套引物探针对不同来源样品的ASFV核酸进行荧光PCR扩增。荧光PCRCt值C2与C1相差1.1±0.6,B1与C1相差0.7±0.6,选择C1进行后续试验(表2)。
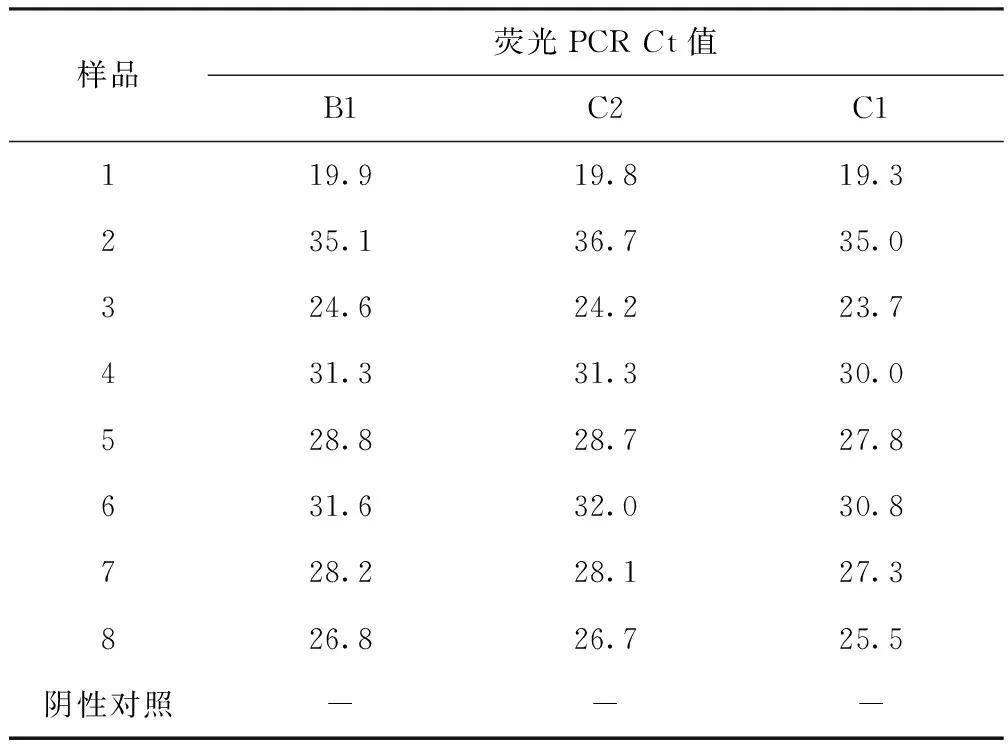
表2 3套引物探针初筛试验(n=8)
2.2 荧光PCR灵敏度和特异性
以PRV、PCV-2、ASFV基因组DNA,PRRSV、CSFV、SIV、SVDV的cDNA以及家猪、野猪、牛、羊、鸡基因组DNA作为模板,进行荧光PCR扩增,发现仅有ASFV出现特异性扩增曲线,其他均没有扩增曲线。
用C1体系扩增浓度为6×108~6×100copies/μL双链DNA,发现稀释到6 copies还能扩增出特异性曲线,其中浓度为6×108~6×100copies/μL扩增的Ct值依次为9.27、12.97、16.55、20.10、23.82、27.43、31.01、34.76、38.58,Ct值和双链DNA拷贝数的对数相关性方程为Y=-3.64X+40.99,R2=0.999(图1),呈现良好的线性关系。
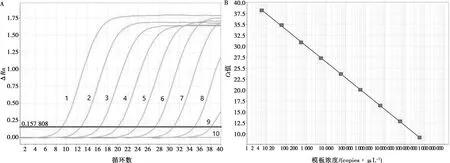
1~9. 分别为模板DNA的拷贝数6×108~6×100 copies/μL;10. 阴性对照。图1 C1荧光PCR的扩增曲线(A)和标准曲线(B)
2.3 数字PCR条件优化
设置3个引物探针浓度组,第1组为(0.65 +0.150)μmol/L,第2组为(0.9 +0.25)μmol/L,第3组为(1.2 +0.35)μmol/L,以相同浓度的双链DNA作为模板进行数字PCR。结果显示第2组和第3组的阳性微滴荧光值与本底之间的差值较大,第2组的阳性微滴产生数量最多,则最佳PCR引物和探针浓度分别为0.9 μmol/L和0.25 μmol/L。
以相同浓度的双链DNA作为模板,在55~62 ℃之间摸索数字PCR反应最佳退火温度,8组退火温度设定为55、55.5、56.5、57.8、59.4、60.7、61.6和62 ℃。结果显示,随着温度升高,阳性微滴荧光值不断降低,综合分析选择退火温度为60 ℃(图2)。

A01~H01. 依次为62、61.6、60.7、59.4、57.8、56.6、55.5和55 ℃。图2 退火温度优化结果
2.4 数字PCR特异性和线性分析
通过对7种病毒核酸和5种动物组织核酸进行的特异性试验,显示仅ASFV检测孔出现阳性微滴,PRV、PCV-2、PRRSV、CSFV、SIV、SVDV以及家猪、野猪、牛、羊、鸡均无阳性微滴(图3),表明建立的数字PCR方法有很好的特异性。
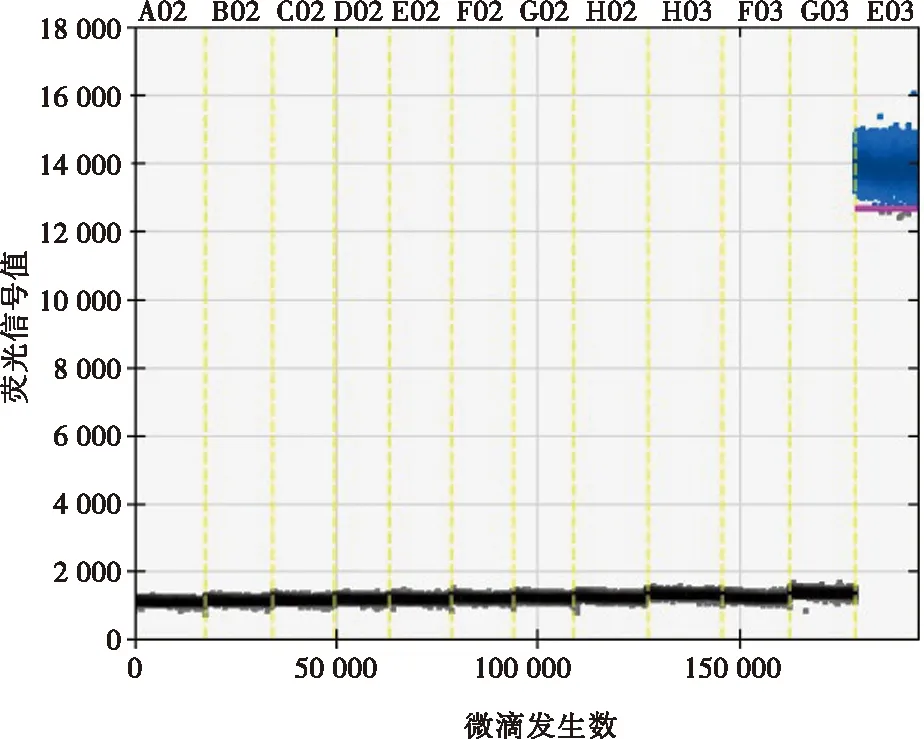
A02~G03. 依次为PRV、PCV-2、PRRSV、CSFV、SIV、SVDV,家猪、野猪、牛、羊和鸡的组织;E03. ASFV。图3 数字PCR特异性试验
以倍比稀释的双链DNA作为模板进行数字PCR,结果显示线性回归系数R2=0.999,变异系数均小于3%,ASFV计算拷贝数与实际检测拷贝数呈现出很好的线性关系(图4,图5),表明其具有较好的重复性(表3)。

B05、D05. 阴性对照;C06~C07. 1 copies·μL-1;B08~D08. 10 copies·μL-1;B09~D09. 1 00 copies·μL-1;B10~D10. 1 000 copies·μL-1。图4 数字PCR的线性分析结果
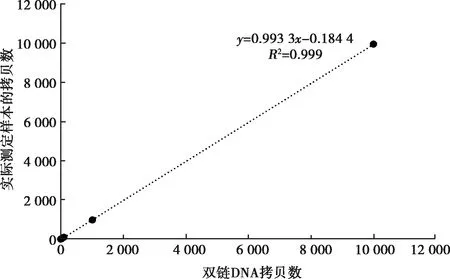
图5 数字PCR标准曲线

表3 ASFV ddPCR 重复性试验
2.5 LOB与LOD
以ASFV核酸作为阳性对照,60次阴性样本检测中基本无阳性微滴检出,根据NCCLS EP17-A指南,经统计分析可得数字PCR方法的LOB为1.6 copies/μL。为确定方法的LOD,分3次试验对4个低拷贝样品进行了40次检测。根据EP17-A的指南,统计分析得出数字PCR方法的LOD为3 copies/μL。临床检测中样品拷贝数低于1.6 copies/μL,即可判为阴性,高于3 copies/μL可判为阳性,介于两者之间,需要重新取样或者提高核酸浓度进行确认。
2.6 临床样品检测
提取50份不同来源的临床样品核酸,用建立的数字PCR、C1荧光PCR方法以及WOAH荧光PCR、WOAH常规PCR方法对样品进行检测。前3种方法均从样品中检出12份ASFV核酸,38份样品未检出ASFV核酸;WOAH常规PCR方法从样品中检出8份ASFV核酸(表4)。WOAH荧光PCR与C1荧光PCRCt值差值为2.2±1.9(n=12)。
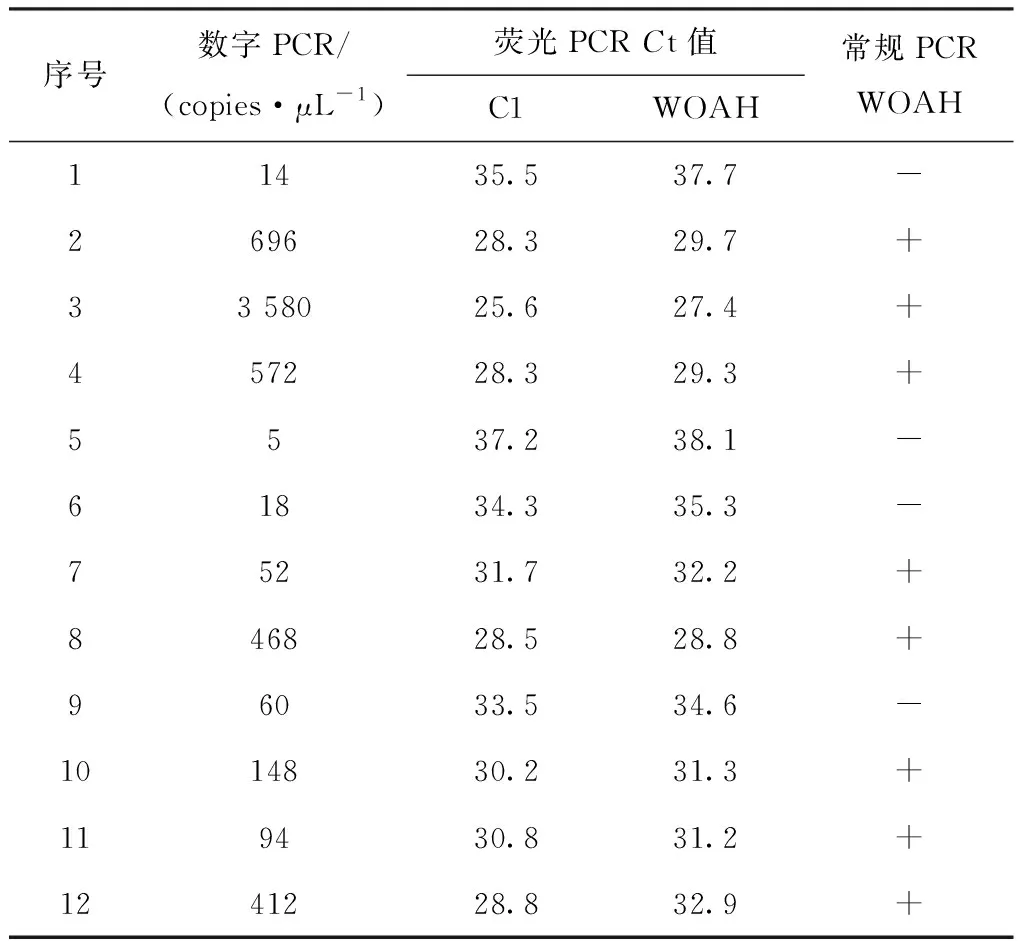
表4 阳性样品不同检测方法比较
3 讨论
数字PCR是20世纪90年代末发展起来的一种核酸分子绝对定量技术[10],灵敏度高,可对核酸进行绝对定量,常用于病原体检测、动物源性成分检测、转基因检测等。在非洲猪瘟检测应用方面,邬旭龙等[11]针对K205R基因建立ASFV 数字PCR检测方法;原霖等[12]在WOAH荧光PCR方法的基础上建立数字PCR方法;严礼等[13]在WOAH荧光PCR方法、团体标准T/CVMA5—2018荧光PCR方法基础上建立数字PCR方法,并与邬旭龙等[11]建立的方法进行比较。
本研究基于74株ASFV病毒全基因组序列分析,选择CP2475L基因保守区段建立数字PCR方法。ASFV CP2475L基因位于基因组较为保守的C区,编码pp220蛋白,pp220相对分子量为281.5 kDa,属于病毒感染中的晚期蛋白,是构成病毒粒子核衣壳的主要成分[14],目前未见以CP2475L基因作为靶基因的ASFV PCR检测方法。分析引物探针与74株ASFV基因序列同源性发现,共计4个位置碱基有错配的情况发生,WOAH荧光PCR引物探针有8个位置碱基发生错配,引物和探针结合区的错配可能会导致假阴性。2019年,越南研究人员Truong等[15]发现WOAH推荐的荧光PCR探针结合位点的单个错配导致其在ASFV的临床诊断中出现漏检,研究人员将WOAH探针21位的碱基C换成Y,WOAH荧光PCR检测结果为阴性的样品用改进后的方法检出ASFV核酸[16]。
根据WOAH手册,ASFV荧光PCRCt值小于40的样品判为阳性,但在实际临床应用中,Ct值大于35的样品经常会出现扩增曲线不明显,难以判定结果的情况。在应用建立的数字PCR方法进行临床样品检测中发现,阳性样品的C1荧光PCRCt值均低于WOAH荧光PCR检测Ct值;Ct值介于35~40之间且扩增曲线不明显的样品,数字PCR检测拷贝数大于LOD,可判定为阳性。因此本研究建立的ASFV 数字PCR方法在含低拷贝ASFV的样品确认上具有一定优势,对非洲猪瘟的高效防控和口岸动物疫病检测具有十分重要的意义。

