基于PI3K/AKT1 通路探讨山西老陈醋对高脂饮食诱导大鼠抗氧化作用机制
申 彤,刘佳佳,陈 嘉,庞全海,
(1.山西农业大学动物医学学院,山西晋中 030801;2.山西农业大学食品科学与工程学院(农产品贮藏保鲜研究所),山西太原 030031)
高脂血症通常由长期高脂饮食所致,表现为外周血中脂质水平异常[1],肝脏脂代谢紊乱,肝细胞变性[2],可引发一系列心血管疾病[3]。山西老陈醋是中国传统的全谷物固态发酵醋,发酵过程中形成了多酚、类黑素、益生菌等多种具有降脂抗氧化功效的有机物[4]。大量研究发现,山西老陈醋浓缩物可有效降低高脂血症小鼠的血脂水平[5],陈醋源乳杆菌通过改变肝脏脂肪酸的构成,改善高脂饮食大鼠肝脂质损伤[6]。进一步研究发现,山西老陈醋多酚提取物能有效减轻高脂血症大鼠的血脂异常和氧化应激[7]。截止目前,山西老陈醋改善高脂血症的作用机制及最适剂量范围尚不明确。
调节糖脂代谢相关通路是最常见的高脂血症防治手段[8]。研究表明脂代谢紊乱与磷脂酰肌醇3-激酶(Phosphatidylinositol 3-kinase,PI3K)异常表达密切相关[9]。PI3K 是细胞代谢关键调节因子,PIK3CA是其催化亚基的一种,蛋白激酶B(Protein kinase B,Akt1)作为PIK3CA 的下游靶标响应激活[10],PI3K/AKT1 信号转导途径通过调节甘油三酯合成关键酶的表达影响脂代谢[11],抑制该通路可改善氧化应激损伤[12],研究证实,食醋加工后的姜黄精油通过调节PI3K/AKT1 通路改善肝脏纤维化[13]。固态发酵醋多酚提取物通过抑制PI3K/AKT1 通路来调节脂代谢,减轻细胞氧化应激[14]。鉴于此,推测山西老陈醋可能通过调控PI3K/AKT1 通路相关基因表达,进而发挥预防高脂血症发生和发展的作用。
本研究通过构建高脂血症大鼠模型,并设置不同浓度山西老陈醋干预组,观察其对大鼠血清内脂质及肝脏相关生化指标的影响,研究山西老陈醋通过PI3K/AKT1 通路对高脂饮食诱导大鼠发挥的降脂抗氧化作用,为后期进一步探究其调控机制提供一定的试验基础。
1 材料与方法
1.1 材料与仪器
SPF 级雄性Wistar 大鼠 6 周龄,体重相近(170±20 g),斯贝福生物技术有限公司,许可证号:SCXK(京)2019-0010,饲养于山西农业大学实验动物中心(SYXK(晋)2020-0003),试验动物使用方案严格执行山西农业大学试验动物伦理委员会对动物试验伦理的要求(IACUC 审查号:SXAU-EAW-2020SD02 01);山西老陈醋 山西紫林醋业股份有限公司;玉米胚芽油 山东西王食品有限公司;吐温-80(T8360)、胆固醇(C8280)、胆酸钠(C1291697)、丙基硫氧嘧啶(P7161)、总RNA 提取试剂盒(R1200)、通用SP 检测试剂盒(SP0041)、RIPA 组织/细胞裂解液(R0020)、BCA 蛋白浓度试剂盒(PC0020)、山羊抗兔二抗及山羊抗鼠二抗(SE134、SE132)Solarbio 公司;甘油三酯(Triglyceride,TG,A110-1-1)、总胆固醇(Total cholesterol,TC,A111-1-1)、高密度脂蛋白(High-density lipoprotein cholesterol,HDL-C,A112-1-1)、谷丙转氨酶(Alanine aminotransferase,ALT,C009-2-1)、谷草转氨酶(Aspartate aminotransferase,AST,C010-2-1)、碱性磷酸酶(Alkaline phosphatase,AKP,A059-2)、谷胱甘肽还原酶(Glutathione reductase,GR,A062-1-1)、超氧化物歧化酶(Superoxide dismutase,SOD,A001-3)、总抗氧化能力(Total antioxidant capacity,T-AOC,A015-2-1)检测试剂盒 南京建成生物工程研究所;HiScript Ⅲ RT SuperMix for qPCR(R323)
诺唯赞生物;2×Realtime PCR Super mix 试剂盒(MF013)北京聚合美生物科技有限公司;抗PIK3CA兔多克隆抗体(bs-2067R)、抗AKT1 兔多克隆抗体(bs-0115R)、抗GAPDH 鼠单克隆抗体(bsm-33033M)北京博奥森生物有限公司。
B11-3 恒温磁力搅拌器 上海司乐仪器有限公司;ELX808 全自动酶标仪 BioTek Instruments 公司;UV-1200 紫外可见分光光度计 上海美谱达仪器有限公司;NanoDrop One/OneC 核酸蛋白检测仪 Thermo Fisher;T100 普通PCR 仪 美国Bio-Rad公司;LightCycler 96 荧光定量PCR 仪 Roche 生物科技有限公司;DYY-8C 电泳仪 北京六一生物科技有限公司;YD-6L 生物组织包埋机 金华市益迪医疗设备有限公司;DM4000 光学显微镜、RM2265轮转式切片机 徕卡显微系统(上海)有限公司。
1.2 实验方法
1.2.1 不同浓度山西老陈醋制备 山西老陈醋原醋为中浓度醋(2.7 g/(kg·bw));蒸馏水稀释至原体积2 倍即低浓度醋(1.35 g/(kg·bw));恒温50 ℃下使用磁力搅拌器将原醋浓缩至原体积1/2 即高浓度醋(5.4 g/(kg·bw))。
1.2.2 高脂饮食诱导大鼠模型构建 高脂乳剂由60%吐温-80,15%玉米胚芽油,6%胆固醇,2%胆酸钠,0.2%丙基硫氧嘧啶和16.8% H2O 配制而成(图1),造模5 周[15]。

图1 高脂乳剂制作流程Fig.1 Production process of high fat emulsion
1.2.3 试验动物分组及样品采集 选取30 只6 周龄健康状况良好SPF 级大鼠,适应性饲喂1 周,根据每组间平均体重相近原则,随机分为5 个试验组(n=6):正常组(C,常规饲料)、高脂模型组(M,高脂乳剂)、1.35 g/(kg·bw)陈醋干预M 组(LV)、2.7 g/(kg·bw)陈醋干预M 组(V)、5.4 g/(kg·bw)陈醋干预M 组(HV)。正常组各大鼠2.0 mL/d 生理盐水持续灌胃10 周,试验组高脂乳剂10 mL/kg·d 灌胃5 周后生理盐水继续灌胃5 周,山西老陈醋灌胃组各大鼠陈醋(2.0 mL/d)及高脂乳剂(10 mL/kg·d)灌胃5 周后使用陈醋继续灌胃(2.0 mL/d)5 周。于温度(22±2 ℃)、湿度(50%±5%)标准动物房内常规饲料喂养,自由采食。
11 周试验结束后,禁食16 h,乙醚麻醉,腹主动脉采血,全血样本室温2 h,4 ℃ 2 h,3000 r/min 离心15 min,取血清于-80 ℃保存。采集各组大鼠同一位置肝脏组织,4%多聚甲醛固定,剩余组织-80 ℃保存。
1.2.4 不同试验组大鼠血清中脂质含量、抗氧化及肝功能检测 根据说明书,使用酶标仪和紫外分光光度计检测各组大鼠血清中TC、TG、HDL-C 含量,SOD、GR、T-AOC 酶活性,ALT、AST、AKP 的酶活力单位,M 组与C 组血脂含量(TC、TG、HDL-C)有统计学差异即为造模成功[16]。
1.2.5 不同试验组大鼠肝脏组织病理学检测 大鼠肝组织4%多聚甲醛固定24 h 后,取出修块,经常规脱水、透明、浸蜡、包埋、切片(厚度5 μm)后,苏木素-伊红(HE)染色,中性树胶封片,在200 倍光学显微镜下观察组织病理变化。
1.2.6 不同试验组大鼠肝脏中PI3K/AKT1通路mRNA 水平表达检测 根据NCBI(https://www.ncbi.nlm.nih.gov)上检索的大鼠PIK3CA、AKT1和GAPDHCDS 区,利用Primer Premier 3.0 分别设计3 对特异性引物(表1),由上海生工生物工程股份有限公司合成。

表1 引物序列信息Table 1 Primer sequence information
总RNA 提取试剂盒提取各组大鼠肝脏总RNA,核酸蛋白检测仪测定浓度和纯度,根据HiScript ⅢRT SuperMix for qPCR 说明书逆转录RNA 为cDNA。相对荧光定量法(qRT-PCR)检测大鼠肝脏中PIK3CA、AKT1mRNA 表达,根据2×Realtime PCR Super mix试剂盒说明构建反应体系(20 μL):2×Realtime PCR Super mix 10 μL、cDNA 模板2.0 μL、正反向引物各0.5 μL、ddH2O 7.0 μL,每个指标重复3 次;设置反应程序:94 ℃预变性5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,循环40 次;72 ℃ 5 min。利用2-ΔΔCT法计算不同实验组大鼠肝脏中PIK3CA及AKT1mRNA水平表达。
1.2.7 不同实验组大鼠肝脏中PI3K/AKT1 通路蛋白水平表达检测 使用组织裂解液(含PMSF)提取不同试验组大鼠肝脏组织总蛋白,4 ℃ 14000 r/min离心10 min,BCA 试剂盒检测蛋白浓度。SDSPAGE 电泳时,上样量为50 μg/孔,100 ℃水浴变性5 min,按照10%分离胶80 V 20 min,5%浓缩胶120 V 60 min 电泳,200 mA 60 min 恒流湿转至NC膜,5%脱脂奶粉室温摇床封闭2 h,TBST 洗膜5 次,抗PIK3CA 兔多克隆抗体及抗AKT1 多克隆抗体(1:300)、抗GAPDH 鼠单克隆抗体(1:5000)4 ℃孵育过夜(12~16 h),移去一抗,山羊抗鼠二抗及山羊抗兔二抗(1:15000)室温孵育1 h,TBST 漂洗5 次,ELC Plus 超敏发光液显色,ImageJ 8.0 分析蛋白免疫印迹灰度值。
1.2.8 不同试验组大鼠肝脏中PI3K/AKT1 通路定位分析 取前期烘干备用且组织完整的切片,按照通用SP 检测试剂盒步骤依次进行脱蜡,柠檬酸钠缓冲液抗原修复,过氧化氢酶灭活,非特异性抗原位点封闭,抗PIK3CA 兔多克隆抗体及抗AKT1 多克隆抗体(1:100)4 ℃孵育过夜,复温后,PBS 漂洗,室温孵育二抗,PBS 漂洗,DAB 显色,蒸馏水终止反应,苏木素复染,盐酸酒精分化,常规脱水后中性树胶封片,光学显微镜下观察,Image-Pro Plus 6.0 进行光密度值分析。
1.3 数据处理
使用Graphpad Prism 8.3.0 分析作图,所有数据以平均数±标准差(±SD)表示,采用单因素方差分析,两两比较采用独立t检验。P<0.01 作为差异极显著的界值,P<0.05 作为差异显著的界值。
2 结果与分析
2.1 不同试验组大鼠血清中脂质含量、抗氧化活性及肝损伤指标检测结果
2.1.1 血清脂质含量检测结果 高脂饮食会导致大鼠体内脂质过度沉积,脂代谢紊乱,引发高脂血症,显著特征是血清内TC,TG 含量升高,HDL-C 含量低于正常值[17]。如图2 所示,与C 组相比,M 组TC 及TG 极显著增加(P<0.01),HDL-C 极显著降低(P<0.01),说明,高脂血症大鼠模型构建成功[16];与M 组相比,HV、MV 和LV 组TC 及TG 均极显著降低(P<0.01),HDL-C 极显著升高(P<0.01);与LV 组相比,HV 和MV 组TC 及TG(极)显著降低(P<0.05,P<0.01),HDL-C 极显著升高(P<0.01);与MV 组相比,HV 组HDL-C 显著升高(P<0.05),TC、TG 差异不显著(P>0.05),结果表明,不同剂量山西老陈醋均可改善高脂饮食引起的脂代谢紊乱,中高剂量组改善效果优于低剂量组。

图2 各组大鼠血脂变化情况Fig.2 Changes in blood lipids of rats in each group
2.1.2 抗氧化酶活性检测结果 血清内脂质升高,会导致氧自由基(Reactive oxygen species,ROS)增加,使机体发生一定程度的脂质过氧化,T-AOC 表示机体内总抗氧化能力,SOD 和GR 是氧自由基清除剂[18]。如图3 所示,与C 组相比,M 组SOD、GR 及T-AOC 均极显著降低(P<0.01),说明脂质堆积使大鼠机体抗氧化酶系统紊乱;与M 组相比,HV、MV和LV 组SOD 和T-AOC 均(极)显著升高(P<0.05,P<0.01),MV 和HV 组GR 极显著升高(P<0.01),LV 组GR 无显著差异;与LV 相比,HV 组SOD 及GR 均极显著升高(P<0.01),MV 组T-AOC 和GR(极)显著升高(P<0.05,P<0.01);与MV 组相比,HV 组SOD 极显著升高(P<0.01),T-AOC 极显著降低(P<0.01),GR 无显著差异(P>0.05),结果表明,山西老陈醋可提高机体抗氧化能力,降低高脂饮食大鼠氧化应激水平。


图3 各组大鼠血清内抗氧化酶活性Fig.3 Antioxidant enzyme activities in serum of rats in each group
2.1.3 肝损伤指标检测结果 血清内ALT 和AST含量升高是肝细胞受损的重要标志,AKP 含量和肝损伤的程度呈负相关[19]。如图4 所示,与C 组相比,M 组ALT 及AST 均极显著升高(P<0.01),AKP 极显著降低(P<0.01),说明血脂过高使肝细胞受损,使细胞质内ALT 和AST 释放至血液内[20],AKP 合成减少;与M 组相比,HV、MV 和LV 组ALT 及AST均极显著降低(P<0.01),AKP 均极显著升高(P<0.01);与LV 组相比,MV 和HV 组ALT 及AST 均(极)显著降低(P<0.05,P<0.01),AKP 极显著升高(P<0.01);与MV 组相比,HV 组AST 极显著降低(P<0.01),ALT 及AKP 无显著差异(P>0.05),结果表明,山西老陈醋对肝脏具有一定保护作用,可有效减轻高脂饮食诱发的肝脂质损伤。

图4 各组大鼠血清内肝功能指标Fig.4 Serum liver function indexes of rats in each group
2.2 肝脏组织病理学检测结果
HE 染色结果显示(图5),与C 组相比,M 组肝索排列紊乱,肝细胞脂肪变性及空泡样变增多,肝细胞肿胀,细胞核移位,胞浆内出现致密且较大的脂滴空泡;与M 组相比,LV 组、MV 组、HV 组细胞变性及脂滴空泡明显减少,HV 组和MV 组干预效果优于LV 组,结果表明,山西老陈醋可有效改善大鼠肝脏脂肪蓄积现象,缓解肝组织病变。

图5 各组大鼠肝脏组织HE 染色结果(20×)Fig.5 HE staining results of liver tissue of rats in each group (20×)
2.3 山西老陈醋对各组大鼠PIK3CA、AKT1 mRNA水平表达的影响
qRT-PCR 检测结果显示(图6),与C 组相比,M 组PIK3CA及AKT1mRNA 水平表达均极显著升高(P<0.01),说明大鼠脂代谢异常导致肝脏内PI3K/AKT1 信号传导通路被激活;与M 组相比,LV、MV 和HV 组PIK3CA及AKT1mRNA 水平表达均极显著降低(P<0.01);与LV 组相比,MV 和HV 组PIK3CA及AKT1mRNA 水平表达均极显著降低(P<0.01);与MV 组相比,HV 组PIK3CA及AKT1mRNA 水平表达无显著差异(P>0.05),结果表明,山西老陈醋可显著改善高脂饮食诱发大鼠肝脏内PIK3CA及AKT1基因表达异常。

图6 各组大鼠肝脏PIK3CA 及AKT1 mRNA 相对表达量Fig.6 Relative expression levels of PIK3CA and AKT1 mRNA in liver of rats in each group
2.4 山西老陈醋对各组大鼠PIK3CA、AKT1 蛋白水平表达的影响
Western blotting 检测结果显示(图7),与C 组相比,M 组PIK3CA 及AKT1 蛋白表达均极显著升高(P<0.01),说明肝脂质蓄积使大鼠肝脏内PIK3CA及AKT1 蛋白表达异常;与M 组相比,HV、MV 和LV 组PIK3CA 及AKT1 蛋白表达极显著降低(P<0.01);与LV 组相比,HV 和MV 组PIK3CA 及AKT1蛋白表达均极显著降低(P<0.01);与MV 组相比,HV 组PIK3CA 蛋白表达极显著降低(P<0.01),AKT1 表达无显著差异(P>0.05),结果表明,山西老陈醋可有效抑制高脂血症大鼠肝脏内PIK3CA 及AKT1 蛋白表达。

图7 各组大鼠肝脏PIK3CA 及AKT1 蛋白相对表达量Fig.7 Relative expression levels of PIK3CA and AKT1 proteins in liver of rats in each group
2.5 山西老陈醋对各组大鼠PIK3CA、AKT1 定位的影响
免疫组化分析结果显示(图8),各组大鼠肝脏细胞核和细胞质中均有PIK3CA 和AKT1 表达,与C 组相比,M 组PIK3CA 及AKT1 表达极显著升高(P<0.01)。与M 组相比,HV、MV 和LV 组PIK3CA及AKT1 表达极显著降低(P<0.01),与LV 组相比,HV 和MV 组PIK3CA 与AKT1 表达(极)显著降低(P<0.05,P<0.01),结果表明,山西老陈醋通过抑制大鼠肝脏PIK3CA 及AKT1 的表达进而调控PI3K/AKT1 通路。

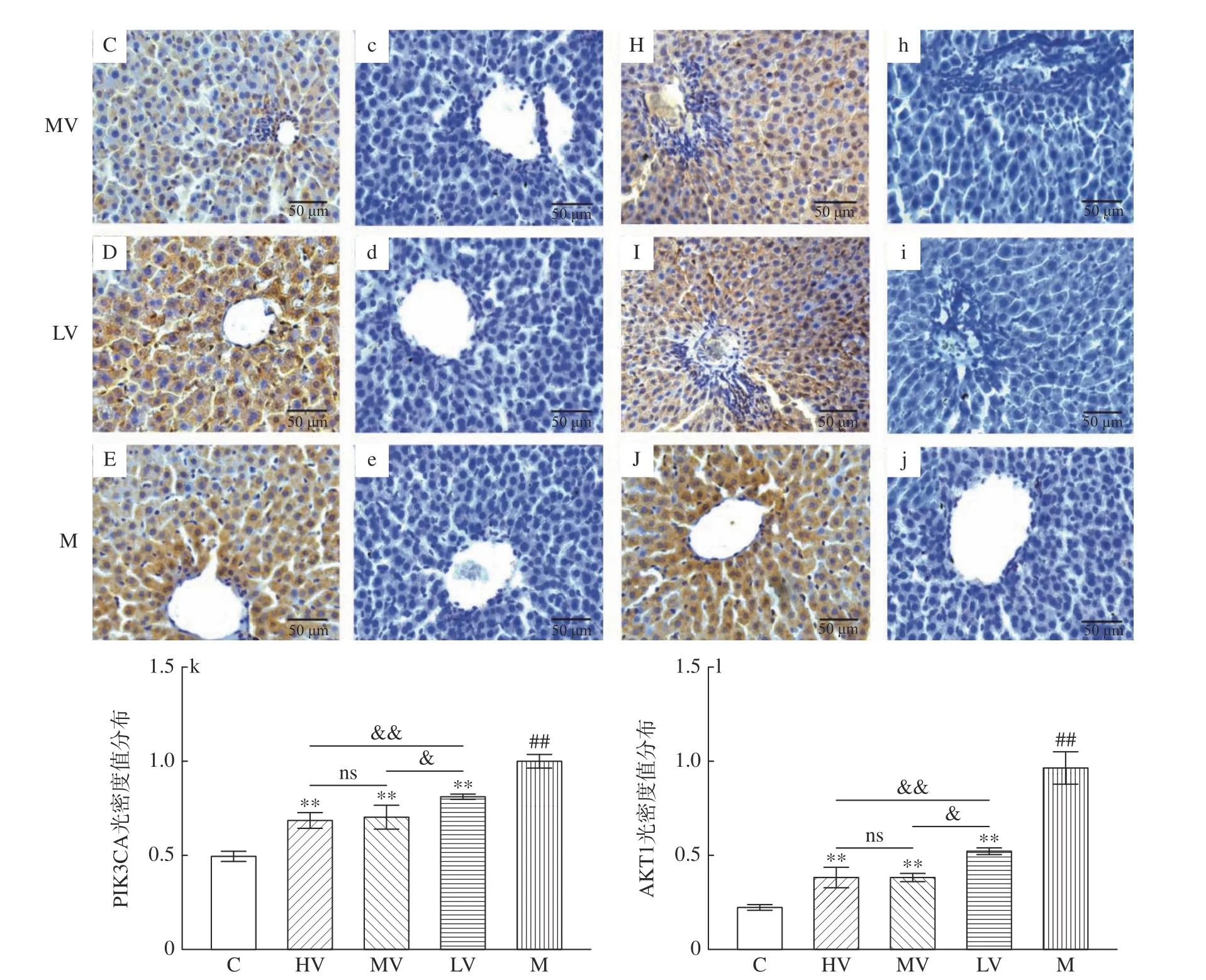
图8 PIK3CA、AKT1 免疫组化结果及光密度分析(20×)Fig.8 IHC results and optical density analysis of PIK3CA and AKT1 (20×)
3 讨论与结论
目前,高脂血症的治疗主要以中药和膳食辅助治疗为主[21],山西老陈醋富含多种活性物质,可调节血脂保护肝脏[22]。研究证实,山西老陈醋可以降低醉酒小鼠肝功酶活性[19],提取的多酚通过抑制TC、TG 分泌调节脂代谢[23]。本次研究中,高脂血症大鼠体内PI3K/AKT1 信号转导途径被激活,不同剂量山西老陈醋均可抑制该通路。PI3K/AKT1 通路参与胆固醇的摄入与转导,调控该通路及其下游脂质合成基因表达[11],可调节脂代谢。研究结果表明,山西老陈醋可能通过下调PIK3CA 及AKT1 基因和蛋白的表达,改善高脂饮食诱发的血脂水平、肝功酶活性异常和肝脏病理性损伤,且浓度为2.7 和5.4 g/(kg·bw)山西老陈醋对血脂、肝功酶水平异常和肝脂肪性病变改善效果均优于1.35 g/(kg·bw)低剂量干预组,中高剂量组改善效果无显著差异。
高脂血症通常伴随着氧化应激的发生,高脂饮食诱导脂质积累,肝脏脂代谢紊乱[24],游离脂肪酸堆积,肝细胞脂肪变性,抗氧化酶系统紊乱,过量产生的ROS 无法被清除,引发氧化应激损伤[25],研究证实山西老陈醋多酚类提取物具有强抗氧化活性[26],陈醋源类黑素通过调控AKT 信号传导途径影响ROS生成[27]。本次研究结果表明,山西老陈醋通过提高抗氧化酶活性,增加大鼠抗氧化能力。PI3K/AKT1 信号转导途径与多种细胞氧化应激密切相关[28],可通过调节ROS 的生成调节氧化应激[29],进一步研究发现多种活性物质均可通过抑制PI3K/AKT1 的表达来改善氧化应激[30-31],本次研究结果显示,干预组大鼠肝脏内PIK3CA 及AKT1 在基因和蛋白水平上均显著下降,说明山西老陈醋改善氧化应激可能是通过抑制PI3K/AKT1 的表达来实现的,且2.7 g/(kg·bw)和5.4 g/(kg·bw)山西老陈醋干预组抗氧化及抑制PI3K/AKT1 通路能力最为显著。进一步研究发现山西老陈醋浓缩物的降脂作用,优于陈醋原液[5]。这可能是由于山西老陈醋内富含的有机物均具有挥发性[32],浓缩过程中以乙酸为主的有机酸[33]和黄酮类物质损失量最大[34],且本研究中,高剂量组浓度及大鼠摄入量均高于前人研究,综上推测,山西老陈醋的最适浓度可能在2.7~5.4 g/(kg·bw)之间。
综上,不同剂量山西老陈醋均可改善高脂血症大鼠的脂代谢紊乱和氧化应激损伤,高脂饮食诱导大鼠体内PI3K/AKT1 通路高度活化,山西老陈醋干预下肝脏内PI3K/AKT1 通路受到不同程度抑制,浓度为2.7~5.4 g/(kg·bw)山西老陈醋改善效果最佳。由此,本研究推测山西老陈醋可能通过抑制PI3K/AKT1 通路,进而改善高脂血症大鼠抗氧化应激和脂代谢紊乱的能力,但其靶向抑制PI3K/AKT1 信号通路的机制尚不明确,有待进一步研究。

