自体脂肪微片段治疗膝关节骨性关节炎的疗效观察
王 成,卢 超
(1.广州中医药大学金沙洲医院骨科,广东 广州 510080 ;2.广东省第二中医院,广东 广州 510095)
膝关节骨性关节炎(Knee osteoarthritis,KOA)是一种发病率很高的关节退行性疾病,可导致软骨、软骨下骨损伤和滑膜炎症[1]。此病的发生通常被认为与生物力学及生物学改变导致的膝关节退变密切相关[2]。KOA软骨损伤的修复一直是临床上的热点话题。临床上对轻中度KOA 主要是采取保守治疗,常用的治疗方式有健康管理、口服药物及关节腔内注射药物治疗,往往能取得一定短期的疗效[3],却难以延缓KOA 的进展。透明质酸(Hyaluronic acid,HA)是一种糖胺聚糖,可发挥镇痛、润滑关节的作用。虽然目前对HA 注射在KOA 治疗中的作用尚存争议,但其仍是目前临床上最常使用的治疗技术之一。近几年,随着干细胞技术的发展,研究人员发现间充质干细胞可用于KOA的治疗,且此治疗技术越来越受到重视,目前已成为研究热点。脂肪间充质干细胞(Adipose mesenchymal stem cells,ADMSCs)是众多间充质干细胞中的一种,其具有取材容易、来源充足、可反复取材等多种优点。本研究中通过利百健技术制备的自体脂肪微片段中就含有丰富的ADMSCs、周细胞、生长因子、基质血管组分等。有研究指出,使用自体脂肪微片段促进软骨再生具有操作简便、安全等优势[4]。本研究通过观察采用关节腔内注射自体脂肪微片段及注射HA 治疗KOA 后患者症状和关节功能的改善情况来评价和对比两种治疗方式的相关临床疗效。
1 资料与方法
1.1 一般资料
选 择2019 年3 月 至2022 年3 月 于 我 院 骨 科就诊的早中期KOA 患者50 例作为研究对象,所有患者的诊断均符合《KOA 分类标准》中的诊断标准[5]。按照随机数字表法将其分为试验组与对照组,每组25 例。试验组:男性12 例,女性13 例;年龄55 ~85 岁,平均年龄(69.08±7.27)岁。对照组;男性13 例,女性12 例;年龄55 ~82 岁,平均年龄(70.40±7.45)岁。两组患者的性别组成比例无明显差异(P=0.777 >0.05),年龄无明显差异(P=0.529 >0.05),两组患者具有可比性,见表1。

表1 两组患者的性别和年龄分布
1.2 纳入与排除标准
纳入标准:(1)存在经磁共振成像(MRI)证实的原发性或继发性单侧、双侧有症状的膝关节OA;(2)X 线检查显示膝内侧有间隙变窄或内翻畸形;(3)至少有1 次保守治疗(口服止痛药物、物理治疗等)失败(治疗3 个月以上)的情况;(4)年龄55 ~85 岁,能够配合研究。排除标准:(1)膝关节K-L 分级在3级以上;(2)存在类风湿关节炎;(3)对局部麻醉过敏;(4)存在活动性恶性肿瘤;(5)存在注射部位活动性膝关节或皮肤感染;(6)存在可能影响研究配合及结果的因素;(7)未获得完整随访。
1.3 治疗方法
1.3.1 试验组治疗(自体脂肪微片段注射) (1)抽脂:选择下腹部或侧腹部作为抽脂部位。使用17G 一次性钝套管注射器向该部位注射适量的肾上腺素+2%甲哌卡因+生理盐水。然后使用13G 钝套管连接20 mL的注射器,抽取脂肪组织。(2)采用利百健技术制作自体脂肪微片段:将脂肪组织置于一次性的利百健处理试剂盒中进行处理,均匀摇晃试剂盒,逐渐减小脂肪组织簇的大小,同时消除具有促炎特性的油性物质和血液残留物。将得到的微碎片脂肪收集到60 mL 注射器中,并定位用于倾析过量的盐水溶液。然后将所得产物转移到几个10 mL 注射器中,并注射到患者的关节腔内。
1.3.2 对照组治疗(玻璃酸钠注射) 患者取平卧位,经常规皮肤消毒后,以患侧髌骨外缘及下缘连线的交点为穿刺点,向膝关节中心穿刺,如有积液,抽取积液后在关节腔内注射玻璃酸钠2 mL,1 次/周,连续治疗5 次。
两组患者同时予以硫酸氨基葡萄糖胶囊口服8周,同时指导患者改善饮食结构,控制体重,行股四头肌肌力训练。
1.4 疗效评估方法
在治疗前、治疗后1 个月、3 个月、6 个月、12 个月时使用以下观测指标评估患者的疼痛症状和关节功能:(1)视觉模拟量表(visual analogue scale,VAS)评分,用于患者自主评估膝关节疼痛程度,可选择范围为1 ~10 分,评分越高,表示疼痛越剧烈。(2)西安大略和麦克马斯特大学(Western Ontario and McMaster University,WOMAC)骨关节炎指数评分,用于评估膝关节功能,包含关节疼痛、关节僵硬、关节功能等24 项评分项目,评分越高,表示膝关节功能越差。(3)美国特种外科医院膝关节功能评分系统(Hospital for Special Surgery Knee Score,HSS)评分,用于评估膝关节功能。该评分系统主要是依据患者的疼痛、功能、肿胀和关节稳定性等因素对膝关节功能进行综合评估。评分越高,表示膝关节功能越好。
1.5 统计学分析
采用SPSS 19.0 软件进行统计学分析。计量资料用均数± 标准差(±s)表示,采用t检验,计数资料用百分比(%)表示,采用χ² 检验。P<0.05为差异有统计学意义。
2 结果
2.1 VAS 评分结果
两组治疗前的VAS 评分无明显差异(P=1 >0.05)。治疗后1 个月,对照组的VAS 评分低于试验组,差异具有统计学意义(P=0.000 <0.05)。治疗后3 个月、6 个月,试验组的VAS 评分低于对照组,但差异不具有统计学意义(P=0.061、0.2 >0.05)。治疗后12 个月,试验组的VAS 评分低于对照组,差异具有统计学意义(P=0.000 <0.05)。试验组治疗后12 个月VAS 评分与治疗前的差值大于对照组,差异具有统计学意义(P=0.000 <0.05)。见表2。
表2 两组治疗前后各观察时间点VAS 评分结果的对比(分,± s)

表2 两组治疗前后各观察时间点VAS 评分结果的对比(分,± s)
组别 治疗前 治疗后1 个月 治疗后3 个月 治疗后6 个月 治疗后12 个月 治疗后12 个月与治疗前的差值试验组 4.40±0.58 3.84±0.37 1.80±0.65 0.92±0.81 0.48±0.59 3.92±0.28对照组 4.40±0.50 2.84±0.37 2.12±0.53 1.20±0.71 1.84±0.85 2.56±0.65
2.2 WOMAC 骨关节炎指数评分结果
两组治疗前的WOMAC 骨关节炎指数评分无明显差异(P=0.78 >0.05)。治疗后1 个月,对照组的WOMAC 骨关节炎指数评分低于试验组,差异具有统计学意义(P=0.047 <0.05)。治疗后3 个月、6 个月、12 个月,试验组的WOMAC 骨关节炎指数评分低于对照组,差异具有统计学意义(P=0.000、0.000、0.000 <0.05)。试验组治疗后12 个月WOMAC 评分与治疗前的差值大于对照组,差异具有统计学意义(P=0.000 <0.05)。见表3。
表3 两组治疗前后各观察时间点WOMAC 骨关节炎指数评分结果的对比(分,± s)

表3 两组治疗前后各观察时间点WOMAC 骨关节炎指数评分结果的对比(分,± s)
组别 治疗前 治疗后1 个月 治疗后3 个月 治疗后6 个月 治疗后12 个月 治疗后12 个月与治疗前的差值试验组 28.40±1.78 26.04±5.33 14.56±2.45 5.72±1.21 5.20±1.00 35.28±1.40对照组 28.80±6.87 23.68±2.01 22.16±6.25 19.76±2.70 14.68±2.44 12.48±3.65
2.3 HSS 评分结果
两组治疗前的HSS 评分无明显差异(P=0.278 >0.05)。治疗后1 个月,对照组的HSS 评分高于试验组,差异具有统计学意义(P=0.000 <0.05)。治疗后3 个月、6 个月、12 个月,试验组的HSS 评分高于对照组,差异具有统计学意义(P=0.000、0.000、0.000 <0.05)。试验组治疗后12 个月HSS 评分与治疗前的差值大于对照组,差异具有统计学意义(P=0.000 <0.05)。见表4。
表4 两组治疗前后各观察时间点HSS 评分结果的对比(分,± s)

表4 两组治疗前后各观察时间点HSS 评分结果的对比(分,± s)
组别 治疗前 治疗后1 个月 治疗后3 个月 治疗后6 个月 治疗后12 个月 治疗后12 个月与治疗前的差值试验组 54.16±4.43 55.28±4.98 72.24±6.69 83.32±2.85 89.44±3.58 23.20±1.04对照组 52.96±3.21 61.52±3.58 64.80±4.01 65.84±5.06 65.44±6.71 14.12±4.64
3 讨论
KOA 是一种致残率较高的疾病,影响了全球约2.5 亿人[6],且目前其发病率由于肥胖人群的增加及人口老龄化的加剧,呈现逐年升高的趋势[7]。其病理性改变主要包括软骨退变、软骨下骨损伤、关节畸形、韧带和半月板损伤以及关节周围肌肉的萎缩等[8]。既往研究数据显示,对早期的KOA 患者采用关节镜下软骨修复、成形或减压手术治疗后,进行中长期随访的结果显示患者均有不同程度的症状缓解;在2 ~4级KOA 患者中,通过5 年随访评估关节镜手术或者保守治疗的疗效,发现治疗缓解不适症状的时间最多只能维持2 年[9]。有文献显示,相较于合并软骨或韧带损伤的患者,未合并软骨、韧带损伤的KOA 患者进行半月板修复术后能获得更好的临床效果[10-11]。研究表明,KOA 多合并软骨、半月板及前交叉韧带、内侧副韧带损伤,但由于软骨修复技术目前并不成熟,进行软骨修复治疗的疗效往往达不到预期。而由于膝关节置换技术的成熟及广泛推广,很多有症状的早中期KOA 患者过早地接受了关节置换手术[12]。基于软骨损伤在KOA 发病机理中的重要性,目前对于促进软骨再生生物治疗方式的研究越来越多[13]。随着再生医学及干细胞技术的发展,干细胞注射已经开始应用于KOA 的治疗。此前常用的干细胞主要来源于骨髓,临床难以获取。近年来,相对更易获取且富含ADMSCs 的自体脂肪微片段逐渐得到了广泛的临床应用。有研究表明,即使是对于4 级KOA 患者,自体脂肪微片段注射治疗同样有益处,且能延缓其进行全膝关节置换的时间[14]。本研究选择了有临床症状的KOA 1 ~3 级患者进行干预治疗,两组患者治疗后疼痛较前明显减轻,关节功能明显改善。但在第6 个月、第12 个月随访时,对照组的VAS 评分、WOMAC 骨关节炎指数评分已无明显下降,HSS 评分已无明显上升;而试验组仍呈现良好的改善趋势。这表明,相较于HA 注射,自体脂肪微片段注射具有更好的远期疗效。在KOA 的慢病管理中,通常将减重、活动水平控制、物理治疗、口服及外用镇痛药物结合作为首选管理方式[15]。当以上治疗的效果不理想时,关节腔内注射HA 或糖皮质激素是主流的治疗选择[16],能起到短期改善患者疼痛症状的作用,但HA 注射的疗效缺乏高级别临床证据,糖皮质激素有加快软骨丢失的风险。再生生物医学是目前相关研究的热点领域,骨髓及脂肪组织是间充质干细胞的主要自体移植来源。相对于脂肪组织而言,骨髓的采集创伤较大,且其基质中间充质干细胞的相对浓度较低[17];此外,骨髓间充质干细胞的活性和分化能力与年龄呈正相关,而脂肪组织来源的间充质干细胞则不受年龄影响。考虑到KOA 患者多为中老年人[18],后者是更好的选择。本研究中的自体脂肪微片段是采用利百健技术制备的,其中含有丰富的 ADMSCs、周细胞、生长因子、基质血管组分等。本研究中,25 例进行自体脂肪微片段注射的患者均未发生不良反应或并发症,且均获得完整的随访。在治疗后1 个月,对照组的VAS 评分、WOMAC 骨关节炎指数评分及HSS 评分均优于试验组,考虑这与自体脂肪微片段和HA 的作用机理有关。HA 主要是通过润滑关节及减轻震荡来起到缓解相关症状的作用[19],并通过与相关受体相结合来起到抗炎作用,达到保护关节软骨的目的[20]。由于是直接补充外源性HA,因此能够迅速减少炎症因子的释放,起到镇痛作用[21]。自体脂肪微片段一方面能增加透明软骨中带负电荷糖胺聚糖的水平,这对构成软骨支架有促进作用,从而可减轻相关疼痛,并改善运动能力[22]。另一方面其可通过间充质干细胞发挥修复作用。相关修复作用主要是通过两种途径实现,一种是间充质干细胞可以直接分化为软骨细胞;另一种是间充质干细胞可通过旁分泌生物活性因子刺激软骨细胞的再生。带有血管基质组分的脂肪微片段中含有丰富的边缘渗出成分[23],其是血管化的重要参与者,是创面修复和组织再生的基础条件[24]。目前,不同的体外研究都表明,间充质干细胞- 边缘渗出成分的相互作用有益于软骨组织的修复和再生,从而可增强关节软骨下骨的强度,达到缓解疼痛的目的[25]。本研究中,我们观察到早期入组的患者进行2 年的MRI 检查随访的结果显示,其软骨下骨的水肿面积不断减小,缺损处出现新生软骨(见图1)。
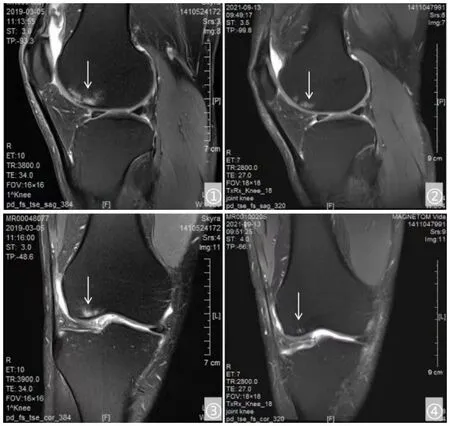
图1 脂肪微片段治疗前后膝关节核磁征象
既往有研究表明,自体脂肪微片段治疗会在给药1 ~2 个月后起效,这与软骨下骨强度增强的时间线有关[25],后期软骨修复可实现良好的关节支撑作用,从而可缓解相关疼痛症状。
综上所述,自体脂肪微片段治疗早中期KOA 具有良好且稳定的疗效,该疗法操作简单、创伤小,值得临床推广应用。但针对其长期疗效以及对软骨的修复效果尚需更多大样本长期随访研究及治疗后不同节点的MRI 评估来验证。

