基于肠道类器官解析益生菌调节肠嗜铬细胞合成5-HT的效应物质
汪铮,田培郡,朱然,王刚,陈卫
(江南大学 食品学院,江苏 无锡,214122)
5-羟色胺(5-hydroxytryptamine,5-HT)作为一种神经递质,在调节肠道蠕动和神经功能方面扮演着重要的角色[1-2]。5-HT是以色氨酸为前体,在色氨酸羟化酶(tryptophan hydroxylase,TPH)和芳香族氨基酸脱羧酶的催化下生成的[3];TPH是其合成途径中的关键限速酶,包括TPH1和TPH2两种亚型。前者存在于肠嗜铬(enterochromaffinl,EC)细胞内,后者主要在大脑中缝核中发现[4]。EC细胞占比不到肠上皮细胞总数的1%,却合成了人体内超过90%的5-HT[3]。EC细胞还能够接受肠腔内环境的化学、机械等刺激,在基底部位或顶膜附近释放5-HT,将肠内信号传导至大脑[5]。
肠道菌群及其分泌的代谢产物能够刺激EC细胞来调控5-HT的合成。YANO等[6]发现无菌小鼠肠道内5-HT含量比正常老鼠低约60%,当重新定殖产孢细菌后,能够恢复其肠道内5-HT的水平;进一步的研究发现,菌群代谢产物是诱导EC细胞释放5-HT的关键因素,包括α-生育酚、丁酸盐、胆盐、脱氧胆酸盐、对氨基苯甲酸、丙酸盐和酪胺等。另有研究表明,与SPF小鼠相比,无菌小鼠结肠内Tph1表达水平显著降低,而恢复肠道菌群可显著逆转这一现象;菌群产生的短链脂肪酸是影响Tph1表达和5-HT合成的必要因素[7]。此外,在异硫氰酸烯丙酯、异戊酸、儿茶酚胺等肠道菌群代谢产物的刺激下,EC细胞分别通过TRPA1离子通道、Olfr558受体和Adrα2A受体—TRPC4通道信号级联通路对其作出兴奋反馈,激活EC细胞的L型电压门控钙离子通道来释放血清素[8]。
益生菌也被证明具有调节肠道5-HT合成的能力。例如,乳双歧杆菌TY-S01能够通过调节肠道微生物群和代谢产物来维持肠道内5-HT水平,对洛哌丁胺诱发便秘具有一定的预防效果[9]。此外,齿双歧杆菌的定殖可以提高肠道短链脂肪酸受体FFAR2和5-HT转运蛋白的表达,进而促进5-HT的外分泌水平[10]。可以看出,现有关于益生菌调节宿主5-HT合成的机制,仍停留在调节肠道菌群及其代谢产物的宏观层面。至于益生菌本身对5-HT合成的影响机制,尚未有深入研究。
本团队前期研究发现一株短双歧杆菌——CCFM1025,能够显著提高EC细胞模型(RIN14B)的5-HT合成能力;尤其是使用发酵上清液孵育30 min后,能够显著提高RIN14B细胞Tph1基因的转录水平[11]。但是,何种代谢产物、通过何种途径提高EC细胞合成5-HT仍然是未知的。本研究拟基于益生菌与肠道类器官共培养和量效分析的方法,解析短双歧杆菌CCFM1025调节5-HT合成的特征效应物,从而阐明益生菌发挥生理功能的分子机制,为该类功能益生菌的定向筛选提供理论依据。
1 材料与方法
1.1 试剂与耗材
MRS肉汤培养基、TRIzol RNA Isolation Reagents,美国Invitrogen公司;SYBR Green Supermix,美国Bio-Rad公司;Tph1特异性引物、D601037-0050抗小鼠/兔FITC免疫荧光检测试剂盒,上海生工有限公司;色氨酸羟化酶1(TPH1;Cat#DF6465),美国Affinity抗体公司;06005 IntestiCultTM类器官生长培养基,加拿大StemCell公司;356231基质胶,美国Corning公司;C0221D D-PBS,碧云天;E-EL-0033c血清素/5-羟色胺(serotonin/5-HT)酶联免疫吸附测定试剂盒,武汉伊莱瑞特生物科技有限公司;36254 DMEM/E12培养基,加拿大Stemcell公司。
1.2 材料和设备
5417R冷冻离心机,德国Eppendorf公司;CFX384实时荧光定量PCR仪,美国Bio-Rad公司;SX-300型灭菌锅,日本Tomy Digital Biology公司;CO2培养箱,美国Thermo Scientific Forma公司;T1-SAM倒置荧光显微镜,日本Nikon公司;恒温水浴锅;厌氧工作站;SCIENTZ-48高通量组织研磨器,宁波新芝生物科技有限公司;BSC-1004IIA2生物安全柜,苏州安泰。
1.3 拟试验菌株
BifidobacteriumbreveCCFM1025分离自西藏某一健康成人粪便,保藏于江南大学生物技术中心菌种库(-80 ℃,30%甘油中)。
1.4 菌株活化和发酵液制备
使用前,以无菌接种环挑取适量菌液,在MRS琼脂平板上划线活化2次(37 ℃厌氧培养24~48 h)。挑取单菌落,CCFM1025接种于含有1 g/L半胱氨酸盐酸盐的MRS液体培养基中,置于37 ℃的厌氧工作站进行发酵培养。取对数生长后期的发酵液,离心(4 ℃、6 000×g、10 min)收集上清液得到发酵液。
1.5 菌株发酵产物非靶向代谢组学分析
取对数生长后期的发酵液,离心(4 ℃、6 000×g、10 min)收集上清液后过0.22 μm滤膜得到发酵液,经400 μL甲醇沉淀蛋白质后,4 ℃、15 000 r/min离心15 min,取上清液于真空浓缩仪蒸发至干,最后以100 μL甲醇水(4∶1,体积比)复溶待测。
采用Ultra-performance liquid chromatography &Q-Exactive high-resolution mass spectrometer系统进行代谢组学检测:使用C18柱(Waters UPLC BEH C18-2.1 mm×100 mm,1.7 μm)进行梯度洗脱。流动相包括:(A)0.1%甲酸水溶液和(B)乙腈用于正离子模式;(A)5 mmol/L乙酸铵水溶液和(B)乙腈用于负离子模式。进样量5 μL,流速350 μL/min。梯度洗脱程序:0~1.5 min,99%(A);1.5~16 min,从99%~0%(A);16~18 min,0%(A);18~18.1 min,从0%到99%(A);18.1~25 min,99%(A)。采用MS/MS-scan模式(70~1 050m/z),分辨率70 000。采用Compound Discover 3.3软件进行样本的峰识别、提取、对齐和整合。之后,通过mzCloud数据库对91个(负离子模式)和185个(正离子模式)发酵液代谢物的名称和化学结构进行二次比对,删去重复合并后共259个代谢物进行后续分析。
1.6 小肠类器官构建
1.6.1 肠道隐窝分离、培养
取6周龄雄性C57BL/6小鼠约20 cm的小肠,用镊子和剪刀去除肠系膜、血管和脂肪,并用D-PBS冲洗多次,沿着肠腔轴向剪开肠道,转移至含有10 mL D-PBS的培养皿中清洗干净。用镊子将肠道悬于含有预冷D-PBS的50 mL离心管口,剪成约2 mm的小段。用移液枪反复吹打,待组织块自然沉降后,弃去上清液,加入15 mL预冷的D-PBS,反复吹打3次,静置。重复操作15次或是等到上清液变澄清,弃去上清液加入细胞解离液摇床上低速孵育10 min,待自然沉降弃去上清液,用含有0.1%(体积分数)牛血清白蛋白的D-PBS重悬,70 μm滤网过滤后,低速低温离心后重悬于DMEM/F-12培养基。显微镜下挑选质量较好、密度适中的隐窝数。用类器官培养基和基质胶各150 μL重悬肠隐窝,吸取50 μL悬液,加入到提前预热的24孔板的中心部位,在37 ℃培养箱中静置10 min让基质胶凝固成一个圆顶结构,使用移液枪沿着孔侧壁向每个孔加入750 μL类器官培养基,并在37 ℃和5% CO2下进行培养。
1.6.2 小肠类器官换液和传代
待肠隐窝培养2~3 d后,培养基逐渐变黄,用移液枪沿着孔侧壁吸去培养基,再吸去750 μL新的培养基,沿着孔侧壁缓慢加入。
等培养5~7 d后进行传代,准备好所有试剂进行解冻,在每个需要传代的孔中小心吸去培养基,不要破坏基质胶结构,每孔加入1 mL细胞裂解液,室温孵育1 min,用润洗后的枪头对类器官进行反复吹打20次,注意不要产生气泡,用同一根枪头将所有需要传代的类器官转移至15 mL离心管中。之后再用新的细胞裂解液润洗培养孔,再转移到15 mL离心管,其余需要传代的孔均按上述操作。摇床低速孵育10 min,低速低温离心5 min后弃去上清液,加入10 mL DMEM/F-12培养基,混匀后低速低温离心,弃去上清液。将类器官培养基和基质胶以1∶1的质量比重悬肠隐窝,吸取50 μL悬液,加入到提前预热的24孔板的中心部位,在37 ℃培养箱中静置10 min让基质胶凝固成一个圆顶结构,使用移液枪沿着孔侧壁向每个孔加入750 μL类器官培养基,并在37 ℃和5% CO2下进行培养。观察培养5~7 d后的类器官形态,成熟且具有明显多芽结构,即可进行物质刺激实验。
1.7 刺激小肠类器官Tph1基因转录实验
以发酵产物中每种代谢产物的实际浓度,配制标准溶液,并设置0.1×、1×、10×三个浓度梯度。无菌0.22 μm滤膜过滤除菌,每个孔用移液枪吸去培养基,加入含有一定浓度草酰乙酸、乳酸或柠檬酸的1 mL D-PBS,孵育一定时间后收集类器官。进行后续的基因表达和免疫荧光的分析。通过qRT-PCR检测小肠类器官中Tph1的基因表达情况。
样本RNA按照TRIzol法提取,收集完类器官加入TRIzol充分裂解、振荡,加入氯仿提取RNA,然后通过异丙醇沉淀,体积分数75%乙醇洗脱得到RNA,室温干燥15 min后加入DEPC水溶解RNA。采用Vazyme反转录试剂盒得到cDNA,在荧光定量扩增仪器上进行检测。以管家基因Gapdh作为内参,每个样本设立3个平行孔。反应结束后,取各个扩增循环数(Cq)进行计算分析。相对表达量以目的基因对于管家基因的倍数(2-ΔΔCq)表示,其中-ΔΔCq=(Cq目的基因-Cq管家基因)实验组-(Cq目的基因-Cq管家基因)对照组。
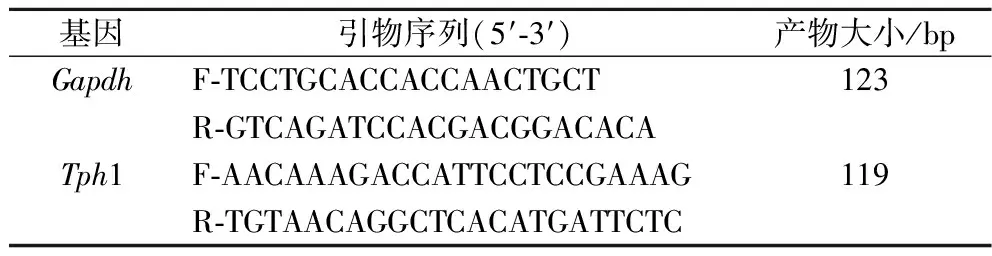
表1 引物序列Table 1 Primer sequence
1.8 小肠类器官TPH1蛋白免疫荧光分析
肠类器官收取:肠类器官培养在24孔中,吸取培养基,用冷的D-PBS洗一遍,然后每个孔加入1 mL的预冷细胞裂解液,用润湿的枪头轻轻吹打,将肠类器官和基质胶从孔底部吹下来,转移到1.5 mL离心管中自然沉降在底部。冰上孵育约20 min直到基质胶基本被融解,肠类器官在离心管中自然沉降在底部。
免疫荧光染色参照上海生工FITC免疫荧光试剂盒说明书进行:将收集的类器官用PBS清洗3遍,加入4%多聚甲醛(paraformaldehycle,PFA)进行固定,再次用PBS清洗3遍加入0.5% Triton-100溶液进行肠细胞破膜。随后PBS清洗2遍后加入5%牛血清白蛋白进行抗体封闭。将一抗TPH1(1∶200)稀释到合适的比例加入后4 ℃过夜,PBS清洗后加入FITC标记的二抗和DAPI进行染色。最后加入一滴抗荧光淬灭剂混匀封片,封好的片子4 ℃避光保存。在FITC和DAPI通道下,用激光共聚焦显微镜进行扫描拍照,分析蛋白在肠类器官中的表达定位情况。最后用Image J对类器官免疫荧光实验结果进行平均免疫荧光强度测定。
1.9 5-HT检测方法
用小鼠5-HT ELISA试剂盒检测各组肠类器官分泌5-HT的水平变化,具体实验步骤参考生产商的说明书进行。
1.10 数据统计与分析方法
数值表示为平均值±标准差,采用Prism 8进行统计分析和图形绘制。显著性标准设为P<0.05;其中*P<0.05,**P<0.01,***P<0.001,****P<0.000 1。
2 结果与分析
2.1 小肠类器官构建及CCFM1025发酵液对小肠类器官的影响
小肠隐窝经分离提取培养,几个小时到一天培养时间内形成闭合的圆形囊状结构,并且具有相对光滑的边缘(图1-a),通常在培养2~4 d后,开始萌芽,位于小肠隐窝底部的干细胞不断增殖和分化,向囊状结构四周扩散,培养第5~7天闭合囊状结构形成复杂的多叶结构,转变为具有多个向外凸起芽体的立体结构(图1-a),此时形成了小肠类器官的成熟结构,一般可达到每个孔约200个类器官(图1-b)。继续培养2~4 d,肠上皮细胞将会死亡脱落于肠腔内,中部变黑,直至类器官裂解破碎凋亡。
团队前期检测了CCFM1025发酵上清液对RIN14B细胞Tph1转录表达的影响。在刺激时间为30 min时,较于空白组Tph1的表达有显著提高。我们设置了不同浓度梯度的CCFM1025发酵液,观察对小肠类器官Tph1表达和5-HT外分泌水平的影响。结果显示发酵液干预60 min后,小肠类器官Tph1基因表达和5-HT外分泌水平呈剂量依赖性。如图1-c所示,较于105CFU/mL发酵液干预组,107、109CFU/mL发酵液干预组中小肠类器官Tph1基因表达显著上调;如图1-d所示,较于105CFU/mL发酵液干预组,109CFU/mL发酵液干预组中小肠类器官5-HT分泌水平显著上调(P<0.05)。
2.2 CCFM1025发酵液非靶向代谢组分析
根据Compound Discover 3.3软件对样本的峰识别、提取、对齐和整合(如图2-a所示),筛选出符合数据库配比得分>80等条件的所有代谢物,得到91个(负离子模式)和185个(正离子模式)发酵液代谢物,删去重复合并后共有259个代谢物。并根据含量对对数后期CCFM1025发酵液中能检测到的代谢物进行排序,发酵液中含量排序前10的物质如图2-b、图2-c所示,前10种物质的m/z的离子图和峰面积图如图2-b所示。
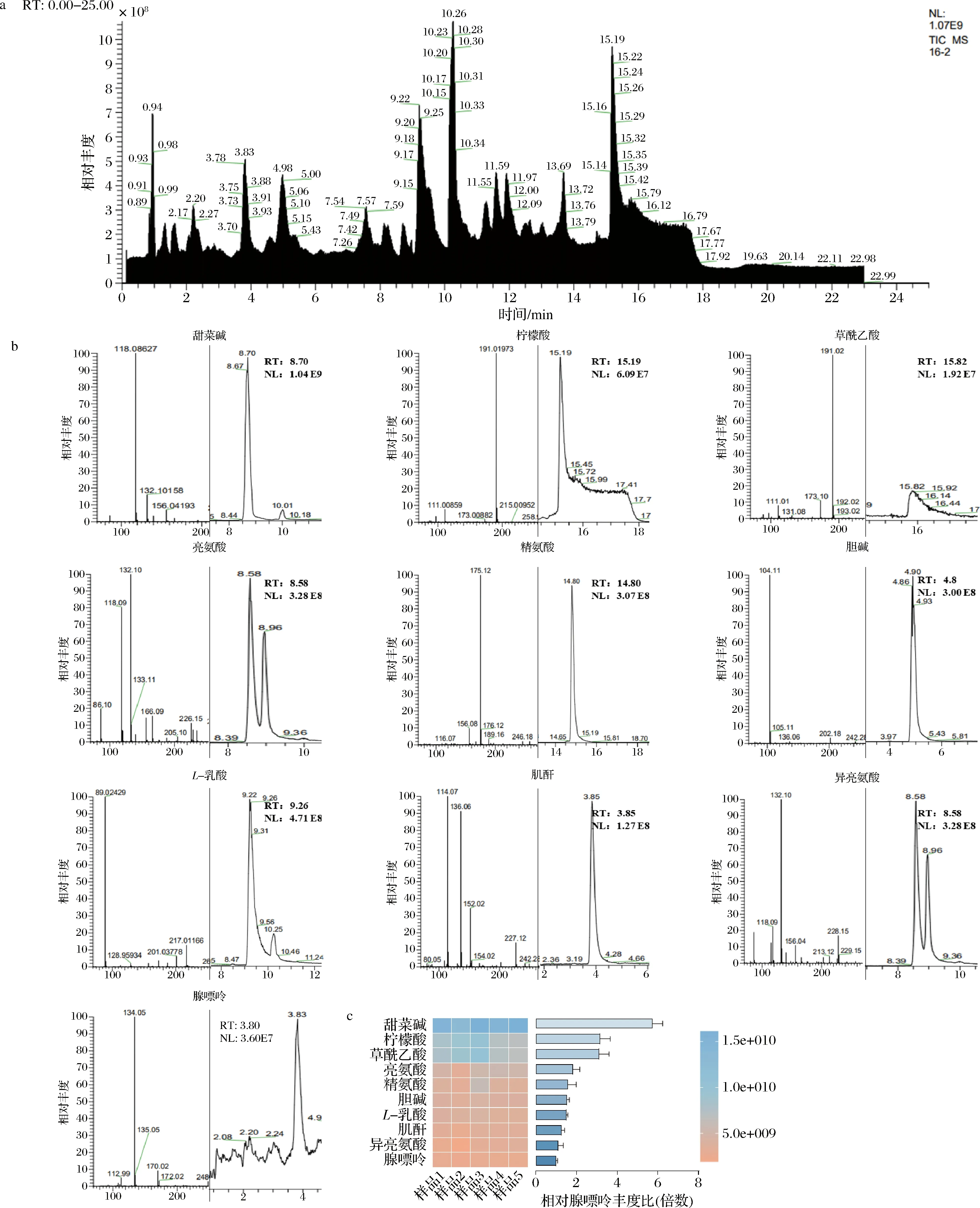
a-CCFM1025发酵液非靶向代谢谱图;b-CCFM1025发酵液非靶向代谢物离子图(m/z)和峰面积图;c-CCFM1025发酵液非靶向代谢物峰面积图(前10)
根据前期文献的调研,我们选取发酵液挥发性代谢产物和非挥发性代谢产物(丰度前10)。根据靶向定量的方法,确定了发酵液中含有4.8 mg/mLL-乳酸等,以发酵液所含每种物质的浓度定为1×,根据母液浓度按梯度稀释配制0.1×、1×、10×的工作液进行后续实验。
2.3 代谢产物对小肠类器官Tph1基因表达的调节作用
以发酵产物中每种代谢产物的实际浓度配制好后,与小肠类器官共培养不同时间:20、40、60 min。如图3所示,柠檬酸、亮氨酸、L-乳酸、异亮氨酸、腺嘌呤、乙酸呈时间依赖性。相较于20 min共培养组,较长时间共培养的草酰乙酸、L-乳酸、肌酐、腺嘌呤、乙酸组均能够显著提高小肠类器官Tph1基因的表达,而较长时间共培养的柠檬酸、亮氨酸、异亮氨酸组显著抑制了小肠类器官Tph1基因的表达。我们根据每种物质在发酵液中的含量设置了3个不同的浓度梯度的工作液,统一为0.1×、1×(CCFM1025发酵液所含该物质浓度)、10×;与小肠类器官共培养相应的最适时间。结果发现L-乳酸、乙酸均具有剂量依赖性,并且在10×浓度下能够显著提高小肠类器官Tph1基因的表达(L-乳酸:P<0.000 1;乙酸P<0.001)。
2.4 乙酸、乳酸对小肠类器官TPH1蛋白免疫荧光的表现
上述结果显示,L-乳酸、乙酸能够显著刺激小肠类器官Tph1基因的表达,因此我们又对小肠类器官进行TPH1免疫荧光实验观察。DAPI透过细胞膜和细胞核中双链DNA结合发挥标记作用,经等浓度DAPI染色后各组间荧光强度没有显著差异,结果体现了实验样本和检测条件的一致性(图4-a)。将最适浓度的乙酸(1×)、L-乳酸(1×)与小肠类器官共培养,对小肠类器官进行TPH1免疫荧光染色处理,结果显示L-乳酸和乙酸体外刺激小肠类器官导致TPH1表达显著增强(如图4-b、图4-c所示)。综上,L-乳酸和乙酸激活了小肠类器官TPH1的表达,与上述基因表达结果一致。

a-各组小肠类器官DAPI染色的平均免疫荧光强度;b-不同代谢物刺激小肠类器官TPH1的平均免疫荧光强度;c-不同代谢物刺激小肠类器官TPH1的免疫荧光表达
3 结论与讨论
明确益生菌特定的代谢产物与肠道细胞的互作机制可能是未来实现特定功能益生菌定向筛选的前提。但由于研究方法的局限性,探究益生菌与宿主的直接互作机制仍具有挑战。以往的研究,都是在单一时间点和特定范围内进行横断面式研究,通过不同实验组横向比较得到差异结果[12-13],比如只通过某一时间点的横向比较来判断服用益生菌的积累效应;其次,在剂量维度上,往往采用单一剂量来评价益生菌的效果,然而它可能处于浓度与效果评价曲线中的任意一点[14]。可见,传统的实验设计存在一定的局限性。益生菌功效研究亟待摆脱脱离剂量、时间限定来研究其效果的现状。
出现这种现象是因为体内量效关系研究的技术难度较高。近年来发展的肠道类器官培养技术能够很好地解决这一问题[15-17]。肠道类器官拥有来源于肠干细胞的多种细胞类型,并复现了肠道组织局部的3D立体空间结构。通过与肠道细菌或是代谢产物的共培养,能够模拟营养成分与多种细胞互作的真实内环境。此外,类器官能够长时间培养、稳定传代,有利于开展基于时间、剂量的量效分析实验。BFLLONO等[18]通过肠类器官阐明了EC的内在生物物理、药学及遗传学特性,为研究肠道微生物调节宿主5-HT合成的分子机制、效应物筛选等奠定了理论和技术基础。本研究采用肠类器官与益生菌特征性代谢产物共培养的方式,明确了能够以时间、剂量依赖效应刺激Tph1基因表达的代谢产物,从物质层面为益生菌调节生理功能提供了更科学、更具体的证据。
针对CCFM1025发酵产物的非靶向代谢组学分析显示,乳酸是其主要的非挥发性代谢产物(丰度排名前10)。此外,我们对CCFM1025主要的挥发性代谢产物——乙酸,也进行了量效作用分析。结果表明,乙酸、L-乳酸能够以时间、剂量依赖效应促进肠道类器官Tph1基因的表达。值得注意的是,乙酸能够参与神经系统功能调节,比如调节胃肠道蠕动、食欲、情绪反应等等。ENGEVIK等[10]研究发现,齿双歧杆菌的定殖可增加小鼠肠道内乙酸的含量,通过提高5-HT转运蛋白的表达,促进5-HT的分泌;此外,TSURUTA等[19]研究发现,乙酸盐和肠类器官共培养能够显著提高CgA阳性细胞数量以及Tph1、Htr4的基因表达水平,这与我们的研究结论一致。乳酸在调节5-HT合成方面鲜有报道,但其被证明具有一定程度的神经活性。比如乳酸转化为丙酮酸的过程中产生的NADH,能够保护抑郁导致的神经元发生障碍[20];外周注射L-乳酸能够提高了小鼠海马体内Hes5的转录水平,激活Notch信号通路调节海马体的神经发生[21];此外,有研究表明在血清素相关神经递质的调节下,星形胶质细胞能够在利用糖原过程中产生释放乳酸盐,并且乳酸盐转运到神经元是长期记忆形成的必要因素[22]。
本研究还存在一些不足之处。首先使用代谢组学技术筛选出益生菌潜在的多种作用物质,基于小肠类器官建立了物质与基因表达的互作量效关系,但时间和剂量的选择范围仍然偏窄。选择作用时长短、时间间隔少、浓度梯度小的共培养方式均不能完全复现出益生菌与肠道细胞的动态互作关系。其次本文采用小肠类器官作为研究益生菌活性成分的模型,但是益生菌的作用部位主要在大肠。受技术所限,虽然小肠类器官是目前研究EC细胞的主要工具,但结肠类器官与益生菌共培养模式应当成为研究益生菌与宿主互作机制的第一选择。
本研究首次采用肠道类器官技术来研究益生菌发挥生理作用的物质基础并明确量效关系。发现短双歧杆菌CCFM1025的发酵产物——L-乳酸、乙酸,能够以剂量、时间依赖性显著上调小鼠小肠类器官Tph1的基因表达,促进5-HT的生物合成。本文建立了益生菌特征性代谢产物与宿主互作的直接证据,阐明了益生菌调节肠道5-HT合成的潜在分子机制,为同类功能新菌株的开发提供了理论基础。

