戈舍瑞林联合改良腹腔镜术治疗卵巢子宫内膜异位囊肿伴不孕症的效果
王义红,张振峰,朱园园
(河南科技大学第二附属医院 妇科,河南 洛阳 471000)
卵巢子宫内膜异位囊肿是一种常见的妇科疾病,其主要表现为痛经、不孕等,给患者的生活带来了较大影响[1]。临床治疗卵巢子宫内膜异位囊肿多用手术干预,传统手术治疗方法包括开放式手术和腹腔镜手术,但两种手术均存在疼痛、切口愈合慢以及术后并发症等问题[2]。近年来,随着腹腔镜技术的进步与发展,改良腹腔镜术在卵巢子宫内膜异位囊肿治疗中的应用频率明显升高,与传统手术相比,改良腹腔镜手术对机体损伤更小[3]。从临床数据来看,卵巢子宫内膜异位囊肿的复发率较高,因此,部分仅接受改良腹腔镜手术的患者可能需要接受多次干预才能完全治愈[4]。戈舍瑞林是一种人工合成的生长抑素类似物,它通过抑制腺垂体的性腺激素分泌来达到治疗癌症的效果,戈舍瑞林可以用于预防卵巢功能的暂时性停止,从而降低体内雌激素水平,减缓肿瘤的生长速度[5]。对于卵巢子宫内膜异位囊肿患者而言,戈舍瑞林可帮助抑制囊肿发展与复发,因此,将其与改良腹腔镜术联合或可发挥协同功能。基于此,本研究纳入82例卵巢子宫内膜异位囊肿伴不孕症患者,深入分析了戈舍瑞林联合改良腹腔镜手术疗效以及对患者妊娠结局的影响。
1 资料与方法
1.1 一般资料
选取2020年1月至2021年12月在河南科技大学第二附属医院诊治的82例卵巢子宫内膜异位囊肿伴不孕症患者作为研究对象。(1)纳入标准:①术中腹腔镜探查可见卵巢内异病灶,且术后经过病理证实为卵巢子宫内膜异位囊肿;②符合不孕症的诊断标准[6];③可正常排卵,有生育需求;④为首次发病;⑤行改良腹腔镜术,且无禁忌证。(2)排除标准:①术中检查输卵管不通;②合并卵巢其他类型肿瘤或乳腺癌;③近期有卵巢手术史或全身放化疗;④多囊卵巢综合征;⑤高泌乳素血症;⑥甲状腺功能异常;⑦肾上腺皮质肿瘤;⑧严重宫腔粘连、子宫生殖道畸形、黏膜下子宫肌瘤等因宫腔原因不孕。随机分为两组,对照组41例和研究组41例,两组一般资料比较,差异均无统计学意义(P>0.05),见表1。患者或家属了解研究内容,知晓利弊,已签署知情同意书。本研究已获医院医学伦理委员会审批。
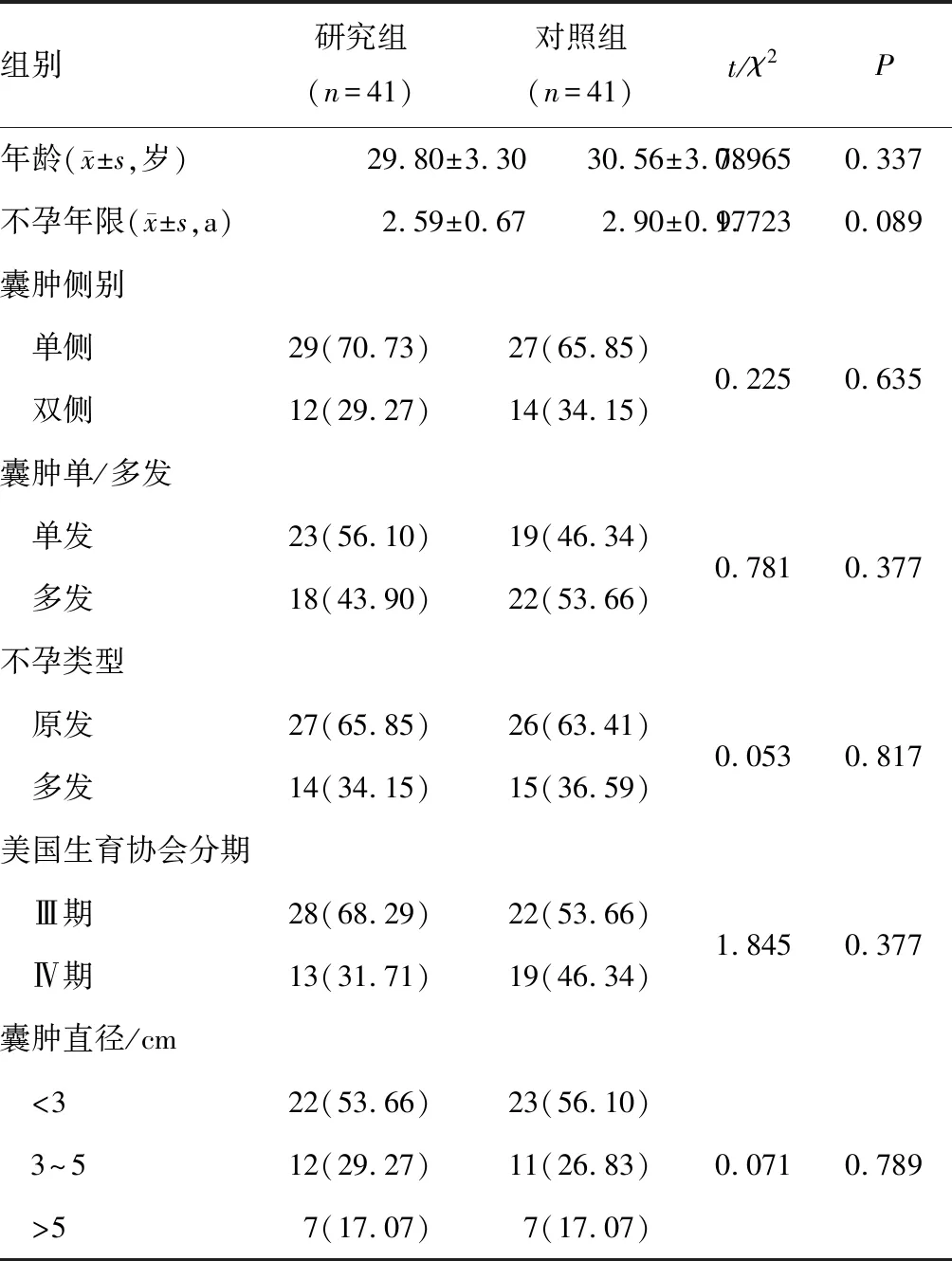
表1 两组一般资料比较
1.2 治疗方法
对照组接受改良腹腔镜术治疗,研究组接受戈舍瑞林联合改良腹腔镜术治疗。改良腹腔镜术:于经期结束后3~7 d实施,常规全麻,在脐部上缘做一1 cm切口,建立气腹,置入镜体,于左髂前上棘上方两横指处做一0.5 cm切口置入对应Trocar,于两切口连线中点外上2 cm做一切口(1 cm),于麦氏点做一切口(0.5 cm),术中用神经垂体素稀释液或缩宫素针稀释液注射卵巢囊肿壁组织、皮质间,形成水垫,用剪刀将卵巢皮质剪开,卷地毯方式剥离囊肿壁,2-0可吸收线缝合卵巢皮质,并止血,全程不采用能量器械。戈舍瑞林,选醋酸戈舍瑞林植入剂(AstraZeneca UK Limited,注册证号H20160244,规格10.8 mg),于术后3 d肌内注射3.6 mg,每28 d给药1次,连续干预3次。
1.3 观察指标
(1)性激素水平,于治疗前、治疗后取患者空腹静脉血5 mL,3 000 r·min-1离心10 min,取上层血清,用全自动免疫发光仪(博科医疗器械有限公司,型号:BKI 2200)测卵泡刺激素(follicle-stimulating hormone,FSH)、雌二醇(estradiol,E2)、黄体生成素(luteinizing hormone,LH)、抗缪勒氏管激素(anti-Müllerian hormone,AMH)、窦卵泡计数(antral follicle count,AFC)水平。(2)相关肿瘤因子,于治疗前、治疗后取患者空腹静脉血5 mL,3 000 r·min-1离心10 min,取上层血清,采用酶联免疫吸附试验检测人附睾蛋白4(human epididymal protein 4,HE4)、趋化因子受体-4(chemokine receptor 4,CXCR-4)、基质细胞衍生因子-1(stromal cellderived factor-1,SDF-1)水平。(3)数字疼痛评分(national reemployment service,NRS)[7],量表将疼痛划分为10个等级,患者根据数字对应疼痛等级进行评分,0分为无痛,7~10分为重度疼痛。(4)妊娠结局,对患者进行12个月随访观察,记录患者妊娠率、生育率、复发(卵巢子宫内膜异位囊肿直径达到2 cm以上)率。
1.4 统计学方法
2 结果
2.1 卵巢功能比较
治疗前,两组E2、LH、FSH、AMH、AFC比较,差异均无统计学意义(P>0.05);治疗后,两组E2、LH、FSH、AFC较治疗前均降低(P<0.05),两组AMH较治疗前均升高(P<0.05),研究组E2、LH、FSH比对照组低(P<0.05),研究组AMH、AFC比对照组高(P<0.05),见表2。
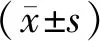
表2 两组治疗前后E2、LH、FSH、AMH、AFC比较
2.2 疾病相关肿瘤因子比较
治疗前,两组SDF-1、CXCR-4、HE4比较,差异均无统计学意义(P>0.05);治疗后,两组SDF-1、CXCR-4、HE4较治疗前均降低,且研究组比对照组低(P<0.05),见表3。
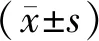
表3 两组治疗前后SDF-1、CXCR-4、HE4比较
2.3 疼痛情况比较
重复测量显示,NRS评分的时间因素、组间因素、时间因素与组间因素交互作用均有统计学意义(P<0.05);LSD-t检验显示,治疗1、2、3个月,两组NRS评分与治疗前比较均降低(P<0.05),且研究组比对照组低(P<0.05),见表4。
表4 两组治疗前后不同时点NRS评分比较
2.4 妊娠结局及复发情况比较
研究组妊娠率、生育率比对照组高(P<0.05),研究组的复发率比对照组低(P<0.05),见表5。
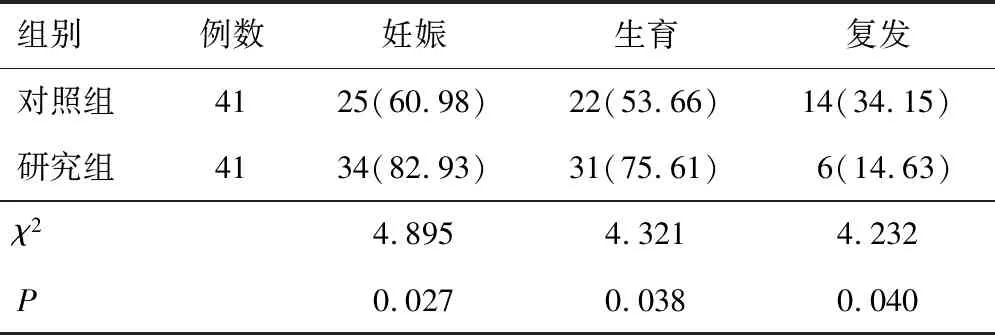
表5 两组妊娠结局及复发情况比较[n(%)]
3 讨论
卵巢子宫内膜异位囊肿是一种常见的妇科疾病,主要表现为卵巢或盆腔内的内膜异位组织形成囊肿,多数患者伴有不孕症状。目前,临床关于卵巢子宫内膜异位囊肿发生原因尚未研究透彻,部分学者认为免疫因素、遗传因素、内分泌因素均可导致卵巢子宫内膜异位囊肿发生与发展。相关数据显示,卵巢子宫内膜异位囊肿发病率在育龄女性中比较高,为5%~10%,卵巢子宫内膜异位囊肿可以引起月经周期紊乱,盆腔内疼痛、性交疼痛等,对女性生活质量影响较大[8]。同时,卵巢子宫内膜异位囊肿发病后卵巢和子宫均会受到影响,这就可能影响胚胎着床,增加流产率,还有部分患者孕期可能表现出子宫收缩过度,胎盘早剥等情况,造成早产。因此,对于卵巢子宫内膜异位囊肿女性,需及时就医,积极进行检查和治疗,保证妊娠期稳定,提高生育成功率。
改良腹腔镜手术是近年来较为常用的治疗卵巢子宫内膜异位囊肿的方法,相比于传统开腹手术与改良前腹腔镜手术,改良腹腔镜手术创伤小,出血少,疼痛轻,术后康复快,还可以保留女性的生育能力[9-10]。但由于卵巢子宫内膜异位囊肿具有一定特殊性,患者普遍复发率较高,可能需要进行多次手术干预才能治愈。因此,要想保障治疗效果,节约治疗成本,还需寻找一种综合治疗方式,实现对复发率的调控。戈舍瑞林是一种治疗前列腺癌和乳腺癌的药物,在调控性腺激素方面有较好效果[11]。在本研究中,治疗后,研究组E2、LH、FSH与对照组比较明显较低,AMH、AFC与对照组比较明显较高,说明研究组患者卵巢功能改善更好。其原因可能为,卵巢子宫内膜异位囊肿会导致盆腔组织炎症反应,从而影响卵巢分泌功能,而改良腹腔镜手术联合戈舍瑞林不仅可以清除机体囊肿,还可以改善盆腔内的炎症,减少对卵巢功能的干扰,降低围手术期的应激反应,从而有利于卵巢功能的恢复。同时,联合使用戈舍瑞林可以保护卵巢组织,有利于卵巢颗粒细胞和黄体细胞的存活和功能[12]。
此外,在本研究中,治疗后,两组SDF-1、CXCR-4、HE4较治疗前均降低,且研究组与对照组比较明显较低,说明研究组肿瘤因子得到控制,原因在于,改良腹腔镜手术联合戈舍瑞林可从两方面实现对囊肿的调控,一方面手术干预后囊肿组织被清除,卵巢微环境被改善,相关肿瘤因子水平改善[13]。另一方面,戈舍瑞林可以调节垂体-卵巢轴的功能,还能够抑制肿瘤、囊肿生长,实现对相关肿瘤因子水平改善。本研究结果显示,研究组患者复发率为14.63%,与对照组的34.15%比较明显较低,妊娠率、生育率分别为82.93%、75.61%,与对照组的60.98%、53.66%比较明显较高,说明研究组妊娠结局改善更明显,原因可能为,戈舍瑞林可以促进卵巢的功能,提高卵子的质量和数量,从而提高患者的妊娠率和生育率,戈舍瑞林联合改良腹腔镜术可以减少手术创伤,降低患者的恢复时间和疼痛程度,调节机体的免疫功能,减少异位组织的再生和复发。
4 结论
戈舍瑞林联合改良腹腔镜术能够改善卵巢子宫内膜异位囊肿伴不孕症患者卵巢功能与妊娠结局,抑制疾病相关肿瘤因子生成,减轻手术疼痛。但本研究纳入样本较少,且来源单一,还需开展大样本长时间研究证实。

