锶-89联合碘-131在分化型甲状腺癌骨转移治疗中的效果
闫志华,程兵,李祥周,陈伟娜
(郑州大学第一附属医院 核医学科,河南 郑州 450000)
分化型甲状腺癌包括甲状腺乳头状癌、滤泡癌、低分化甲状腺癌、Hürthle细胞癌。分化型甲状腺癌属于恶性程度相对偏低的一种类型;而未分化型甲状腺癌病变程度较为严重,恶性程度较高[1]。虽然分化型甲状腺癌的预后情况整体较为理想,但发生骨转移后常出现生存周期缩短、生活质量下降等问题。甲状腺癌骨转移早期发病以疼痛为主,若不进行及时干预和治疗,在局部疼痛之外可能造成患者局部骨质的破坏,严重者可导致病理性骨折[2]。当出现上述情况时须及时进行相应治疗以及干预。目前,一期多进行手术切除转移灶、原发灶,同时给予患者放射性核素以及甲状腺激素抑制治疗。常用的放射性核素包括碘-131为主的全身治疗方案。然而,由于不同患者存在个体差异,常规干预方案联合碘-131治疗在部分患者的应用中效果并不理想。锶-89的治疗原理是利用发射β射线杀死癌细胞进而发挥镇痛的效果,有助于缓解骨痛并提高生活质量、延长患者生存周期[3]。本研究主要探讨锶-89联合碘-131应用于上述疾病的临床疗效,旨在为甲状腺癌骨转移患者治疗方案的选取发挥一定的参考价值。
1 资料与方法
1.1 一般资料
选取2018年6月至2022年12月郑州大学第一附属医院收治的甲状腺癌骨转移患者共计86例。(1)纳入标准:①符合分化型甲状腺癌骨转移的诊断标准[4];②符合接受放射性核素治疗的要求;③精神状态正常,具有良好的沟通交流能力以及对治疗的依从性。(2)排除标准:①合并甲状腺癌以外的其他器官或组织恶性病变;②合并严重的凝血功能异常;③合并严重的机体代谢紊乱、内环境严重异常。上述研究对象对本研究内容知情且签署了知情同意书,本研究内容经本院医学伦理委员会审批。采用随机数表法将上述研究对象划分为观察组(n=48)、对照组(n=48)。观察组男性26例,女性22例;年龄48~65岁,平均(56.51±4.59)岁;体重指数(21.56±1.38)kg·m-2;甲状腺乳头状癌26例,甲状腺滤泡癌22例。对照组男性25例,女性23例;年龄50~67岁,平均(58.55±4.08)岁;体重指数(21.62±1.40)kg·m-2;甲状腺乳头状癌28例,甲状腺滤泡癌20例。两组一般资料比较,差异无统计学意义(P>0.05)。
1.2 治疗方法
全部研究对象均进行手术切除甲状腺癌治疗,同时给予碘-131治疗。在治疗前1个月进行低碘饮食,同时给予全身骨扫描等常规性检查。空腹服用碘-131口服液,首次服用剂量为3.7~5.55 GBq。观察组在上述治疗方案的基础之上联合使用锶-89进行治疗。采用上海科兴公司提供的89SrCl2静脉一次性给药,剂量按2.22~2.96 MBq·kg-1计算,用量148~185 MBq。上述治疗方案持续进行3个月后,进行相关指标的评价与比较。
1.3 观察指标
(1)治疗总有效率。(2)治疗前后的血清甲状腺球蛋白(thyroglobulin,Tg)水平:分别于接受治疗前后采集患者全血样本,并采用赛默飞世尔Thermo Fisher全自动化学发光分析仪以及配套试剂盒进行检测。(3)疼痛视觉模拟评分(visual analogue score,VAS)[5]:该评分在1根长度10 cm的直尺上进行,患者根据自身感觉到的骨痛在直尺上进行标记,对应的刻度表示患者的疼痛程度。评分范围0~10分,对应的分值越高表示疼痛程度越剧烈。(4)骨转移病灶缩小面积占比:采用电子计算机断层扫描(computed tomography,CT)对患者进行复查,计算病灶区域占比,并计算接受相应治疗后,病灶缩小面积占原病灶面积的百分比作为骨转移病灶缩小比率。(5)不良反应发生率,包括消化道症状、头颈区不适、唾液腺炎、骨髓抑制等。
1.4 疗效判定
显效:患者骨痛症状完全消失,经医学影像学检查体内转移灶大幅度缩小或消失,血清Tg水平出现下降且下降幅度超过50%。有效:患者骨痛症状缓解,经医学影像学检查见体内转移灶出现缩小,Tg水平出现下降且下降幅度超过25%以上。无效:患者骨痛症状未出现缓解甚至加重、影像学资料显示转移病灶扩大或出现新的转移病灶,Tg水平下降不超过25%[6]。
1.5 统计学方法
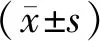
2 结果
2.1 疗效
观察组患者的治疗有效率高于对照组患者,差异有统计学意义(P<0.05)。见表1。
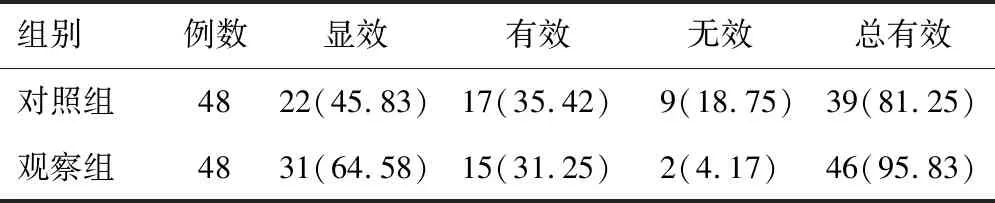
表1 两组研究对象治疗有效率的比较[n(%)]
2.2 治疗前后Tg、VAS、骨转移病灶缩小比率
两组接受治疗前,Tg以及VAS评分差异无统计学意义(P>0.05);接受治疗后,上述指标相比治疗前均出现下降,且观察组低于对照组(P<0.05);与此同时,观察组骨转移病灶缩小面积比率高于对照组,差异有统计学意义(P<0.05)。见表2。
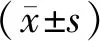
表2 两组治疗前后Tg、VAS、骨转移病灶缩小比率
2.3 治疗后不良反应发生率
两组研究对象接受治疗后,并发症发生率差异无统计学意义(P>0.05)。见表3。

表3 两组研究对象接受治疗后不良反应发生率的比较[n(%)]
3 讨论
放射性核素治疗指的是利用核素的放射性对病变部位进行局部辐射治疗。能够改变细胞形态,进而缓解肿瘤等疾病引发的疼痛症状,应用范围十分广泛。由于该治疗方案能够在较大程度上保证器官与组织之间的完整性,同时能够对处于生长发育中的癌细胞造成毁灭性伤害,进而达到良好的治疗效果[7]。分化型甲状腺癌骨转移是较为常见的甲状腺癌远处转移类型,对患者的生活质量及生存周期造成很大的影响。碘-131治疗甲状腺癌骨转移属于全身治疗,是规范化的治疗方案。主要是利用了甲状腺癌细胞具有吸收碘元素的特点,将放射性碘高浓度聚于甲状腺癌细胞中,从而发挥抑制癌细胞的效果[8-9]。核素锶-89治疗骨转移的主要作用机制是利用其进入体内释放β射线的作用对癌变细胞发挥杀伤性作用[10]。本研究旨在探究上述两种放射性核素应用于分化型甲状腺癌骨转移患者的疗效对比,旨在为相关患者治疗方案的选取发挥一定的参考价值。
研究结果显示,采用锶-89联合碘-131治疗的患者治疗有效率高于单纯使用碘-131治疗的患者。Tg以及VAS评分获得了更显著的下降,且影像学检查结果显示,甲状腺的癌变病灶相比治疗前出现了更显著的降低。分析其原因,锶-89能够发射纯β射线,且其具有同钙元素相似的特点,在经注射进入血液循环后,30%~80%会聚集在骨转移处,对于缓解由于甲状腺癌骨转移造成的疼痛具有良好的治疗效果[11]。李诗运等[12]研究分析指出,锶-89治疗具有良好的靶定向性,且β射线的平均射程可达8 mm,而在骨内的射程大约为3 mm,由于其几乎不含有γ射线,因此尽管在骨转移病灶中具有较大的聚集浓度,但在全身范围内的辐射剂量却相对较低,因而对患者的正常组织以及周围器官不造成显著的负面效应。由于纯β射线能够对病灶及肿瘤细胞发挥显著的抑制作用,因此,患者接受锶-89联合碘-131治疗后,骨转移病灶出现了更大幅度的缩小。血清Tg是甲状腺滤泡上皮细胞分泌的一种大分子糖蛋白,在甲状腺功能正常的状态下储存于甲状腺滤泡胶质中,是甲状腺激素合成的前体蛋白和储存的载体[13-14],依据其生理特性,Tg常作为临床甲状腺功能监测的常用指标之一。当甲状腺组织出现破坏时,Tg水平会升高,因而该水平应用于甲状腺疾病的诊断具有较高的诊断价值。对于单纯使用碘-131治疗分化型甲状腺癌骨转移患者而言,碘-131能够通过细胞表面钠碘转运体特异性浓聚在甲状腺癌转移病灶内,并杀死癌细胞[15-16]。与此同时,锶-89通过β射线的途径对癌细胞发挥抑制作用,两种治疗方案通过不同的作用机制,经过两种作用途径对甲状腺骨转移患者进行治疗,因此观察组研究对象的治疗有效率更高,骨转移病灶面积获得了更加明显的减小。
两组研究对象治疗后不良反应发生率的对比结果显示,差异无统计学意义,表明联合治疗方案具有较高的安全性。本研究的不足之处在于,选取的病例数量有待进一步扩充,与此同时,对两组研究对象的一般资料收集尚且有待进一步完善。更加确切的研究结论还有待大样本数据以及进一步研究的证实。
4 结论
锶-89联合碘-131能够显著提高分化型甲状腺癌骨转移的治疗有效率,且不增加不良反应发生风险,具有较高的应用价值。

