亚低温联合星状神经节阻滞对脑动脉瘤患者介入术后脑功能的影响
刘志军,耿亚东,张鹏,何康,霍俊峰,唐石磊,段国庆,陈小兵,刘红林
(河南大学淮河医院 神经外科,河南 开封 475000)
近年来随着医学设备与材料科学的不断发展,神经介入治疗已成为颅内动脉瘤治疗的重要手段。脑血管痉挛为脑动脉瘤介入术后常见并发症,严重时可引起弥漫性微血管血栓栓塞从而导致患者术后出现脑功能障碍[1-2]。除了传统的钙通道阻滞剂(如尼莫地平)的应用外,近年来星状神经节阻滞也开始应用于临床治疗脑血管痉挛,且取得了较好的效果[3-4],其通过抑制颈交感神经扩张脑血管,增加脑血流量,改善脑部微循环和代谢[5]。临床实践中亚低温目标温度范围为32~35 ℃[6]。本研究观察不同治疗方案下颅内动脉瘤患者介入手术前后各项指标的变化并进行统计学分析,以期指导颅内动脉瘤患者介入术后治疗方案的制定。
1 对象与方法
1.1 研究对象
选取河南大学淮河医院2019年3月至2021年6月择期或急诊接受脑动脉瘤介入治疗的80例患者作为研究对象。根据治疗方案分为4组:A组、B组、C组、D组。通过病历系统及检验系统获取患者术前及术后各项指标数据。患者年龄18~60岁;具有完影像学及检验资料;符合手术适应证且无手术禁忌证;无其他重大身体疾病。两组患者一般资料均衡可比,见表1。

表1 4组一般资料比较
1.2 治疗方法
A组接受传统治疗(使用尼莫地平、维持血容量、使用血管扩张剂等);B组接受神经阻滞;C组接受神经阻滞联合低温(35.0±0.5)℃治疗;D组接受神经阻滞联合低温(32.0±0.5)℃治疗。(1)神经阻滞:患者气管插管后,由麻醉医生在超声引导下进行患侧星状神经节阻滞。使用5~12 MHz线性阵列超声探头,成像深度为2~4 cm,于C6水平,将线性探针置于颈动脉鞘和臂丛之间的前斜角肌。使用平面内技术将绝缘Pajunk针头平环状软骨在C6椎体横突水平进针,穿刺针避开血管神经,针尖抵达颈动脉鞘外下方,颈长肌筋膜表面,回抽无血液及脑脊液,超声影像直视下缓慢注射罗哌卡因10 mL,调整针头使液体均匀分布。注射5 min后,根据出现霍纳氏综合征(上睑下垂、瞳孔缩小、鼻腔僵硬、面部潮红等症状和体征)判定阻滞成功。局麻药注射完毕,留置连续外周神经阻滞导管5 cm,无菌薄膜敷料固定,导管连接水囊镇痛泵给予术后持续阻滞。(2)局部亚低温疗法。采用低温治疗仪联合体表温度传感器,将患者头部体温降至(32.0±0.5)℃或(35.0±0.5)℃ ,根据患者病情维持1~3 d,然后自然复温。
1.3 观察指标
(1)脑血流指标。用经颅多普勒超声探头于术前和术后第3天测量并记录患侧大脑中动脉(middle cerebral artery,MCA)的血流速度。(2)大脑皮质额叶局部脑氧饱和度(regional cerebral oxygen saturation,rSO2)。术前和术后第3天采用近红外光谱仪(INVOS 5100,Somanetics,Troy,USA)记录大脑皮质额叶的局部rSO2。(3)血清内皮素(endothelin-1,ET-1)、S100 β蛋白。于术前和术后第3天从颈内静脉采集静脉血10 mL,置于含EDTA的试管中,以2 000 r·min-1离心20 min分离血清。如果不能立即进行试验,则将血清冷冻-20 ℃,避免反复冻融。所有试剂在2~8 ℃下冷藏,并在使用前平衡至室温30 min。操作步骤按照制造商的说明进行试验并记录结果。(4)认知障碍情况。根据简易智力状态检查量表[7](mini-mental state examination scale,MMSE)改编而成,总分为30分,25~30分为正常状态,21~24分为轻度认知障碍,14~20分为中度认知障碍,≤13分为重度认知障碍。
1.4 统计学方法
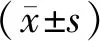
2 结果
2.1 脑部血流动力学指标水平
4组术前大脑中动脉血流速度差异无统计学意义(P>0.05);术后第3天,与A组比较,B、C、D组患者大脑中动脉血流速度均降低,差异有统计学意义(P<0.05);术后第3天,D组与B组患者相比,大脑中动脉血流速度下降(P<0.05)。4组患者术前rSO2差异无统计学意义(P>0.05);术后第3天,与A组相比,C、D组患者rSO2升高,差异有统计学意义(P<0.05)。见表2。
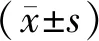
表2 4组手术前后脑部血流动力学指标水平比较
2.2 血液标志物
4组术前S100 β差异无统计学意义(P>0.05);术后第3天,与A组比较,B、C、D组患者ET-1降低,差异有统计学意义(P<0.05);术后第3天,D组与B组患者相比,ET-1下降(P<0.05)。4组患者术前S100 β差异无统计学意义(P>0.05);术后第3天,与A组相比,B、C、D组患者S100 β降低,差异有统计学意义(P<0.05);术后第3天,D组与B组患者相比,S100 β下降(P<0.05)。见表3。
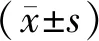
表3 4组手术前后血液标志物整体比较
2.3 MMSE评分
4组术前MMSE评分差异无统计学意义(P>0.05)。术后第3天,与A组比较, B、C、D组患者MMSE评分均升高(P<0.05);与B组比较, D组患者MMSE评分升高(P<0.05)。在同组内,与术前相比,A、B、C、D 4组术后第3天MMSE评分差异有统计学意义(P<0.05),且术后第3天较术前相比,MMSE评分升高。见表4。
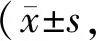
表4 4组手术前后MMSE评分比较分)
3 讨论
颅内动脉瘤是脑血管动脉壁的局部扩张,易破裂引发出血。未破裂的脑动脉瘤通常无症状,当体积大到足以压迫附近的神经或脑组织引起相关症状,如头痛、癫痫、视力减退甚至丧失和面部疼痛等[8]。脑动脉瘤发病率及致残致死率高[9-10],目前主流治疗方法是开颅手术夹闭或血管内介入栓塞[11-12]。超声引导下星状神经节阻滞术为慢性疼痛、术后疼痛和交感神经兴奋患者提供了有价值的治疗[13-14]。大量与缺血脑损伤相关的生化物质活性已被证明受亚低温影响,有利于神经元的保护,这在大鼠应用亚低温减轻缺血性脑水肿实验中也得到了证实[15]。临床试验表明亚低温可减少活性氧中间产物的产生从而减少对细胞的损伤,并能通过降低代谢率减少耗氧量[16-17]。根据动脉CO2分压严格控制正常通气和过度通气时,rSO2和颈内静脉血氧饱和度之间存在良好相关性,局部脑血流某种程度可反映局部脑氧饱和度[15]。
脑动脉瘤介入治疗中穿刺股动脉或操作时,血管内皮受到损伤会释放大量炎症活性因子和血管收缩剂,如ET-1等。ET-1具有较强的血管收缩作用,在脑血管痉挛的变化过程中起到至关重要的作用,其大量生成可引起颅内血管自主调节的丧失,从而引起脑血管病理生理学的改变以影响患者预后[18]。本研究发现:与A组比较,B、C、D组患者术后第3天ET-1降低;与B组比较,D组患者血ET-1降低。这表明星状神经节阻滞和或联合32 ℃和35 ℃局部低温疗法均可通过降低患者ET-1水平,有效缓解脑动脉痉挛,保护脑功能,且(32.0±0.5)℃亚低温较(35.0±0.5 )℃效果更为明显。脑血管痉挛是脑动脉瘤介入术后常见并发症,在约2/3动脉瘤介入术后患者中发生。脑血管痉挛的传统治疗方法包括钙通道阻滞剂、维持血容量、血管扩张剂等,本研究发现,与术前比较,4组患者术后大脑中动脉血流速度均降低,局部脑氧饱和度升高,差异有统计学意义。这肯定了传统治疗方法的效果,支持在无条件实施星状神经节和局部低温的基层医疗单位,传统治疗方法可作为首选治疗方案。但由于其伴随的其他并发症,某些治疗措施不会轻易采用,而新的治疗方案(如镁、他汀类药物、内皮素拮抗剂等)临床疗效则需要大样本临床试验以证明其有效性[19]。脑血流速度与血管痉挛已被证实存在关联,当心输出量和血压保持不变时,脑血流速度增加幅度越大,脑血管痉挛越严重[20]。本研究发现:与A组比较,B、C、D组患者术后大脑中动脉血流速度降低;与B组比较,D组患者大脑中动脉血流速度降低。这表明星状神经节阻滞和其联合(32.0±0.5)℃和(35.0±0.5)℃局部亚低温疗法均可改善大脑中动脉的血流动力学指标,且(32.0±0.5)℃亚低温效果较(35.0±0.5)℃更为明显。S100 β蛋白已被证明可用于评估脑损伤程度和颅脑恢复情况[21]。本研究中B、C、D组患者术后较术前S100 β水平降低,表明星状神经节阻滞和其联合(32.0±0.5)℃或(35.0±0.5)℃局部亚低温疗法均可改善S100 β水平。本研究发现,与A组相比,B、C、D组患者术后较术前MMSE评分均升高,表明与传统治疗方法相比,星状神经节阻滞和其联合亚低温疗法的患者术后认知功能提升。与B组比较, C、D组患者术后MMSE评分升高,差异有统计学意义,表明星状神经节阻滞联合亚低温疗法较单纯星状神经节阻滞患者术后认知功能提升。
4 小结
星状神经节阻滞联合亚低温疗法可通过减少ET-1释放以缓解脑血管痉挛从而改善脑循环,升高rSO2,可降低脑细胞损伤指标S100 β,改善患者认知功能,其中星状神经节阻滞联合(32.0±0.5)℃亚低温疗法脑保护作用最为明显。本研究也暴露了一些问题:患者术后清醒状态行亚低温疗法时会偶发寒战等不良反应;无持续有效的后期随访数据;病例数较少且为单中心研究等问题。后期拟进一步增加病例数量并拓展为多中心临床研究并进一步完善后期随访数据以追踪患者术后远期疗效。

