肿瘤标志物AFP、AFP-L3 及DCP 联合检测对原发性肝癌的临床诊断价值
廖春娇 刘义文
原发性肝癌(primary liver cancer, PLC)属于临床较为常见的恶性肿瘤之一, 在我国恶性肿瘤发病率中排第4 位, 多由肝炎肝硬化病情持续进展所致, 死亡率较高, 且近年来患病率呈逐年上升趋势[1]。PLC 主要指人体肝内胆管上皮细胞或肝细胞发生的癌变, 本病临床特点为发病率高、病程进展快、侵袭性强、生存率低等, 严重危害患者身心健康[2]。目前PLC 预后较差, 美国PLC 患者5 年生存率仅为10%, 预后较差的原因主要与患者早期缺乏自觉症状存在一定关系, 在明确诊断时已经出现肝内或肝外转移[3]。因此早期发现PLC 并采取有效治疗可有效提高患者生存率。相比病理与影像学检查, 肿瘤标志物能够快速且简单地进行检测, 随着分子生物学技术的不断发展, 肿瘤标志物种类也在不断增多。本文将临床常见的肿瘤标志物AFP、AFP-L3 及DCP 联合检测用于诊断PLC, 分析其诊断价值, 结果报告如下。
1 资料与方法
1.1 一 般 资 料 将 本 院2020 年1 月~2022 年1 月收入的40 例PLC 患者作为研究组, 50 例乙型肝炎肝硬化患者作为对照组, 另选取同期60 例健康体检者作为健康组。研究组男27 例, 女13 例;年龄40~78 岁, 平均年龄(58.74±6.42)岁;最大肿块直径1.5~15.2 cm, 平均最大肿块直径(6.56±2.88)cm。对照 组 男32 例, 女18 例;年 龄38~72 岁, 平 均 年 龄(57.98±6.66)岁;最大肿块直径1.4~15.4 cm, 平均最大肿块直径(6.34±3.02)cm。健康组男35 例, 女25 例;年龄35~70 岁, 平均年龄(56.85±7.28)岁。三组性别、年龄等一般资料比较, 差异无统计学意义(P>0.05), 具有可比性。见表1。本研究经医院伦理委员会批准, 患者知情同意并签署知情同意书。
表1 三组一般资料比较(n, ±s)
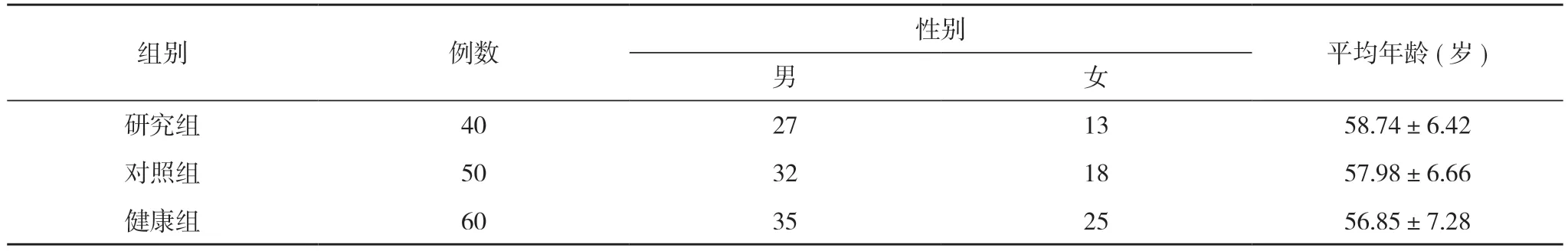
表1 三组一般资料比较(n, ±s)
注:三组比较, P>0.05
组别 例数 性别 平均年龄(岁)男女研究组 40 27 13 58.74±6.42对照组 50 32 18 57.98±6.66健康组 60 35 25 56.85±7.28
1.2 纳入及排除标准 纳入标准[4]:①研究组患者手术后病理组织学确诊PLC;②对照组患者乙型肝炎肝硬化符合临床诊断标准;③均结合患者症状、体征及多项检查明确诊断。排除标准:①合并其他位置肿瘤;②无法积极配合此次研究;③相关资料不完善。
1.3方法所有入选研究者均在首诊或入院第2 天,未开展任何治疗前取清晨空腹静脉血, 血标本留取后30 min 内以3000 r/min 的速度离心15 min, 取上层血清,EP 管分装后-80℃冻存备用, 避免标本溶血及反复冻融。AFP、AFP-3、DCP 水平均严格按照试剂及仪器说明书进行操作检测[5]。研究组患者均给予支持治疗, 包括镇痛、纠正贫血、营养支持、控制合并症等,根据患者不同分期进行个体化的综合治疗, 包括手术、肝动脉化疗栓塞、射频消融、微波消融、冷冻、激光等治疗。
1.4 观察指标 ①比较三组AFP、AFP-L3、DCP 水平,其中临床上通常采用AFP-L3 占AFP 的比例诊断PLC,即AFP-L3%=AFP-L3/AFP×100%。②比较研究组不同类型患者AFP、AFP-L3、DCP 水平。③研究组治疗前后AFP、AFP-L3、DCP 水平。
1.5 统计学方法 采用SPSS18.0 统计学软件处理数据。计量资料以均数±标准差(±s)表示, 两两比较采用t 检验, 多组比较采用方差分析;计数资料以率(%)表示, 采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 三组入选者AFP、AFP-L3、DCP 水平比较 三组AFP、AFP-L3%、DCP 水平比较, 差异有统计学意义(P<0.05);研究组AFP、AFP-L3%、DCP 水平均高于对照组、健康组, 差异有统计学意义(P<0.05)。见表2。
2.2 研究组不同类型患者AFP、AFP-L3、DCP 水平比较 研究组不同类型患者AFP、AFP-L3%、DCP 水平比较, 差异有统计学意义(P<0.05);弥漫型肿块患者AFP、AFP-L3%水平高于结节型单发、结节型多发肿块患者, 多发肿块患者DCP 水平高于结节型单发、弥漫型肿块患者, 差异有统计学意义(P<0.05)。见表3。
2.3 研究组治疗前后AFP、AFP-L3、DCP 水平 研究组治疗后AFP、AFP-L3%、DCP 水平均低于治疗前,差异有统计学意义(P<0.05)。见表4。
表2 三组AFP、AFP-L3、DCP 水平比较( ±s)

表2 三组AFP、AFP-L3、DCP 水平比较( ±s)
注:与研究组比较, aP<0.05
组别 例数 AFP(ng/ml) AFP-L3%(%) DCP(mAU/ml)研究组 40 2891.29±85.65 9.82±2.41 2147.21±56.98对照组 50 63.58±6.54a 5.21±1.06a 29.98±4.36a健康组 60 10.11±1.65a 1.21±0.26a 5.21±1.01a
表3 研究组不同类型患者AFP、AFP-L3、DCP 水平比较( ±s)
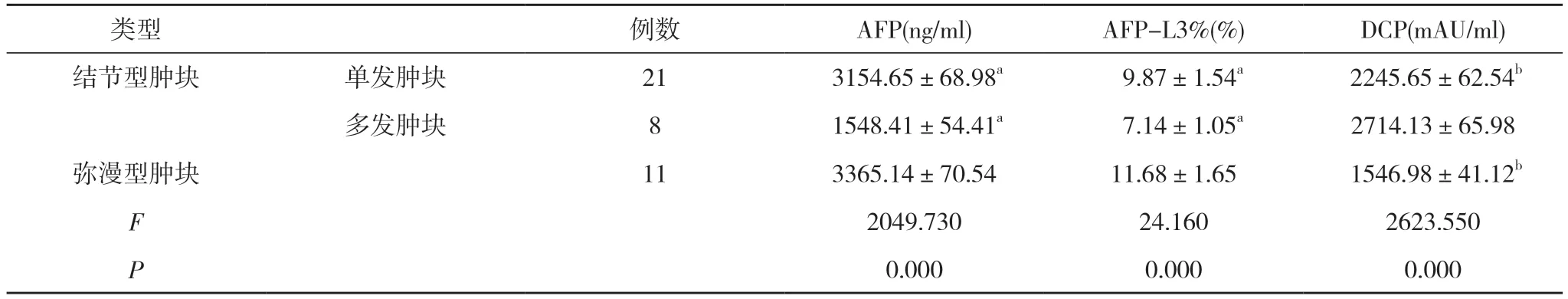
表3 研究组不同类型患者AFP、AFP-L3、DCP 水平比较( ±s)
注:与弥漫型肿块患者比较, aP<0.05;与多发肿块患者比较, bP<0.05
类型 例数 AFP(ng/ml) AFP-L3%(%) DCP(mAU/ml)结节型肿块 单发肿块 21 3154.65±68.98a 9.87±1.54a 2245.65±62.54b多发肿块 8 1548.41±54.41a 7.14±1.05a 2714.13±65.98弥漫型肿块 11 3365.14±70.54 11.68±1.65 1546.98±41.12b F 2049.730 24.160 2623.550 P 0.000 0.000 0.000
表4 研究组治疗前后AFP、AFP-L3、DCP 水平比较(n=40, ±s)

表4 研究组治疗前后AFP、AFP-L3、DCP 水平比较(n=40, ±s)
注:与治疗前比较, aP<0.05
时间 AFP(ng/ml) AFP-L3%(%) DCP(mAU/ml)治疗前 2891.29±85.65 9.82±2.41 2147.21±56.98治疗后 546.98±12.41a 2.01±0.54a 46.42±4.09a t 171.319 20.000 232.581 P 0.000 0.000 0.000
3 讨论
肝癌属于临床较为常见的恶性肿瘤之一, 多由肝炎肝硬化病情持续进展所致, 死亡率较高, 且近年来患病率呈逐年上升趋势。患者早期起病隐匿, 缺乏典型症状, 导致临床出现症状后已经进入中晚期阶段, 导致外科切除等治疗无法进行[6]。早期诊断是降低患者死亡的重要方式, 并能够改善患者预后。肿瘤标志物是由肿瘤细胞分泌或脱落到体液及组织液中的活性物质, 或是由机体产生新的生物化学反应并进入到体液及组织液中的物质, 能够反映肿瘤细胞的转化特性, 对肿瘤的早期筛查和诊断具有重要的价值[7]。同一种肿瘤能够产生多种标志物, 而肿瘤标志物的联合检测可以弥补单项检测灵敏度差的缺陷, 从而提高诊断的阳性率[8]。
本文选取临床常见的几项肿瘤标志物进行研究,结果显示, 研究组AFP、AFP-L3、DCP 水平均高于对照组、健康组, 差异有统计学意义(P<0.05)。证实PLC患者与乙型肝炎肝硬化患者及健康者之间存在明显差异, 因此可用于临床PLC 诊断。AFP 目前仍是临床医师针对PLC 患者所采取的常规诊断方法, 该指标能够在肝癌出现临床症状前的8~11 个月检测得出阳性结果, 早期筛查优势明显, 还可用于PLC 治疗效果的评价[9]。AFP 水平的升高是诱发肝硬化发展的危险因素,肝硬化患者的AFP 水平明显高于正常患者, 且随着患者炎性反应分级上升, AFP 水平也逐渐增加。但AFP测定存在诸多弊端, 其假阳性率偏高, 临床阳性率通常高达60%~80%, 特异性及敏感性均不太理想[10]。DCP又被称为维生素K 缺乏诱导的蛋白质, PLC 患者的DCP 水平明显较高, 该指标在健康者血清中无法及时检出, 也证实了DCP 的诊断价值[11]。目前DCP 已经被认为是肝癌的预后指标之一, 血清DCP 水平可提示癌组织渗透增长, 有多个肿瘤结节的存在, 其表达水平与肝癌患者肿瘤大小及数据均存在密切相关[12]。研究显示[13], DCP 不仅有生长因子样作用, 并能够促进血管内皮细胞增殖, 促进血管生成因子类物质, 提示与肿瘤发展存在密切关系。AFP 可分为3 个亚型, AFP-L3是其中一个亚型, 属于肝癌细胞所特有, 其表达水平随肝癌严重程度而变化, 可作为检测PLC 病情的重要指标[14]。本研究中, 研究组治疗后AFP、AFP-L3、DCP水平均低于对照组, 差异有统计学意义(P<0.05)。由此证实AFP、AFP-3、DCP 可用于患者治疗前后的判断,并进一步了解患者治疗效果。因此, 三者联合检测对疾病诊断具有重要意义。
综上所述, AFP、AFP-L3、DCP 联合检测对PLC患者的诊断具有重要意义, 并能够了解患者的治疗情况, 判断患者预后。

