改性正渗透膜去除水中全氟化合物研究
金海洋,余 婵,张 为,刘 敏,张雨婷,孙婷婷
(1.长江科学院 流域水环境研究所,武汉 430010; 2.长江科学院 流域水资源与生态环境科学湖北省重点实验室,武汉 430010)
0 引 言
全氟化合物(Perfluorinated Compounds,PFCs)是指化合物分子中与碳原子连接的氢原子全部被氟原子取代的一类新型持久性有机污染物,因其具有优良的稳定性、表面活性以及疏水疏油等性能,被广泛用于纺织、润滑剂、表面活性剂、食品包装、不粘锅涂层、电子产品、防火服、灭火泡沫等领域[1]。其中,目前使用量最大的2种全氟类化合物(Perfluorinated Compounds,PFCs)是全氟辛酸(Perfluorooctanoic Acid,PFOA)和全氟辛烷磺酸(Perfluorooctane sulfonates,PFOS)[2]。PFCs的大量生产和使用带来了一系列环境污染和威胁人类身体健康等问题。研究表明,PFCs对人体的免疫系统、肝组织系统、呼吸系统等有不同程度的损害[3-4]。此外,PFCs具有远距离的传输能力和高水溶性,能造成海水、地表水和地下水污染。据文献报道,我国绝大部分的地表水环境均受到PFCs污染,存在形式主要以PFOS和PFOA为主[5-7]。
近年来,针对水环境中PFCs的控制和去除技术研究成为环境保护科学研究领域的热点[8]。由于PFCs的化学性质十分稳定,常规的物理处理和生物降解方法都难以有效将其降解[9-10]。目前,吸附法[11]、高级氧化法[12-15]、膜处理法[16-18]等技术已被广泛应用于去除工业废水中PFCs的研究。其中,膜处理工艺过程简单,对高浓度和低浓度的PFCs均具有较高的去除效率,而且膜组件简单紧凑且易于实现自动化操作,相比于其他方法优势明显。目前限制膜技术进一步应用的主要问题是运行成本和膜污染[19]。正渗透(Forward Osmosis,FO)技术是21世纪以来兴起的一种新型膜分离技术[20],是指水通过选择性渗透膜从具有较高水化学势的区域(原料液侧)向具有较低水化学势的区域(汲取液侧)运输。这一过程是由膜上溶质浓度的差异驱动的,膜上的溶质浓度允许水通过,但拒绝大多数溶质分子或离子。相比其他膜分离技术,正渗透具有膜污染程度较低、污染过程更加可逆、低能耗和低成本等优势[21-23]。而且通过设置膜两侧的高渗透压差以及选择合适的膜材料,正渗透可以实现对众多的污染物的有效截留,同时可以实现高水通量和高水回收率[23-24]。目前正渗透技术在水处理中的应用仍存在较多挑战,其中最关键的在于缺乏适宜专用的正渗透膜。目前正渗透膜用于去除水中PFCs的研究尚未见报道。
本文研究了自主研制的氯化银表面改性正渗透膜对水中典型PFCs(PFOA和PFOS)的去除性能,分析膜表面性能与PFCs去除效果的关系,探讨了水中共存物质对改性正渗透膜去除PFCs性能的影响,初步揭示了改性正渗透膜去除PFCs的机理。本文的研究成果可为正渗透膜分离技术去除水中PFCs的实际应用提供试验基础和技术支撑。
1 材料和方法
1.1 主要仪器与化学试剂
主要仪器有液相色谱串联质谱仪(美国PerkinElmer公司生产,型号为QSightTM 210)、电子分析天平(普利赛斯国际贸易上海有限公司生产,型号为XS125A)、扫描电镜(荷兰FEI 公司生产,型号为FEI Quanta 200)、接触角测定仪(德国Kruss公司生产,型号为DSA100)、Zeta电位测试仪(奥地利安东帕公司生产,型号为surpass)、超纯水机(密理博中国有限公司生产,型号为Direct 8)。
主要化学试剂有:氯化钠(AR)、全氟辛酸(≥97%)、全氟辛烷磺酸(≥97%)、腐殖酸(AR)、牛血清蛋白(≥98%)、氢氧化钠(AR)、 盐酸(AR)等,AR表示分析法(Analytically Pure),试验中所用溶液均用超纯水配制。
1.2 改性正渗透膜的制备
首先通过界面聚合反应制备聚酰胺薄层复合正渗透膜,然后采用表面矿化改性制备氯化银改性正渗透膜,具体操作步骤和基本原理见前期研究成果[25]。改性膜上的矿化度(Mineralization Degree,MD)通过控制交替浸泡的循环次数来控制。分别制备交替浸泡循环次数为1、2、4、5、6次的改性正渗透膜,并对应记为M1、M2、M4、M5、M6,未经过矿化改性的聚酰胺正渗透膜记为M0。
1.3 改性正渗透膜的结构表征
采用扫描电镜测量正渗透膜表面形貌变化。测试前,每个膜样品真空干燥24 h,然后进行喷金处理以增强其导电性能。测量表面形貌的同时利用能谱仪(EDX)附件对膜的元素组成进行分析。
采用接触角仪测定正渗透膜表面接触角。每个膜样品在测量前真空干燥24 h。每个类型样品测量2张膜片,每张膜片上选取不同位置测试5次,取平均值。
采用Zeta电位测试仪测定正渗透膜表面的带电情况。通过记录通过样品表面的电解质溶液pH值变化过程中样品表面双电层中流动电位差的变化,根据Helmholtz-Smoluchowski方程计算得到Zeta电位[26]。测试过程中采用的电解质溶液为0.01 mmol/L KCl溶液,pH值测量范围为4~10,通过0.1 mol/L盐酸和氢氧化钾来进行调节。
1.4 改性正渗透膜对水中PFCs的去除性能
测试所制备的改性正渗透膜对水中典型PFCs(PFOA和PFOS)的去除性能,选取1 mol/L的氯化钠溶液为汲取液,用超纯水配制10 μg/L的PFOS和PFOA溶液作为原料液,利用自制的正渗透膜性能测试装置(示意图见图1,实物见图2)测试不同矿化度的改性正渗透膜的水通量以及对PFOS/PFOA的去除效果。测试过程中,汲取液和原料液的流速均设定为20 L/h,测试时间为1 h。

图1 实验室自制正渗透测试装置示意图Fig.1 Schematic of the laboratory-scale forward osmosis testing device

图2 正渗透装置实物Fig.2 Photo of forward osmosis testing device
利用电子天平记录试验前后汲取液的质量来计算水通量。水通量Jw是指单位时间、单位膜面积内原料液侧渗透到汲取液侧的水的体积,计算公式为
(1)
式中:Jw为水通量(L/(m2·h));Δw为汲取液增加的质量(g);ρ为水的密度(kg/L);Am为膜表面积(m2);Δt为测试时间(h)。
通过测量试验前原料液中和试验后汲取液中的PFOS和PFOA的浓度来计算膜对它们的截留率,其中PFOS和PFOA的浓度采用液相色谱-质谱联用法测定。截留率R是指原料液侧渗透到汲取液侧过程中膜对渗透液中PFCs的截留能力,其计算公式为
(2)
式中:Cd为测试结束时汲取液中PFCs浓度(μg/L);Cf为测试开始时原料液中PFCs浓度(μg/L);Vd为测试结束时汲取液的体积(L);Vp为测试结束时汲取液增加的体积(L)。
1.5 水中共存物质对改性正渗透膜去除PFCs性能的影响
选取1 mol/L的氯化钠溶液为汲取液,设置4种原料液:第1种为10 μg/L的PFCs超纯水溶液;第2种为在10 μg/L的PFOS超纯水溶液中添加10 mmol/L的氯化钠(NaCl);第3种为在10 μg/L的PFOS超纯水溶液中添加5 mg/L的有机物(腐植酸HA和牛血清蛋白BSA);第4种为在10 μg/L的PFOS超纯水溶液中同时添加10 mmol/L的NaCl和5 mg/L的BSA。选用交替浸泡4次的氯化银改性正渗透膜,分别测试改性膜对这4种原料液中PFOS的截留率。测试过程中,汲取液和原料液的流速均设定为20 L/h,测试时间为1 h。
2 结果与分析
2.1 改性正渗透膜的表面形貌
未经矿化改性的聚酰胺正渗透膜以及不同矿化度的氯化银改性正渗透膜的表面形貌如图3所示。从图3可知,聚酰胺正渗透膜在经过表面矿化改性后,膜表面出现均匀分布的氯化银颗粒,而且氯化银颗粒的数量随着改性过程中交替浸泡循环次数的增加而增多。未改性的聚酰胺正渗透膜以及不同矿化度的氯化银改性正渗透膜的EDX元素组成分析数据(C、N、O、S、Ag和Cl)如表1所示。从表1中可知,聚酰胺正渗透膜在经过表面矿化改性后,膜表面出现了Ag元素和Cl元素,而且2种元素的含量均随着改性过程中交替浸泡循环次数的增加而增多。SEM的表面形貌及元素组成分析结果表明,矿化改性后氯化银确实沉积在改性膜的表面。

表1 不同矿化度的氯化银改性正渗透膜的EDX元素组成Table 1 EDX element composition of modified FO membranes with different degrees of silver chloride mineralization

图3 不同矿化度的氯化银改性正渗透膜的SEM图像Fig.3 SEM surface images of modified FO membranes with different degrees of silver chloride mineralization
2.2 改性正渗透膜的表面性质
未改性的聚酰胺正渗透膜以及不同矿化度的氯化银改性正渗透膜的接触角数据如图4所示。从中可知,对聚酰胺正渗透膜进行表面矿化改性后,膜的接触角急剧减小,表明改性后膜的亲水性能得到较大提升,这有利于提高膜的水通量和降低膜的污染倾向[27]。在经过交替浸泡循环4次改性后,膜的接触角由65.61°±1.80°减小至40.10°±1.20°。需要指出的是,在一定矿化度范围内,改性膜的接触角随着改性过程中交替浸泡循环次数的增加而减小,而当改性过程中交替浸泡循环次数超过4次后,改性膜的接触角不再继续减小,而是基本保持不变。
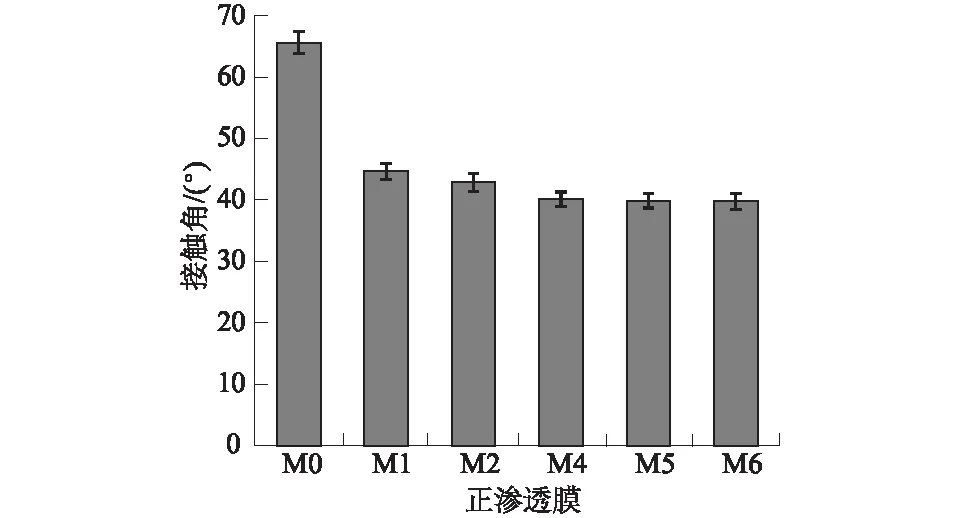
图4 不同矿化度的氯化银改性正渗透膜的接触角Fig.4 Contact angles of modified FO membranes with different degrees of silver chloride mineralization
不同矿化度的氯化银改性正渗透膜的表面Zeta电位随pH的变化曲线如图5所示。从图5可知,随pH值的增加,所有膜的表面Zeta电位的负值越来越小,即所有膜的表面带有的负电荷越来越多。不同pH值条件下,聚酰胺正渗透膜在经过表面矿化改性后,膜表面带有的负电荷均有多增加。而且改性膜表面带的负电荷随改性过程中交替浸泡循环次数的增加而增多,原因是改性膜表面的氯化银颗粒会吸附溶液中的少量阴离子[28]。氯化银改性正渗透膜表面负电荷增多,可以增强膜对带负电的盐离子和污染物的排斥作用,从而提高膜的截留性能。
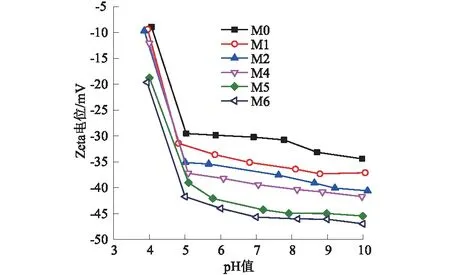
图5 不同矿化度的氯化银改性正渗透膜的表面Zeta电位随pH值的变化Fig.5 Surface Zeta potential of modified FO membranes varying with pH value under different degrees of silver chloride mineralization
2.3 改性正渗透膜对PFCs的去除性能
未改性的原始正渗透膜以及不同氯化银矿化度的改性正渗透膜对PFOS/PFOA的去除性能如表2所示。由表2可知,氯化银矿化改性膜相比未改性的原始膜表现出更高的水通量和PFCs截留率。随着改性过程中交替浸泡循环次数从0增加到4(M0—M4),膜的水通量与对PFCs的截留率逐渐增大。继续增加改性膜的矿化度(M5和M6),膜的水通量与对PFCs的截留率开始下降。交替浸泡4次制备出的改性膜具有最佳的全氟化合物去除效果,对PFOA和PFOS的去除率分别为96.2%和95.7%。同时,交替浸泡4次制备出的改性膜也具有最大的水通量22.5 L/(m2·h)。在保证对全氟化合物具有高效去除效果的情况下,水通量越大表明膜的处理能力越大。未改性的正渗透膜虽然也具备较高的PFCs截留能力,但水通量太低,处理能力较差。

表2 不同矿化度的氯化银改性正渗透膜对PFOA和PFOS的去除效果Table 2 Removal of PFOA and PFOS by modified forward osmosis membrane with different degrees of silver chloride mineralization
氯化银表面矿化改性对正渗透膜的水通量的影响主要表现在以下两个方面:一是氯化银在膜表面的沉积提高了膜表面的亲水性能,使膜在正渗透过程中会优先吸附水分子从而提高膜的水通量;二是氯化银在膜表面的沉积对水分子渗透通过膜会产生阻碍作用从而降低膜的水通量。在一定矿化度范围内(M0—M4),改性膜的水通量随着矿化度的增加而不断增大,主要是因为此时膜的亲水性能增强所产生的水通量增强效应大于膜表面氯化银阻碍水分子通行产生的水通量降低效应。当继续增加改性膜的矿化度时(M5和M6),膜的水通量不再继续增加,反而开始下降,这是因为此时氯化银含量的继续增加不再提升膜的表面亲水性能,也就不会对膜的水通量产生进一步的增强效应,而氯化银对水分子通行的阻碍作用仍在增强。
在一定范围内(M0—M4),随着改性膜矿化度的增加,膜表面亲水性随之增强,膜表面多带负电荷随之增加,对PFCs的截留性能也随之加强。有机污染物主要通过疏水作用和静电作用吸附在膜表面[29-30]。膜表面亲水性增强,降低了膜与PFCs之间的疏水作用。另一方面,PFOS和PFOA在水溶液中发生电离作用而带负电,改性膜表面带的负电荷越多,对PFCs的静电排斥力越大。因此,改性正渗透膜主要通过降低与PFCs的疏水作用以及增强与PFCs的静电排斥作用,从而实现对PFCs的高效截留。需要指出的是,当改性膜的矿化度超过一定数值时(M5和M6),虽然膜具备较好的表面亲水性和较多的表面负电荷,膜对PFCs的截留能力并未继续提高。
PFOS和PFOA在水溶液中发生电离反应式分别如下:
CF3-(CF2)7-COOH→CF3-(CF2)7-COO-+H+;
CF3-(CF2)7-SO3K→CF3-(CF2)7-SO3-+K+。
2.4 水中共存物质对改性膜去除PFOS性能的影响
水中不同物质共存时,改性正渗透膜对PFOS的截留率如表3所示,表3中同样列出了各试验条件下的膜电位。对不同物质共存条件下改性膜对PFOS截留率的影响逐一进行分析。
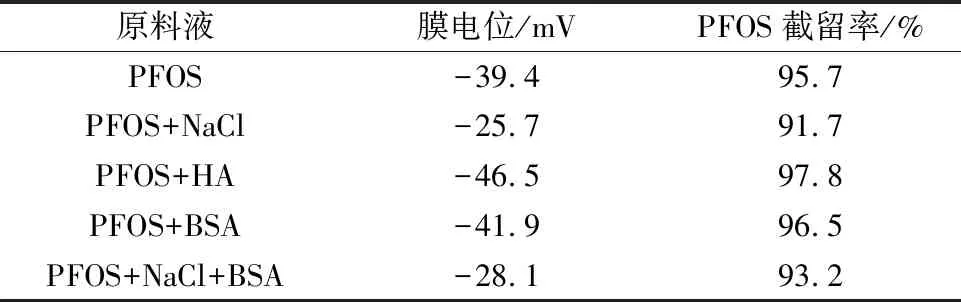
表3 不同物质共存条件下改性膜的表面电位及PFOS截留率Table 3 Surface potential and PFOS rejection of the modified membrane under the coexistence of different substances
2.4.1 NaCl对改性正渗透膜去除PFOS的影响
根据德拜长度常数及双电层理论,向溶液中加入高化合价离子或增加溶液离子浓度,均可减小膜分子间的静电斥力,进而有利于PFCs在膜面的吸附[31]。向PFOS原料液中添加10 mmol/L 的氯化钠溶液后,氯化钠中的钠离子可以减小双电层厚度,从而使膜面电位减小。原料液中的钠离子受膜表面的负电荷吸引,二者通过中和作用,膜面负电荷降低和膜电位下降,进而导致膜表面与PFOS的静电斥力减小,污染物在膜面的吸附量增大。膜对PFOS吸附作用增强和静电排斥作用减弱,促进了PFOS在正渗透膜分离过程中的溶解扩散作用,导致膜对于PFOS的截留率有所下降。
2.4.2 HA对改性正渗透膜去除PFOS的影响
PFCs的溶液体系加入HA后,由于HA含大量羧基,膜面的最终电位大幅增加,说明HA的加入增加了PFCs与膜面的静电斥力,从而增加了膜对PFCs的去除率。同时,PFOS会与HA结合,这一定程度上增加了污染物的亲水性,从而减弱了污染物与正渗透膜之间的疏水作用,导致膜对PFC的去除率降低。综上可知,在加入HA后,两种作用同时发生,增加的静电斥力作用对膜去除PFCs性能的增强效应超过了减弱的疏水作用带来的降低效应,最终表现出的结果是PFOS的去除率仍有所增加。
2.4.3 BSA对改性正渗透膜去除PFOS的影响
PFCs的溶液体系加入BSA后,由于BSA含有少量的羟基荷氨基,膜面的最终电位小幅增加,表明BSA的加入会增加PFCs与膜表面的静电斥力。此外,PFOS与BSA可以结合,结合后污染物的亲水性会得到增强,进而导致污染物与正渗透膜之间的疏水作用会减弱。综上可知,在加入BSA后,两种作用同时发生,增加的静电斥力作用对膜去除PFCs性能的增幅效应超过了减弱的疏水作用带来的减幅效应,使得PFOS的去除率得到一定程度的提高。同HA相比,BSA的加入最膜面最终电位的增幅及污染物亲水性的增强相对较小,因此在添加同等浓度的HA和BSA条件下,HA的加入对正渗透膜去除PFCs的性能提升更大。
2.4.4 NaCl和BSA共存对改性正渗透膜去除PFOS的影响
PFCs的溶液体系同时加入NaCl和BSA后,正渗透膜去除PFOS的性能受到2种物质的综合影响。一方面钠离子的加入会降低膜电位,膜与污染物的吸附作用增强,静电排斥作用减弱;另一方面BSA的加入会增加膜电位,同时一定程度上增加污染物的亲水性,从而增加PFCs与膜面的静电斥力,并减弱污染物与正渗透膜之间的疏水作用。从表3可知,最终膜电位仍然下降,正渗透膜对PFOS的截留率有所下降。这表明NaCl和BSA共存时,NaCl对膜去除PFCs性能的减幅效应超过了BSA的增幅效应。
3 结 论
本文研究制备了氯化银表面改性正渗透膜,研究了改性膜对水中典型PFCs(PFOA和PFOS)的去除性能,分析膜表面性能与PFCs去除效果的关系,探讨了水中共存物质对改性正渗透膜去除PFCs性能的影响,主要结论如下:
(1)氯化银表面改性并未破坏正渗透膜的内部结构,改性膜具有更强的表面亲水性和更多的膜表面负电荷。
(2)改性膜具有更高的水通量和PFCs截留率。一定范围内随着改性膜矿化度的增加,膜的水通量与对PFCs的截留率逐渐增大。但氯化银过量沉积会降低正渗透膜对PFCs的截留性能。
(3)正渗透膜与PFCs的相互作用方式主要为疏水作用和静电相互作用。改性正渗透膜主要通过降低与PFCs的疏水作用以及增强与PFCs的静电排斥作用,从而实现对PFCs的高效截留。水中不同物质共存会对正渗透膜与PFCs之间的疏水作用及静电排斥作用产生影响,从而影响膜对PFCs的截留性能。

