发酵法生产茶叶籽油中不同成分的分层机理
杨鹏鸣,蔡祖国,姜金仲
(1.河南科技学院 园艺园林学院,河南 新乡 453003;2.贵州师范学院 贵州特色生物资源开发利用重点实验室,贵州 贵阳 550018;3.贵州酵油坊茶籽科技有限公司,贵州 黔南 551303)
茶树(Camelliasinensis)是我国重要的经济植物之一,茶叶籽含油率25%~35%,富含不饱和脂肪酸、维生素E和茶多酚[1-2]。2009年,卫生部正式批准茶叶籽油为新资源食品[3]。茶叶籽含有14%~18%的淀粉,在压榨过程中会吸附籽油,降低茶叶籽油的产量。同时茶叶籽中的茶皂甙等物质也会污染茶叶籽油,使茶叶籽油的颜色暗淡,口味苦涩,难以直接食用。因此,使用传统压榨工艺生产茶叶籽油效率低下[3]。其他方法如溶剂浸提法、水酶法、超临界CO2萃取法由于存在着食品安全风险、环境安全风险或成本高昂等问题,导致目前国内外还没有成熟高效的茶叶籽油生产工艺[3-6]。大量的茶叶籽在茶园中自然腐烂,成为茶业生产中的“废弃物”,造成巨大的资源浪费[7]。
茶叶籽油发酵分层生产是一种新的茶叶籽油提取工艺[8]。将茶叶籽去壳、加水浸泡、加水打浆,过滤后形成茶叶籽浆;茶叶籽浆在一定条件下静置发酵后分为3层,顶层为油脂体、中层为富含茶皂甙的发酵液、底层为茶叶籽淀粉。取上层的油脂体加热即可得到茶叶籽油,剔除了淀粉、茶皂甙等其他成分对油料的吸附和污染作用,因而产油率高、品质好,是目前唯一能同时进行茶叶籽油和淀粉批量生产的工艺[8]。剩余富含茶皂甙的发酵液还能进一步开发利用。茶叶籽浆体系稳定,具有胶体的典型特征,在不发酵条件下很难分层[8]。发酵离不开微生物的作用[9],这些微生物主要有酵母菌(Meyerozymacaribbica)和植物乳杆菌(Lactobacillusplantarum),其中茶叶籽乳杆菌数量的变化和油脂体、淀粉分层的趋势更为一致[10-11]。茶叶籽油发酵分层生产工艺的产品主要是茶叶籽油和淀粉,而油脂体和淀粉的分层效果直接决定了茶叶籽油和淀粉的产量。因此,本试验通过研究茶叶籽水浆发酵过程中植物乳杆菌数量、相关酶活性的变化与油脂体和淀粉分层的关系,旨在阐明茶叶籽水浆发酵分层的内在机制,为优化茶叶籽浆发酵分层工艺提供理论依据。
1 材料与方法
1.1 试验材料
所用茶叶籽采自河南信阳浉河区信阳毛尖品种,千粒重493.3 g、含水率9.2%、含油率(索氏抽提法)26.2%。
主要试剂:羧甲基纤维素钠(CMC),柠檬酸缓冲液和C2H2Cl2O2试剂(Sigma-Aldrich);考马斯亮蓝、Folin酚试剂和DNS试剂(北京索莱宝科技有限公司);NaOH、碳酸钠、酪蛋白、淀粉、葡萄糖(上海源叶生物科技有限公司);甲苯胺蓝、蒽酮(国药集团化学试剂有限公司)。以上试剂均为分析纯。
主要仪器:101-3AB电热鼓风干燥箱(天津泰斯特仪器有限公司);电热恒温培养箱和水浴锅(江苏新春兰科学仪器有限公司);XSP-9CA光学显微镜(上海光学仪器一厂)、PHSJ-4A pH计(西安禾普生物科技有限公司)、GL124-1SCN电子天平(季尔国际贸易有限公司)、ET-7打浆机(湖北武汉宏旭机械设备责任有限公司)。L6S紫外可见分光光度计(上海仪电分析仪器有限公司)及移液管、试管等。
1.2 指标测定
茶叶籽脱壳后,放入80 ℃干燥箱中烘干至恒重,取1 000 g去壳茶叶籽用蒸馏水浸泡24 h,取出后和3 000 g蒸馏水用打浆机研磨,过滤后得到茶叶籽浆。然后将茶叶籽浆等分到30个试管内,分成3批,每批10个,分别置于25、30 ℃和35 ℃的恒温水浴锅中发酵12 h,逐渐分为油脂体层(顶层)、茶皂甙层(中层)和淀粉层(底层)。在茶叶籽浆发酵过程中,每1 h从发酵液中层取样1次,用来进行植物乳杆菌数量、酶活性、蛋白质和可溶性糖含量的鉴定。
1.2.1 植物乳杆菌的分离、鉴定和数量的测定 从发酵液中层的中间位置取样,25 ℃条件下在MRS固体培养基上进行划线培养[10]。长出菌落后,挑选独立的菌落,用接种针挑取样本放在载玻片上,用甲苯胺蓝染液染色观察,如果有类似植物乳杆菌的细胞,则参照东秀珠等[12]的方法进行鉴定,包括菌落形态及细胞形态的观察;繁殖特性及假菌丝的观察;16 S rDNA及pheS的序列测定,测序结果利用GenBank数据库进行BLAST同源序列检索,然后采用MEGA5.0软件进行同源性分析[10]。数量动态测定是将发酵液中取出的样本稀释10 000倍,取0.2 mL稀释液用涂布法进行MRS固体培养基接种,然后于25 ℃恒温培养36 h,数出每个培养基上的菌落数,每个处理3次重复。
1.2.2 发酵过程中茶叶籽浆体中酶活性的测定 纤维素酶活性采用DNS法测定并稍作改进[13]。取0.5 mL的样液加入0.5 mL 1%羧甲基纤维素钠(pH=5)中,55 ℃水浴30 min。然后加入DNS试剂0.5 mL,沸水浴5 min后放入冷水中冷却,于540 nm处比色测OD值,以葡萄糖作标准曲线。在上述反应条件下每分钟底物水解生成1 μmol葡萄糖的酶量为1个酶活力单位。淀粉酶活性采用DNS法并稍作改进[14],取样液1 mL,加1 mL柠檬酸缓冲液40 ℃水浴10 min取出,加入40 ℃的1%淀粉溶液2 mL,40 ℃水浴30 min取出,加入0.4 mol·L-1NaOH溶液4 mL进行糖测定。取酶作用后的反应液2 mL,加2 mL DNS试剂沸水浴10 min,冷却后于540 nm处测定OD值。在上述反应条件下每分钟底物水解生成1 μmol麦芽糖的酶量为1个酶活力单位。果胶酶活性采用DNS法测定并稍作改进[15]。 取甲、乙2只10 mL试管,分别加入2 mL蒸馏水和0.5 mL的1 mg·mL-1葡萄糖;甲试管中加入0.5 mL样液,乙试管加入0.5 mL蒸馏水,30 ℃水浴加热60 min后,再在甲、乙试管中分别加入2.5 mL DNS试剂沸水浴5 min后冷却定容至10 mL,540 nm处测定OD值。在上述反应条件下每分钟底物水解生成1 μmol半乳糖醛酸的酶量为1个酶活力单位。以酪蛋白为底物测定蛋白酶的活性并作了一些改进[16],取1 mL样液,45 ℃水浴2 min,加入1 mL 45 ℃预热过的酪蛋白,45 ℃水浴15 min后加入2 mL C2H2Cl2O2溶液,沉淀15 min,过滤后取滤液 1 mL,加入5 mL碳酸钠溶液和1 mL Folin酚试剂,45 ℃水浴 10 min,取出在700 nm波长比色。在上述反应条件下每分钟底物水解生成1 μmol酪氨酸的酶量为1个酶活力单位。以上每个处理均3次重复。
1.2.3 发酵过程中浆体中蛋白质和可溶性糖的测定 取1 mL发酵液,加水稀释10倍。取稀释液1 mL放入试管中,加入5 mL考马斯亮蓝溶液,充分混合,放置2 min后,用分光光度计在595 nm下测定吸光度,按标准曲线计算蛋白质含量[17]。取稀释液1 mL,加蒽酮试剂5 mL,显色后用分光光度计在620 nm下测定可溶性糖的吸光度,按照标准曲线算出可溶性糖含量[18]。每个处理重复3次。
1.2.4 发酵过程中油脂体和淀粉分层的测定 在茶叶籽浆发酵并逐渐分层的过程中,每隔1 h取出试管,测量顶层(油脂体层)和底层(淀粉层)的厚度,3次重复。
1.2.5 茶叶籽水浆发酵液pH的测定 从发酵开始,每隔1 h采用pH计测定发酵液的pH,3次重复。
1.3 数据统计分析方法
利用SAS软件对所得试验数据进行分析,当P<0.05时表示差异显著。
2 结果与分析
2.1 不同发酵温度下油脂体和淀粉的分层效果
茶叶籽浆在25、30 ℃和35 ℃条件下发酵,油脂体逐渐上浮,形成顶层;淀粉逐渐下沉,形成底层。油脂体层和淀粉层所占的比例均随着发酵时间的延长而增加(图1)。3种温度下油脂体层所占比例分别在发酵的11、10、10 h时达到最大值,在整个茶叶籽浆体中所占比例(v/v)分别为19.8%、35.1%、和30.2%。3种发酵温度下生成的淀粉层比例(v/v)最大值分别为10.7%、15.8%和14.6%。其中30 ℃条件下发酵所得到的油脂体层和淀粉层最大值均显著高于(P<0.05)25 ℃和35 ℃发酵条件下的最大值。由此可以看出,在30 ℃条件下发酵油脂体和淀粉的分层效果较好。

图1 不同发酵温度下油脂体和淀粉的分层比例Fig.1 Proportions of oil and starch layers at different fermentation temperatures
2.2 不同发酵温度下茶叶籽浆中植物乳杆菌数量的变化
在25、30 ℃和35 ℃发酵温度下,茶叶籽浆中的植物乳杆菌数量变化趋势均为先增后降,分别在发酵的11、9 h和9 h达到最大值,随后逐渐降低(图2)。在不同发酵时期,30 ℃茶叶籽浆中的植物乳杆菌数量均高于25 ℃和35 ℃条件下,分别高出58.4%~368.3%和5.5%~29.1%。在发酵后期植物乳杆菌数量降低的原因可能是发酵液中pH下降,抑制了植物乳杆菌的生长[9-10]。
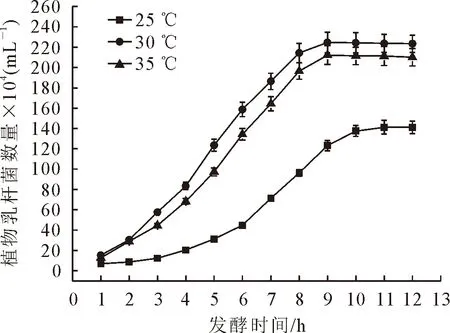
图2 不同发酵温度下茶叶籽浆中植物乳杆菌数量Fig.2 Number of L.plantarum in fermentation mixture at different temperatures
2.3 不同发酵温度下茶叶籽浆中酶活性的变化
由图3可以看出,茶叶籽浆中的4种酶活性差异很大,其中纤维素酶活性最高,其余依次是果胶酶、蛋白酶和淀粉酶。这4种酶活性在不同温度的茶叶籽发酵液中均为先升后降,和植物乳杆菌数量的变化趋势基本一致(图2、图3)。在25、30 ℃和35 ℃下,纤维素酶活性分别在发酵的11、11 h和10 h达到最大值;果胶酶、淀粉酶和蛋白酶活性分别在11、10 h和10 h达到最大值。纤维素酶、果胶酶、蛋白酶和淀粉酶均在30 ℃发酵条件下活性最高,分别比25 ℃和35 ℃下高出38.5%~50.8%和2.3%~7.8%、41.0%~52.7%和10.7%~12.7%、15.7%~53.6%和6.3%~21.0%、18.5%~46.8%和8.0%~19.5%。
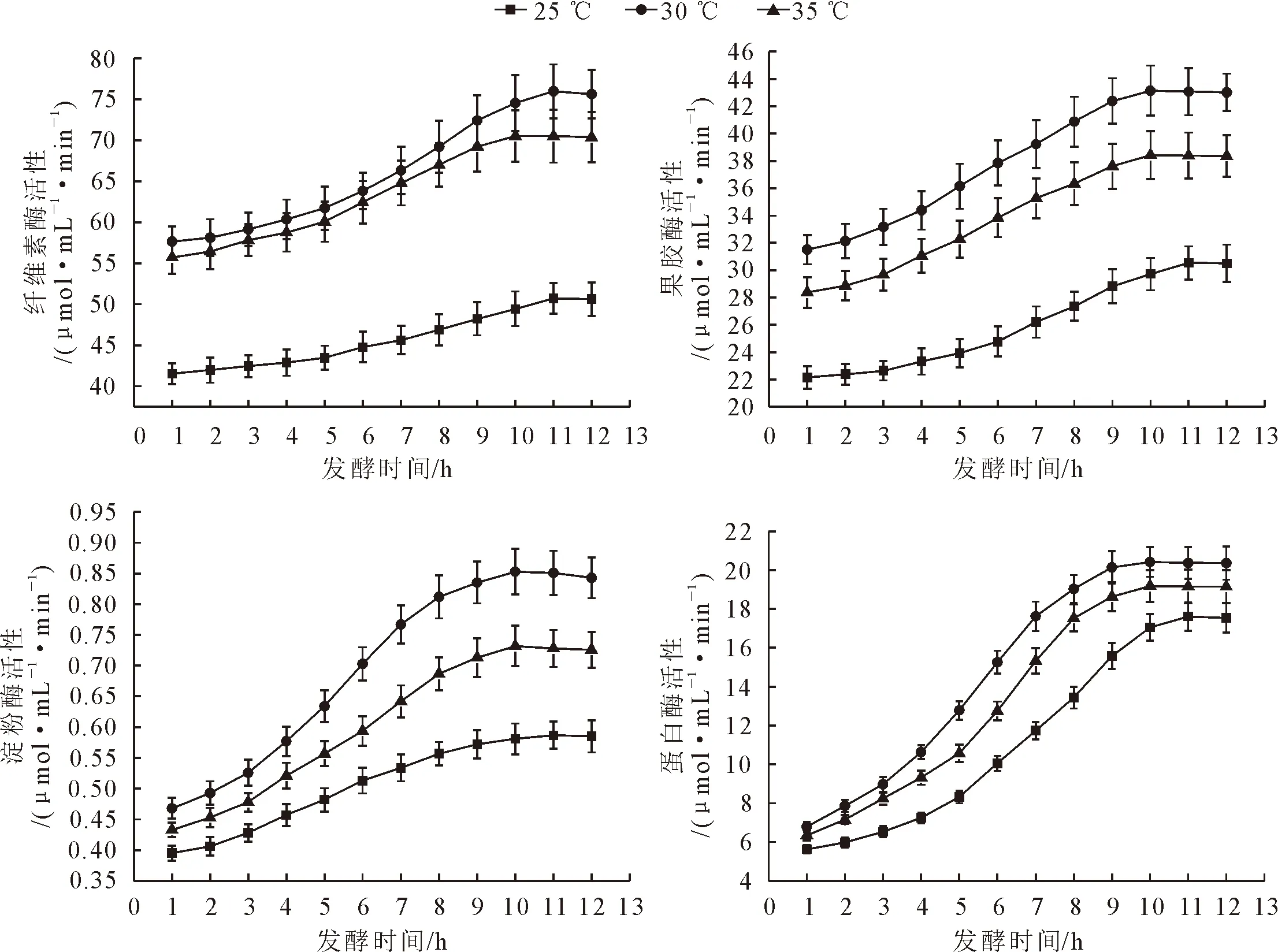
图3 不同发酵温度下茶叶籽浆中的酶活性Fig.3 Enzyme activities in fermentation mixture at different temperatures
2.4 不同发酵温度下茶叶籽浆中蛋白质和可溶性糖含量的变化
在25、30 ℃和35 ℃下,茶叶籽浆中蛋白质和可溶性糖含量均随着发酵时间的延长而降低(图4)。其中30 ℃发酵液中蛋白质和可溶性糖含量的降幅最大,分别比25 ℃和35 ℃降低了1.4%~25.2%和0.5%~13.7%、1.0%~28.4%和0.4%~14.4%。
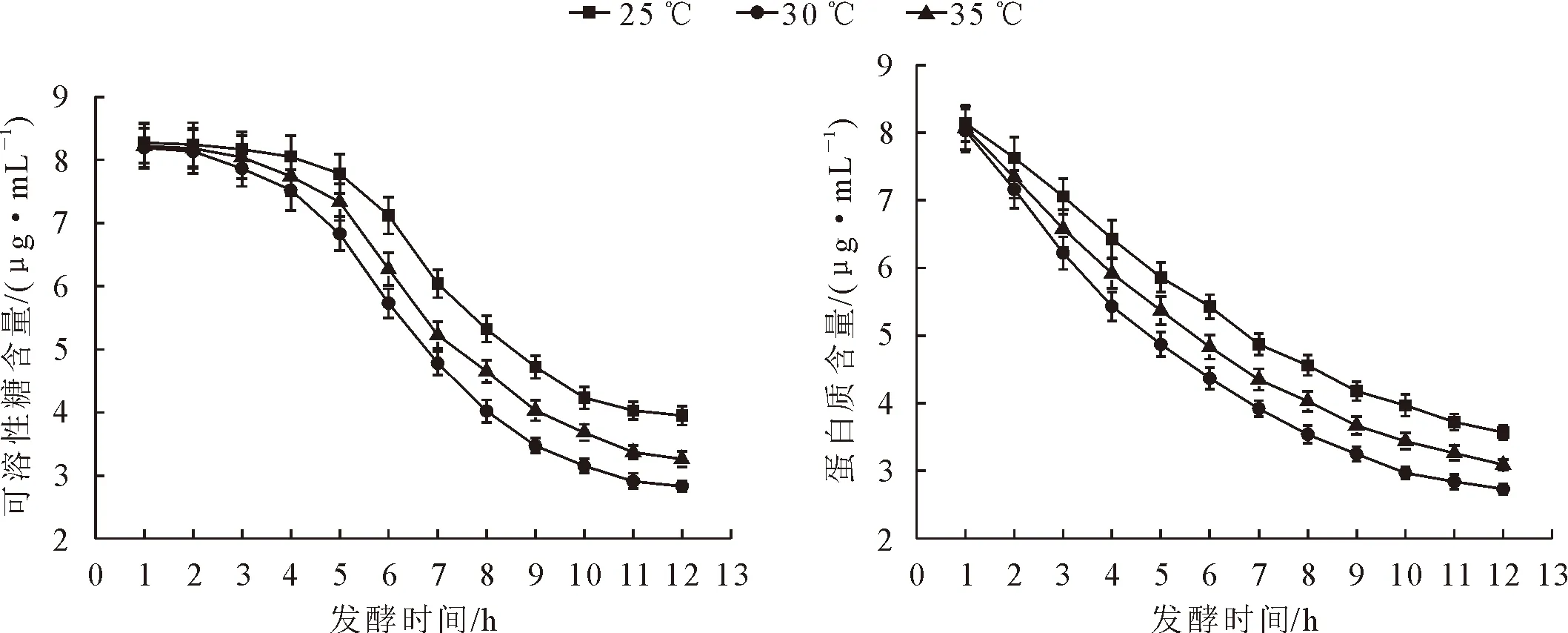
图4 不同发酵温度下茶叶籽浆中蛋白质和可溶性糖含量Fig.4 Contents of protein and soluble sugar in fermentation mixture at different temperatures
2.5 不同发酵温度下茶叶籽浆中pH值的变化
在25、30 ℃和35 ℃下,茶叶籽浆的pH随着发酵时间的延长而降低(图5),其中30 ℃发酵液中pH的降幅最大,分别比25 ℃和35 ℃条件下降低了1.2%~14.8%和0.6%~7.4%。
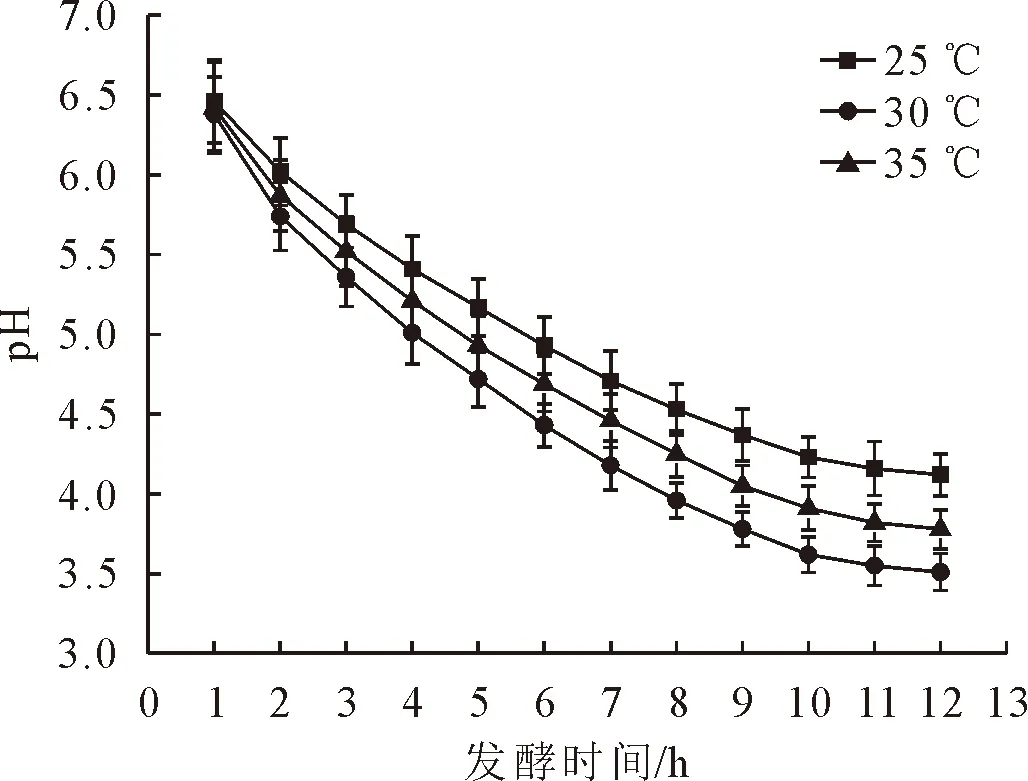
图5 不同发酵温度下茶叶籽浆的pHFig.5 The pH of fermentation mixture at different temperatures
2.6 茶叶籽浆发酵体系中各参数的相关分析
从图1-图5看出,在茶叶籽浆发酵过程中,油脂体和淀粉的分层效果和其他参数的变化趋势关系密切,对上述参数的相关分析结果见表1。在不同的发酵温度下,茶叶籽浆发酵体系中油脂体层和淀粉层的形成和植物乳杆菌数量、蛋白酶活性、淀粉酶活性、果胶酶活性和纤维素酶活性之间呈现高度的正相关,相关系数0.896~0.998,相关显著;和反应体系中的蛋白质含量、可溶性糖含量和pH呈现显著负相关,相关系数-0.997~-0.930。在茶叶籽浆发酵体系中,植物乳杆菌是决定发酵分层的核心,其数量和蛋白酶、淀粉酶、果胶酶和纤维素酶的活性均呈显著正相关,相关系数0.937~0.998;和反应体系中的蛋白质含量、可溶性糖含量及pH呈显著负相关,相关系数-0.997~-0.930。

表1 茶叶籽浆发酵体系中不同参数的相关系数Table 1 Correlation coefficients of different parameters in fermentation mixture
3 结论与讨论
3.1 结论
不同温度下茶叶籽浆分层效果不同的原因是植物乳杆菌的生长和代谢活性不同,适宜的发酵温度(30 ℃)下植物乳杆菌的数量最多,代谢产生的淀粉酶、纤维素酶、果胶酶和蛋白酶活性最高,较高的淀粉酶、纤维素酶、果胶酶和蛋白酶活性促进茶叶籽浆中的破碎细胞壁、蛋白质和多糖的降解。而酶解形成的可溶性糖被植物乳杆菌消耗利用,使茶叶籽浆中的胶粒、蛋白质和可溶性糖等黏稠成分逐渐降低,从而打破茶叶籽浆胶体的稳定性,促进浆体中油脂体的上浮和淀粉的下沉,因此30 ℃发酵条件下油脂体和淀粉的分层比例最高。同时,随着茶叶籽浆发酵体系中植物乳杆菌数量的增多,分泌有机酸的增加,茶叶籽浆的pH逐渐降低,过低的pH反过来会抑制植物乳杆菌的数量和相关酶活性,从而导致分层效果逐渐降低。因此在以后的工艺改良中,适当向茶叶籽水浆中加入植物乳杆菌、纤维素酶、蛋白酶、淀粉酶和果胶酶,以及适时调解发酵体系的pH等,能够进一步提高茶叶籽油脂体和淀粉的分层比例。
3.2 讨论
茶叶籽油发酵分层生产工艺的原料是去壳茶叶籽加水研磨后的滤液,这种滤液体系相当稳定,在低温不发酵的条件下,放置5 d以上也不会有明显的分层出现,属于典型的胶体现象[8]。此胶体体系中的胶粒主要有未破碎的茶叶籽细胞、富含纤维素和果胶的破碎细胞壁、淀粉粒、多糖和蛋白质颗粒等,茶叶籽油脂体和淀粉附着在这些胶体颗粒上,不能上浮或下沉[10]。打破这种稳定性的途径有化学、物理及生物途径。本工艺用于食品原料生产,因此在分层过程中尽量不添加化学药品,采用绿色低耗的生物发酵方式为最佳途径。
3.2.1 植物乳杆菌的作用 植物乳杆菌常存在于发酵的植物中,发酵过程中以基质中的碳水化合物作为主要碳源,同时产生有机酸和其他代谢产物[19-20],从而使pH降低、酸度增加、黏度变低[21]。在本试验中,植物乳杆菌数量和淀粉酶、纤维素酶、果胶酶及蛋白酶活性在茶叶籽浆发酵过程中的变化趋势基本一致(图2、图3),呈显著正相关,可以推测植物乳杆菌在发酵代谢过程中可能产生淀粉酶、纤维素酶、果胶酶和蛋白酶,其中纤维素酶和果胶酶的活性较大,纤维素酶和果胶酶可以逐步降解浆体中的破碎细胞壁,而淀粉酶和蛋白酶会降解浆体中的多糖和蛋白质颗粒[22-23],促使附着在这些颗粒上的油脂体和淀粉发生分离,从而上浮或下沉。同时,茶叶籽浆液中还有许多未破碎的细胞,纤维素酶和果胶酶也能降解这些细胞的细胞壁,从而使细胞中的物质释放出来。在发酵的过程中,茶叶籽浆中的可溶性糖被植物乳杆菌消耗利用,蛋白质颗粒被蛋白酶降解。这些因素导致茶叶籽浆中的各种胶粒和黏稠成分逐渐降低,胶体逐渐被打破,促使油脂体的上浮和淀粉的下沉。
3.2.2 温度对茶叶籽浆分层的影响 发酵温度对茶叶籽浆中油脂体和淀粉的分层影响显著,可能是温度的高低直接影响植物乳杆菌的生长代谢和相关酶活性[24]。在本试验的3种发酵温度下,30 ℃更适合茶叶籽浆中植物乳杆菌的生长和代谢,在此温度下茶叶籽浆发酵液里植物乳杆菌数量最多,酶活性也最高,因此能够将茶叶籽浆体中的胶粒降解得更彻底,使附着在这些颗粒上的油脂体和淀粉充分分离。而较多的植物乳杆菌数量也能更快更多地消耗茶叶籽浆中的可溶性糖等黏稠物质,有利于油脂体和淀粉的分层。
3.2.3 pH对各参数的影响 pH是影响微生物和酶活性的关键因素之一,微生物和酶在适宜的pH范围内才能表现出较高的活性,大于或小于最适pH都会抑制微生物的生长和酶的活性[9-10,25-26]。综合分析可以看出,初时茶叶籽浆pH接近中性,比较适合植物乳杆菌的生长,因此发酵液中植物乳杆菌的数量随着发酵液时间的延长而增加,伴随着植物乳杆菌的代谢活动,分泌的乳酸等酸性有机物增加,发酵液的pH逐渐降低,最后形成高酸环境[10]。过低的pH会抑制植物乳杆菌的生长和淀粉酶、纤维素酶、果胶酶及蛋白酶的活性。因此,从发酵的9~11 h开始,植物乳杆菌的数量和淀粉酶、纤维素酶、果胶酶及蛋白酶的活性增幅放缓并逐渐降低。

