太平洋牡蛎对海洋酸化响应的分子机制
——基于转录组的分析
卢梓雅,陈晓琳,黄思敏,段茜茜,彭博言,肖子健,项载盈,郭晓梅,刘雅琪,林思晴,TAN Karsoon,张洪宽,郑怀平
(汕头大学海洋科学研究院/广东省海洋生物技术重点实验室/广东省亚热带海水养殖工程技术研究中心,广东汕头 515063)
0 引言
牡蛎养殖在中国贝类养殖业中占有重要地位,是中国传统四大养殖贝类之一,沿海各地都有养殖[1]。太平洋牡蛎(Crassostrea gigas)又称长牡蛎、褶牡蛎,隶属于软体动物门(Mollusca)、瓣鳃纲(Lamellibranchia)、翼形亚纲(Pteriomorphia)、珍珠贝目(Pterioida)、牡蛎科(Ostreidae)、巨蛎属(Crassostrea)。太平洋牡蛎原产于日本,20 世纪80 年代被中国引进,因其生长快、产量高、口感细嫩、味鲜清香,很快成为中国主要海水养殖品种,带动了中国牡蛎养殖业的发展[2]。2020年,中国牡蛎养殖产量达542.5万t,位居世界首位[3]。牡蛎口感鲜嫩爽滑,富含优质蛋白且营养成分易被机体吸收,深受广大消费者喜爱[4]。因此,研究牡蛎响应环境胁迫的分子机制具有重大的应用和理论价值。
近年来,由于人类活动加剧,近海海洋生态系统的稳定性被破坏[5],其中最主要的就是海洋酸化。工业革命以来,人类活动释放了包括CO2在内的大量温室气体,导致全球变暖,海洋作为地球上最大的CO2存储体,吸收了大量的CO2(超过100万t/h),极大地缓解了全球变暖,但却使海水pH 下降,最终导致海洋酸化[6]。据统计,自工业革命以来,海洋水体的pH 已下降了0.1。根据IPCC 预测模型(A1F1)推测,至2100 年表层海洋水体pH 将会下降0.3~0.4,氢离子浓度则增加100%~150%。海洋酸化正在逐渐改变海水的理化性质、海洋生物的生理机能和海洋生物群落,进而威胁到了海洋生态平衡。最近的研究表明,人为气候变化的影响从根本上改变了海洋生态系统,包括海洋生产力下降、食物网动态变化、栖息地物种丰度减少以及物种分布变化等[7-8]。
海洋酸化对太平洋牡蛎的幼体和成体都有很大的危害。生活在海洋酸化环境下的牡蛎,虽然幼体牡蛎的生长速率要高于成体牡蛎,但是幼体牡蛎为了保障机体功能的正常运行,往往会消耗更多的能量,并且长期处于该环境下,幼体的死亡率会更高[9]。与此同时,幼体牡蛎外壳和软体部的生长情况在酸化条件下会比生活在正常环境下的差很多,且贝壳十分脆弱;对于成体牡蛎来说,一方面本身长速变缓,另一方面由于新陈代谢的速率比幼体慢,因此生长速率并没有受到太大的影响[9]。但是在这种弱酸性的环境条件下,成体牡蛎的外套膜增加了碳酸酐酶的表达,碳酸酐酶是一种专门调节pH的酶,有助于壳体内碳酸氢盐的生成,这种酶含量的增加,表明成体牡蛎能够在一定程度上平衡酸化条件造成的机体损伤[9]。
目前研究太平洋牡蛎的学者们虽然从不同方面展示了海洋酸化对牡蛎生长发育的影响,但关于牡蛎响应海洋酸化胁迫下的分子机制尚未深入研究。因此,本研究利用公共数据库NCBI 中的RNA-seq 数据(包括4 个组:pH 7.8、7.4、7.0、6.6)进行分析,进而在分子层面探究太平洋牡蛎对海洋酸化响应的机制。
1 材料与方法
1.1 实验材料
从NCBI 网站的SRA 数据库(Sequence Read Archive)上下载了太平洋牡蛎在pH 6.6、7.0、7.4、7.8的转录组数据(https://www.ncbi.nlm.nih.gov/bioproject/PRJNA735889)以及Genome 数据库中太平洋牡蛎的参考基因组(https://ftp.ncbi.nlm.nih.gov/genomes/all/GCF/902/806/645/GCF_902806645.1_cgigas_uk_roslin_v1/GCF_902806645.1_cgigas_uk_roslin_v1_genomic.fna.gz),本研究于2022 年7—8 月在汕头大学海洋生物研究所开展。
1.2 方法
1.2.1 数据格式转换 利用SRAtoolkit 2.11.3 软件的fastp-dump 将SRA 格式的文件转化为fastq.gz 格式的文件。
1.2.2 数据质控利用Fastp 软件对转换格式后的数据进行质控,过滤低质量的reads,去除adapter,数据截取,最后生成HTML和JSON格式的质控报告,统计过滤前和过滤后Q20、Q30及GC含量数据。
1.2.3 数据的比对首先建立太平洋牡蛎参考基因组的索引,然后通过Hisat2 将质控得到的数据比对到参考基因组,得到sam格式的输出文件和报告,统计数据的整体比对率(overall alignment rate),唯一比对率(Unique mapping),多重比对率(Multiple mapping)等信息。
1.2.4 数据排序由于从Hisat2得到的sam格式的文件占用存储较大,利用Samtools 将sam 文件转换为bam文件,并且对bam文件进行排序。
1.2.5 数据的定量分析与标准化对于处理后得到的bam 文件,通过使用R 语言中的FeatureCounts 来计算readscounts,并转化为TPM值(transcripts per million)。
1.2.6 差异表达分析通过R语言中的tidyverse包进行多表关联,将每组的差异表达基因筛选出来(基因差异表达的参数设置为|log2FoldChange|≥1和padj>0.05),然后利用EnhancedVolcano 和pheatmap 包生成火山图和热图,将差异表达基因可视化。
1.2.7 富集分析(GO 和KEGG)通过基迪奥生物信息云平台(https://www.omicshare.com)进行GO 分析(Gene Ontology)和KEGG 分析(Kyoto Encyclopedia of Genes and Genomes)。利用GO数据库,通过计算差异表达基因参与生物学过程、细胞组分、分子功能的超几何分布,进行功能分类注释和富集分析。同时,用KEGG数据库获得代谢通路注释信息。
2 结果
2.1 测序数据的统计
对4 个组别pH 6.6、pH 7.0、pH 7.4、pH 7.8 的数据分别进行质控,获得高质量的测序数据。在未过滤前,这些数据的Q20 值最低为90.65%,最高为98.22%;Q30 值最低为84.59%,最高为98.17%,而GC 含量在42.04%~94.97%;过滤后Q20最低值达到96.82%,而最高值达到98.54%;Q30 值最低达到92.11%,最高达到95.34%,而GC 含量在42.33%~94.67%,表明测序数据经过fastp质控后质量得到提升。利用将hisat2软件将质控后的数据与建好的牡蛎基因组索引文件进行比对。测序reads 的总比对率值最低为76.26%,最高为79.36%(见表1),数据的唯一对照率最低为71.31%,最高为74.60%;多重对照率最低为4.23%,最高为6.12%,说明质控后的数据质量较高,可用于研究分析。

表1 测序数据比对到参考基因组的统计结果
2.2 差异表达基因的统计与分析
通过使用R语言中的tydiverse包对3组样本进行了差异表达基因分析,将log2FoldChange <1 且padj >0.05 的基因筛选出来,生成火山图和热图(图1 和图2)。分别对pH 6.6 vs pH 7.8 组、pH 7.0 vs pH 7.8 组和pH 7.4 vs pH 7.8 组的显著差异表达基因进行分析,发现pH 6.6 vs pH 7.8 组总共有943 个显著差异表达基因,其中上调基因有295个,下调基因有648个;pH 7.0 vs pH 7.8组总共有93个显著差异表达基因,其中上调基因有46 个,下调基因有47 个;pH 7.4 vs pH 7.8 组总共有61个显著差异表达基因,其中上调基因有31个,下调基因有30 个。通过火山图将差异表达基因可视化(图1)。

图1 牡蛎各组差异表达基因火山图
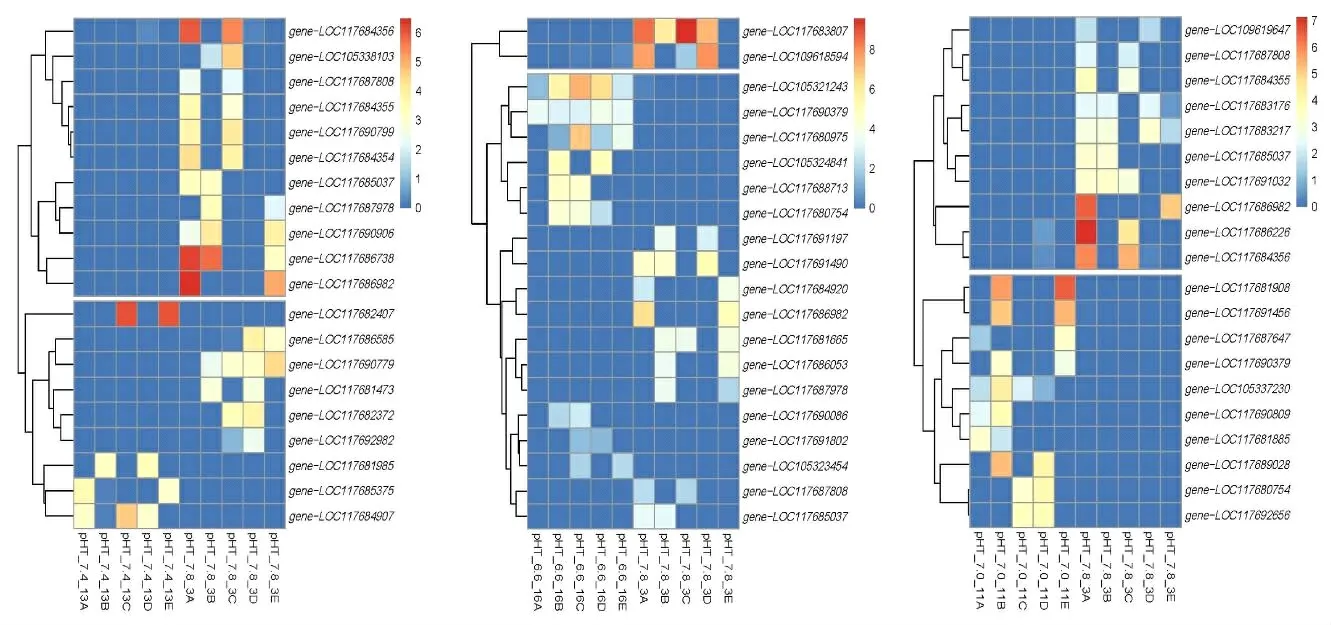
图2 牡蛎各组差异表达基因热图
利用韦恩图显示pH 6.6 vs pH 7.8 组、pH 7.0 vs pH 7.8 组、pH 7.4 vs pH 7.8 组间共有及特有的基因数(图3),响应酸胁迫的基因总共有1059 个。当pH 6.6 vs pH 7.8 时,基因个数已有943 个,pH 7.0 vs pH 7.8时,基因个数为93个;pH 7.4 vs pH 7.8时,基因个数达到61个;其中有4个基因在pH 6.6、pH 7.0和pH 7.4均差异表达。由此可知,随着pH的下降,牡蛎响应酸化胁迫的基因数也在增加。
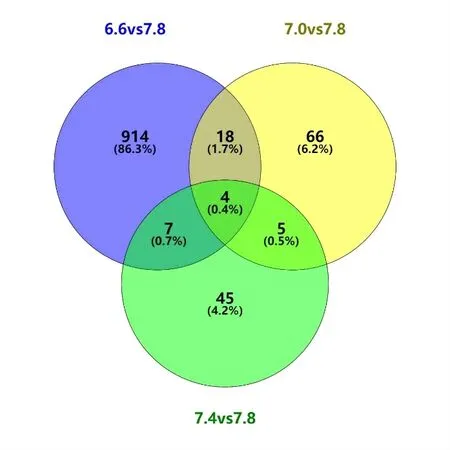
图3 太平洋牡蛎酸胁迫差异表达基因韦恩图
利用韦恩图可视化pH 6.6 vs pH 7.8 组、pH 7.0 vs pH 7.8组、pH 7.4 vs pH 7.8组间的差异基因。
2.3 GO功能分析
由于pH 7.0 vs pH 7.8 组和pH 7.4 vs pH 7.8 组的差异基因较少,因此,本研究仅对pH 6.6 vs pH 7.8 组的差异表达基因进行了GO(Go Ontology)富集分析。将该组的943个差异表达基因在基迪奥生物信息云平台(https://www.omicshare.com)上进行GO 富集分析,对该组中差异表达基因的前53个GO term进行列举,发现其中8个GO term差异富集明显。
在pH 6.6 vs pH 7.8组中的差异表达基因,在生物过程方面,大部分富集到了细胞过程、代谢过程、生物调节等过程中,如糖代谢、脂类代谢;在细胞组分方面,细胞器成分和细胞成分等组分被集中富集;在分子功能方面,以催化和分子结合为主(图4)。

图4 差异表达基因的GO统计柱状图
3 讨论
(1)代谢方面
在海洋酸化胁迫下,很多海洋贝类和珊瑚等海洋生物的新陈代谢活动受到了影响[10]。紫贻贝(Mytilus edulis)在海水酸化的影响下能量代谢出现抑制现象[11];浅珊瑚(Mesophotic corals)的代谢率在海洋酸化胁迫下显著降低[12]。通过研究发现(见图5),太平洋牡蛎在海洋酸化条件下的糖代谢、氨基酸代谢、脂类物质代谢等都受到抑制。糖类和脂肪都是太平洋牡蛎的主要能源物质,当这些主要能源物质的代谢被抑制时,会减少对太平洋牡蛎的能量供应从而对太平洋牡蛎的生长、发育、繁殖等正常活动造成不利影响[13]。在研究中发现,糖代谢方面的下调差异基因数目(8)多于上调差异基因数目(3),表明太平洋牡蛎的糖代谢由于受到海水酸化的胁迫而被抑制。在海洋酸化条件下(pH 6.6),太平洋牡蛎的糖代谢差异表达基因gene-LOC105328227(与糖原磷酸化酶有关)的下调倍数最大,对太平洋牡蛎的糖代谢抑制起到主导作用。糖原磷酸化酶是关于糖原分解的酶。在糖原分解过程中,糖原磷酸化酶催化糖原的磷酸解作用,从而实现给太平洋牡蛎提供能量。但是在海水pH 逐渐降低的情况下,gene-LOC105328227(与糖原磷酸化酶有关)的表达量逐渐减少,甚至趋向于0(见图6),对太平洋牡蛎的糖代谢极其不利。海水酸化通过抑制糖原磷酸化酶对糖原的分解能力来抑制太平洋牡蛎的糖代谢,进而减少由糖原提供的能量。这将导致太平洋牡蛎在海洋酸化胁迫下将供给能量的方式由糖原代谢转化为蛋白质消耗,这将严重损耗它们自身的肌肉组织等,从而影响到正常的生命活动[14]。厚壳贻贝和紫贻贝在海水酸化下出现类似现象,它们在海水pH 逐渐下降的情况下,代谢底物由碳水化合物转化为蛋白质,出现糖代谢抑制现象[8]。在研究中发现,在海洋酸化胁迫下,太平洋牡蛎的新陈代谢快慢受到氨基酸代谢的影响,氨基酸代谢的下调基因数目远多于上调基因数目,表明太平洋牡蛎的氨基酸代谢受到抑制。其下调基因gene-LOC117691793和gene-LOC10532916的下调倍数显著,最高达7 倍,并且这2 个基因都与精氨酸激酶有关。精氨酸激酶是无脊椎动物调节能量代谢的最重要的酶之一,在细胞活动活跃时,精氨酸激酶会促进高能磷酸键转移并形成ATP[15]。在海洋酸化下,gene-LOC117691793和gene-LOC10532916的表达量相较于在中性海水严重减少(见图6),很大程度上抑制形成精氨酸激酶,以至于太平洋牡蛎形成的ATP 减少,最终导致呼吸代谢等减弱[16]。
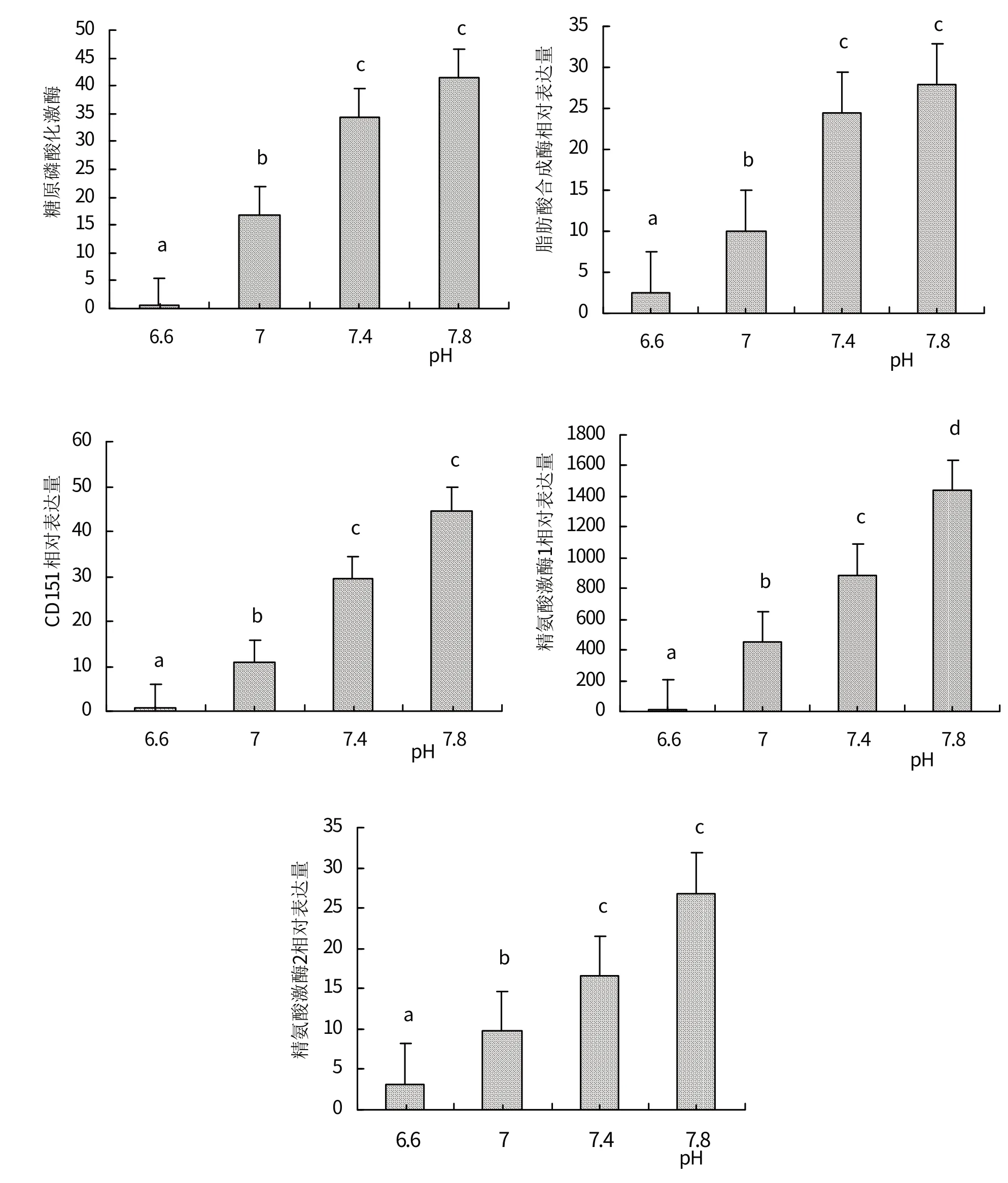
图6 各个差异表达基因在不同pH下的表达量
在研究中发现,脂肪代谢的下调基因数目(6)远高于上调基因数目(1),其中以基因gene-LOC105318687差异倍数为最高。gene-LOC105318687与脂肪酸合成酶(Fatty Acid Synthase,FAS,E.C.)相关,属于脂质代谢基因,通过影响脂质代谢过程的效率,从而影响组织脂肪的含量[17]。脂肪酸合成酶又称脂肪酸合酶,是内源性脂肪酸合成的关键酶。脂肪酸合成酶能够催化丙二酰辅酶A等酶,在体内合成拥有16碳的长链饱和软脂酸盐。海洋酸化胁迫下,其表达水平显著下降(见图6),表明其酶的含量也显著下降,这将影响太平洋牡蛎脂肪组织的发育、脂肪的沉积,进而打破脂肪合成代谢与分解代谢之间的平衡状态,影响牡蛎供能物质的摄入量与其体内能量消耗的平衡,进而导致能量代谢的紊乱[18]。在其他水产动物中也有相似的研究,比如通过在饲料中添加胆汁酸,齐口裂腹鱼(Schizothorax prenanti)降低其体内的脂肪酸合成酶的表达量,从而控制翻译水平下降,减少体脂合成,减少脂肪沉积[19];在短期酸化胁迫10 d,紫贻贝(Mytilus edulis)选择降低摄食,减少吸收的能量,增加呼吸代谢能量消耗,从而减少贝类生长的能量,使其生长下降[20]。
(2)免疫方面
在海洋酸化的影响下,不仅导致太平洋牡蛎代谢功能的减弱,其免疫功能也被显著抑制。通过比较分析发现,在pH 6.4组和pH 7.8组相比时,免疫代谢方面下调表达数目(12)多于上调表达基因(9),表明太平洋牡蛎在酸化胁迫下免疫作用受到抑制。贝类作为无脊椎动物,具有不同于脊椎动物的免疫机制来抵抗外界病原体的入侵,其宿主防御包括细胞和体液系统,血细胞可以清除病原微生物和死亡细胞,参与损伤修复,是贝类主要的免疫防御机制[21]。当太平洋牡蛎的免疫功能受到抑制时,太平洋牡蛎的生长发育等生理活动都会受到影响。在研究中发现,在海洋酸化胁迫下(pH 6.6),太平洋牡蛎起免疫防御功能的差异表达基因gene-LOC105345760(CD151 抗原有关)下调倍数最大,表明该基因可能对其在海洋酸化条件下的免疫功能起着关键作用。CD151 蛋白是一种细胞表面糖蛋白,参与多种病理生理过程,包括细胞的黏附、迁移、半桥粒结构的形成以及通过囊泡进行整合素的运输等[22-23],因此,CD151基因的表达量减少可能导致太平洋牡蛎免疫系统的发生一定程度的受损。此外,从图6 中可以看出,在海水pH 逐渐降低时,CD151的表达量不断减少,甚至趋向于0,表明海水酸化显著抑制了CD151抗原的表达,这可能会导致太平洋牡蛎体内渗透压改变,免疫系统紊乱,降低太平洋牡蛎抵挡外界环境变化的能力。研究表明,酸化(p CO2101~203 Pa)可以引起太平洋牡蛎(C.gigas)血细胞凋亡和活性氧生成的增加,并且升高的p CO2对一些抗氧化酶活性具有抑制作用,导致消化腺中的谷胱甘肽水平降低,过氧化氢酶显著下降[24-25]。泥蚶(Tegillarca granosa)在酸化(pH 7.4 和7.8)胁迫下的总血淋巴细胞数和吞噬率显著减少,嗜酸性和嗜碱性粒细胞的百分比分别显著减少和增加,信号传导也受到了一定的负面影响[26]。由此可知,海洋酸化对贝类的免疫系统有显著的影响,能够显著地抑制双壳贝类的免疫应答作用[27]。
综上所述,本研究通过转录组分析获得太平洋牡蛎在不同pH(7.8、7.4、7.0、6.6)环境下的差异表达基因,发现在海水酸化(pH 6.6)时,太平洋牡蛎的代谢功能和免疫功能都受到显著抑制。在代谢方面中,糖代谢相关的gene-LOC105328227(糖原磷酸化酶)、氨基酸代谢相关的gene- LOC117691793和gene-LOC10532916(精氨酸激酶)和脂类物质代谢相关的gene-LOC105318687(脂肪酸合成酶)表达量都随着pH 的下降而不断减少,有的甚至趋于零,表明在海洋酸化条件下太平洋牡蛎的代谢功能受到严重的抑制;在免疫方面中,gene-LOC105345760(CD151 抗原)的表达量显著下降,表明海洋酸化胁迫很有可能会导致太平洋牡蛎体内渗透压改变,免疫系统紊乱,降低其抵挡外界环境变化的能力。面对全球海洋酸化的大趋势下,希望本研究成果能够弥补海洋贝类响应海洋酸化分子机制研究中的不足,能够为海洋贝类的遗传改良提供一定的理论基础。
4 结论
本研究利用生物信息学对海洋酸化胁迫下的太平洋牡蛎转录组数据进行了分析,结果显示pH 6.6 vs pH 7.8 组总共有943 个显著差异表达基因,pH 7.0 vs pH 7.8组总共有93个显著差异表达基因pH 7.4 vs pH 7.8 组总共有61 个显著差异表达基因。对pH 6.6 vs pH 7.8组的差异表达基因进行GO和KEGG分析发现太平洋牡蛎在海洋酸化胁迫下其代谢和免疫功能受到显著抑制,表明海洋酸化极可能导致牡蛎机体代谢和免疫系统的紊乱,降低太平洋牡蛎抵挡外界环境变化的能力。

