生境对紫茎泽兰叶片外部形态结构的影响
杨楠茜,刘宪斌,2,赵星硕,董 晗
(1玉溪师范学院化学生物与环境学院,云南玉溪 653100;2玉溪师范学院生物与环境工程研究院,云南玉溪 653100)
0 引言
紫茎泽兰(Ageratina adenophora)为菊科多年生草本或半灌木植物,株高可超过2 m,原产于南美洲的墨西哥至哥斯达黎加一带,集中分布范围在北纬37°至南纬35°的热带和亚热带地区,喜光、喜湿、喜肥、耐旱、耐高温、耐贫瘠;在原产地有环境控制因子和天敌的抑制而没有对生态环境产生明显的破坏,后作为观赏植物引入欧洲和亚洲国家,造成大面积繁衍,现作为一种世界性有害入侵杂草,对入侵地各种陆地生态系统造成了严重影响,已经广泛分布于世界各地热带和亚热带30 多个国家和地区,且目前还在世界各地蔓延[1-3]。在20世纪40年代左右,紫茎泽兰野生种通过野外传播途径由缅甸传入中国云南边境临沧地区南部,在当地生态系统生长和繁衍,形成大面积单种群生态系统,并快速向内地北部和东部扩散,云南80%左右面积的土地上都有紫茎泽兰植株的分布,涉及各类陆地生态系统[4-5]。经过半个多世纪的传播,现在云南、贵州、四川、重庆、广西、西藏等地区均有大面积紫茎泽兰野生种群的分布,且有研究结果显示入侵中国的紫茎泽兰植物在核DNA水平上具有丰富的遗传多样性,在自然形态结构上表现出了明显的可塑性和适应性,经过相对较短时间的繁衍和进化就可以形成能够适应各种不同生态环境的地理种群[1,6]。紫茎泽兰的种子传播途径多,传播速度快,每年约以20 km的速度随着西南风向东和向北持续传播蔓延,给传播所到地的农、林、畜牧业生产造成了严重的经济损失[1]。
紫茎泽兰植株适应能力强,生长和繁殖速度快,繁殖方式多样,除可以依靠强大的根状茎快速扩散蔓延外,其种子遇到恶劣环境条件能够以休眠的状态长久保存在生态系统表层土壤中,待环境条件适宜可快速萌发、生长、繁衍并抢占生存空间,短时间内就可以造成同一生态系统中其他物种生存空间的压缩[7-8]。作为进行光合作用合成有机物的主要植物器官,紫茎泽兰植物的叶片生长速度快,外部形态结构对外界自然环境因子的影响表现出明显的可塑性,其内部植物生理结构可以通过叶片气孔的调节来调整气体交换的速度和流量,满足进行光合作用的适宜条件,这些植物生理特点对其入侵其他生态系统的能力有重要提升作用[9-10]。此外,紫茎泽兰植物叶片含有抑制同一生态系统其他植物正常生长发芽的化感物质,作为凋落物的叶片经雨水的淋溶仍然可以溶解出此类化感物质,对入侵地的其他植物正常生长产生消极影响[11-12]。由于植物叶片的生理活动和所含化感物质对紫茎泽兰植株的正常生长和入侵机理具有重要作用,所以国内外相关研究领域和学者对其叶片构造、生理活动和成分的研究项目和成果较多[13-14]。
紫茎泽兰植物叶片对生,质薄,形状有菱形、卵形、三角形或菱状卵形等,叶缘有锯齿;只有花序下方少数小叶呈不完全生长状态,没有叶缘锯齿[15]。现有的研究结果证明,不同生态环境中的气候、土壤和水分可以影响紫茎泽兰叶片的大小,但是对其叶片形状、叶缘锯齿以及相关环境影响因子的研究结果还未见报道[16-17]。笔者重点关注紫茎泽兰植株叶片的形状和叶缘锯齿的数目规律,在此前提下调查相应的其他叶片外部形态结构;以光照强度、土壤水分和养分含量及三者相互交叉影响为环境影响因子,选定10 个具有不同环境因子组合的生境,调查各生境中紫茎泽兰植株叶片的长、宽、长宽比、叶面积、叶缘两侧锯齿数目和比例,并分析环境因子对植株叶片外部形态结构的影响程度,以期为后期该植物叶片生理活动、内部解剖学特征和人工防治等相关科研领域的研究提供理论依据。
1 材料与方法
1.1 样地信息
试验于2022 年3—7 月在玉溪师范学院校园内(24°20′N,102°33′E,海拔1700~1740 m)进行。玉溪市地处低纬度、高海拔地区,属于典型的亚热带高原季风气候类型,受到来自印度洋的西南季风、北部湾的温湿与干燥气流、复杂地形等综合因素的影响,具有冬春季节降雨少、夏秋季节降雨集中及垂直气候分布的特点,局部地区地形与背向和朝向结合形成多样性气候变化的特征,气候立体特征明显,温和湿润[18]。年平均气温15.4~24.2℃;6—8 月温度较高,最高温度可达为32.2℃;12月—次年1月温度相对较低,最低为-3℃[19]。一年之中有明显的干湿季节之分,每年6—11月为湿季,降水量多,占全年降水量的85%左右;12 月—次年5 月为干季,降水量少,占全年降水量的15%左右[20-21]。年平均降水量787.8~1000 mm,多集中于6—10 月,强对流天气产生的大、暴雨多集中在6—8 月,范围小、强度大的“单点暴雨”频繁发生,容易在短时间内形成地面径流,从而造成水土流失;相对湿度68%~79%,绝对湿度1.36 kPa;年平均蒸发量1801 mm[22-23]。全市范围内无霜期244~365 d,年平均日照时数2115~2285 h,1—3 月为霜期,偶有降雪天气出现,但持续时间短,降雪量小[24]。由于玉溪市区域内地形复杂,海拔高度落差较大,受山地垂直气候带和植被的影响,通常情况下山区比坝区降雨量大,温度相对较低,自山顶到谷底,全年和昼夜温差变化亦较显著[25]。玉溪师范学院校园内土壤类型为原生土,成土为红色沙壤土,由泥质岩和碳酸岩发育而成,具有弱酸性、低有机质含量、低土壤微生物含量和低土壤养分含量等明显特征。
1.2 采样方法
针对校园内影响紫茎泽兰植株生长的关键环境因子——光照强度、土壤水分和养分含量,在玉溪师范学院校园内选取10个不同生境作为样品采集地点,即路基(阳)、路基(荫)、林下、林窗、池塘边(干)、池塘边(湿)、田埂、田间、栽培(阳)和栽培(荫)(表1)。其中,人工栽培紫茎泽兰植株在玻璃日光温室内进行,种子繁殖,设置全光照和半遮荫2 个处理,每个处理设置3个重复。栽培基质采用混合基质(蛭石、草炭和有机土等体积混合);营养液采用的是改良版霍格兰营养液配方,盆栽,苗期每2周浇1次营养液,中期每周浇营养液1 次,后期每周浇营养液2 次,其他时间视栽培基质干湿情况浇水[26]。人工温室内栽培周期为5个月。
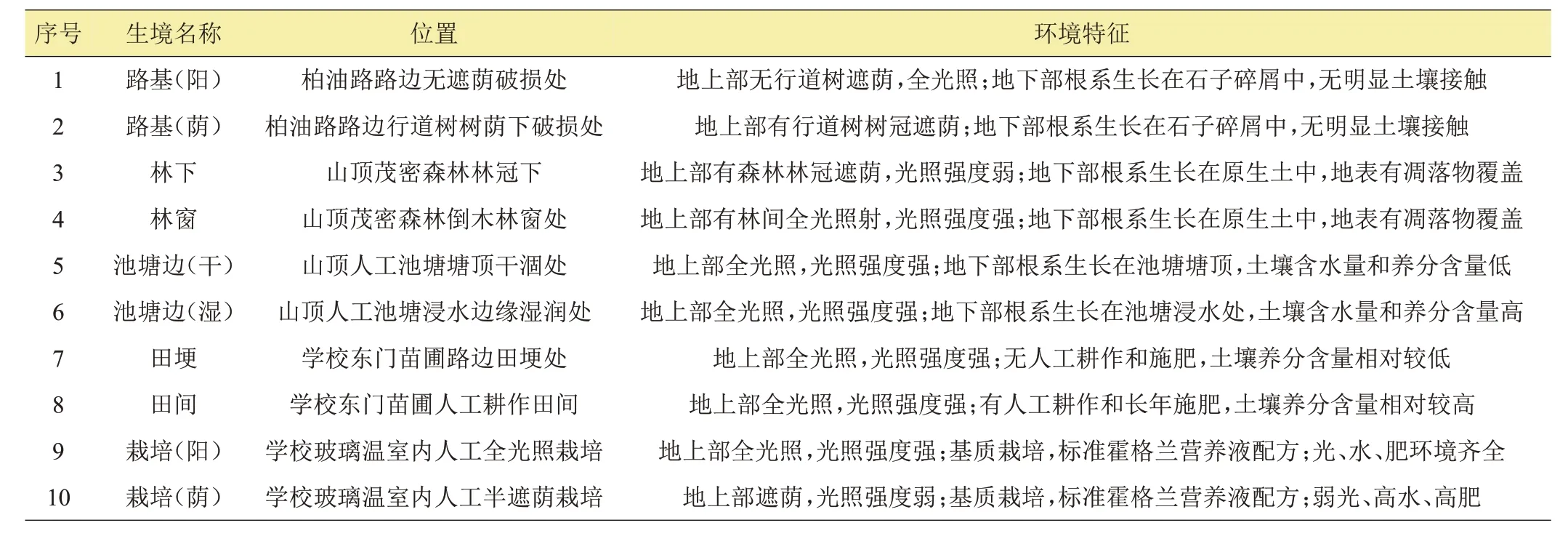
表1 10个不同采样生境的位置和环境特征
在每一个采样点,选择长势良好、高度一致、叶片无破损的植株个体100 株,对每一株进行编号。在所选定的每一株紫茎泽兰个体的中部随机挑选一片已经定型且与上下相邻叶片形状和面积无明显差异的叶片进行活体观察,测定叶片长、宽、面积和叶缘左右两侧锯齿个数。
1.3 指标测定
叶片长和宽用直尺测定,叶面积用活体叶面积测量仪测定。
1.4 数据分析
数据用Excel 2017 进行前期分析处理和后期作图,用SPSS 20.0软件进行统计学单因素方差分析和多因素交叉分析。
2 结果与分析
2.1 叶片长、宽和面积
叶片长、宽和叶面积在10个采样点之间变化趋势明显(图1),按照从大到小为栽培(荫)>田间≈栽培(阳)≈池塘边(湿)>田埂≈林窗>林下>路基(荫)≈池塘边(干)>路基(阳)。人工半遮荫栽培条件下的紫茎泽兰植株叶片最长,长度为(10.85±0.62)cm;叶片基部最宽,宽度为(8.01±0.49) cm;叶面积最大,为(43.55±4.67) cm2;叶片呈暗绿色,叶面与地面平行或向上生长,说明在地下部基质含水量和养分供应充足而光照强度较弱的情况下,紫茎泽兰植株会通过增加叶片面积和调整叶面与地表的角度等机制,接受更多的光照进行光合作用,合成有机物供植株体生长使用,提高个体竞争力。人工全光照栽培条件下的紫茎泽兰植株叶片长、宽和叶面积均显著小于人工半遮荫条件下栽培的植株,叶片长度为(8.70±0.52) cm,宽度为(6.54±0.43)cm,叶面积为(28.39±1.31)cm2;叶片呈暗绿色,但叶面前端朝下,尤其是晴天中午、温室内温度超过35℃的时候,叶面甚至会与地面垂直,说明温室内温度高、光照强的条件下,紫茎泽兰植株会通过降低叶片面积和调整叶面朝向,减少叶片与太阳光照直接接触的机会,降低植株体温度,减少强光和高温对植株体产生的危害。
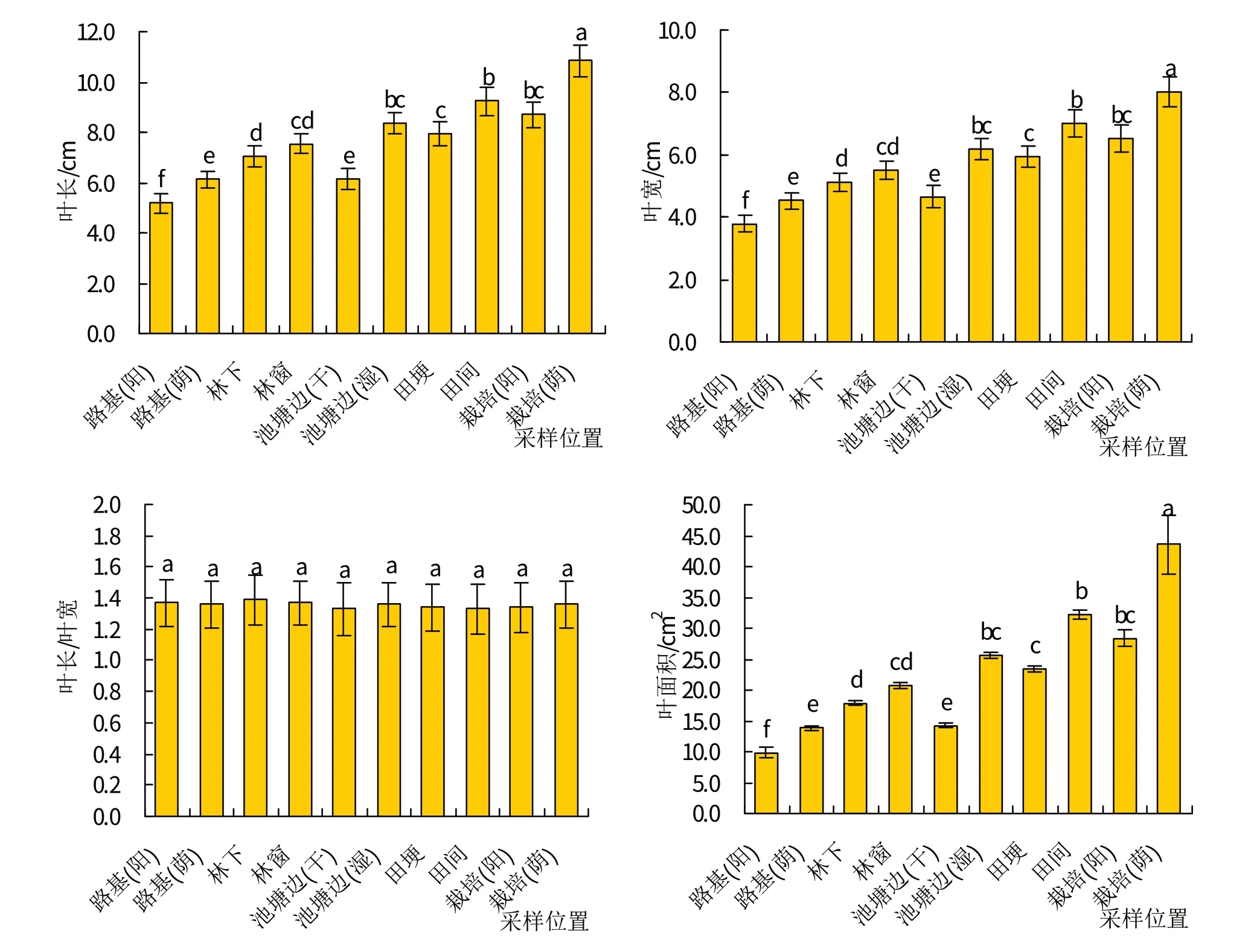
图1 不同生境条件下紫茎泽兰植株叶片形态结构特征
田间人工耕作条件下紫茎泽兰植株叶片长、宽和叶面积均显著小于人工半遮荫栽培环境条件下紫茎泽兰植株叶片的相应指标,但与人工全光照栽培条件下植株叶片的相应指标差异并不明显,而且田间人工耕作条件下紫茎泽兰植株的叶片与地面呈直角生长,说明田间人工耕作条件下的施肥和浇水措施完全能够满足紫茎泽兰植株生长对土壤养分的需求,且光照强度是控制其叶片外部形态结构的主要环境因子。田埂上的紫茎泽兰植株叶片长、宽和面积均显著小于田间紫茎泽兰植株叶片的相应指标,叶片长度为(7.93±0.46)cm,宽度为(5.94±0.32)cm,叶面积为(23.49±0.48)cm2;绝大多数叶片发黄,叶片基部与叶柄相连的部位呈现明显的暗红色,且叶片与地面呈直角生长,说明土壤水分和养分含量两者控制紫茎泽兰植株叶片面积的大小,光照强度控制植株叶片的空间朝向。
池塘边(湿)采样点紫茎泽兰植株叶片长、宽和叶面积均显著高于池塘边(干)采样点紫茎泽兰植株叶片的相应指标,叶片长度为(8.34±0.42)cm,宽度为(6.18±0.33)cm,叶面积为(25.71±0.49)cm2;池塘边(干)采样点紫茎泽兰植株叶片长度为(6.14±0.42) cm,宽度为(4.66±0.36) cm,叶面积为(14.23±0.29) cm2;池塘边(湿)采样点植株叶片呈鲜绿色,叶面生长方向与地面角度较大;池塘边(干)采样点植株叶片呈黄绿色,叶面与地面垂直生长;说明池塘边(湿)采样点紫茎泽兰植株较高土壤水分和养分含量增加了叶片长、宽和叶面积,但全光照条件下使得池塘边(湿)和池塘边(干)2个采样点紫茎泽兰植株叶面的空间朝向差别不大。
林窗采样点紫茎泽兰植株叶片长、宽和叶面积均介于田埂和林下2个采样点中紫茎泽兰植株叶片的相应测定指标,但均没有达到显著性差异水平。林窗采样点中紫茎泽兰植株叶片长为(7.54±0.38) cm,宽为(5.52±0.28) cm,叶面积为(20.76±0.42) cm2;林窗和林下2 个采样点紫茎泽兰植株叶片均呈鲜绿色,叶面与地面呈水平或向上生长,说明2 个采样点虽然光照强度之间有差异,但是差异程度还没有大到可以影响紫茎泽兰植株叶片外部形态结构的程度,或者该森林生态系统还有其他环境因子(如温度、坡度、生物因子等)对紫茎泽兰植株叶片外部形态结构起到控制作用。
路基(阳)和路基(荫)2个采样点中的紫茎泽兰植株根系均没有明显与土壤接触,根部养分含量低,石子碎屑保水能力差,唯一显著的区别就是光照强度。路基(荫)采样点紫茎泽兰植株叶片的长、宽和叶面积均显著大于路基(阳)采样点中紫茎泽兰植株叶片的相应外部形态结构指标,叶片长度为(6.13±0.34)cm,宽度为(4.52±0.27)cm,叶面积为(13.81±0.40)cm2;2个采样点紫茎泽兰植株叶片均呈黄绿色,叶片基部叶脉呈暗红色,叶脉呈浅黄色,与人工栽培条件下紫茎泽兰植株叶片的相应指标相比,路基(阳)和路基(荫)2 个采样点的紫茎泽兰植株均显著较低。在半遮荫、充足水分和养分的人工(荫)采样点中,紫茎泽兰叶长、叶宽和叶面积均达到10 个采样点中的最大值,说明半遮荫、充足水分和养分的环境因子组合最适合紫茎泽兰种群叶片的生长,即光照、土壤水分和养分含量的交互作用对紫茎泽兰植株叶片外部形态结构有影响,且在统计学上表现为显著(图1)。
虽然紫茎泽兰植株叶片长、宽和叶面积在10个采样点之间差异明显,但叶片长和宽的比例相对固定,统计学分析没有显著差异,比例值为1.35左右,说明外部环境条件只能改变紫茎泽兰植株叶片的面积和空间朝向,但不能影响其形状。
2.2 叶缘锯齿
在10个采样点中,所有紫茎泽兰叶片左右两侧叶缘锯齿数差异不显著,为12 个左右;叶片两侧锯齿数比例为1.00左右;说明光照强度、土壤水分和养分含量不能改变紫茎泽兰叶片的叶缘锯齿数(图2)。
2.3 环境因子分析
环境因子光照强度、土壤水分和养分含量以及三者相互交叉作用可以显著影响紫茎泽兰植株叶片的长、宽和叶面积(表2),且影响水平均达到极显著(P<0.001);但对于叶片长宽比、叶缘两侧锯齿数目和比例没有明显影响;说明环境因子光照强度、土壤水分和养分含量以及三者相互交叉作用可以影响紫茎泽兰植株叶片的大小,但不能改变叶片形状和叶缘锯齿数目。
3 结论
(1)不同生境中的光照强度、土壤水分和养分含量以及三者之间的相互交叉组合可以显著影响紫茎泽兰植株叶片的长、宽和叶面积,但对叶片的长宽比、叶缘两侧锯齿数目及比例没有显著影响。本研究所选择的10个采样点中紫茎泽兰植株叶片的长、宽和叶片面积从大到小依次为栽培(荫)>田间≈栽培(阳)≈池塘边(湿)>田埂≈林窗>林下>路基(荫)≈池塘边(干)>路基(阳),说明自然环境条件下虽然紫茎泽兰植物分布广泛,对各种环境因子的适应性较强,但整个生长过程还是会受各种环境因子的制约。
(2)本研究中,光照强度、土壤水分和养分含量对紫茎泽兰植株叶片长、宽和叶面积影响的研究结果与前人相符,说明所测定的试验数据和相关研究结果可信。在同一个面积相对较小的范围内观察10 个不同生境条件下紫茎泽兰植株叶片的外部形态结构,对比各生境中紫茎泽兰植株叶片的长宽比、叶缘两侧锯齿数目及比例,探讨不同种类环境因子及其交叉组合对紫茎泽兰植株叶片外部形态结构的影响,国内外相关研究成果并不多。本研究成果对后期研究紫茎泽兰植株的个体生态学、群落的植物生理特性、生活生长习性和入侵繁衍机制有很好的提示作用,可为紫茎泽兰叶片的化感作用和控制紫茎泽兰植株的持续入侵等相关科研活动提供研究思路。
(3)本研究采用的是活体测定法,测定过程中并没有破坏性的采集紫茎泽兰植株叶片进行内部组织结构解剖观察、烘干称重和成分分析等研究,同期试验小组成员也在测定紫茎泽兰植株不同部位叶片养分积累规律。考虑到植物叶片形态指标较多,包括叶片厚度、叶柄长度、叶面和叶背气孔数量等,而且每一项指标均有其特定的植物生理特性和生态学作用,从一个植物器官外部形态结构的全面性角度考虑,本项目的研究结果只包含了部分叶片外部形态结构指标,试验结果难免有一定的局限性。
4 讨论
按照控制因子属性和影响因素来源的不同,控制和影响植物叶片外部形态结构的因子主要可以分为植物体内部基因、植物体生长外部环境2类[27-28]。从植物体内部基因调控角度分析,植物体可以通过各种生理活动控制细胞内相应遗传基因的表达,调整和控制植物体器官的外部表现,例如根系构造、茎秆抗病性、叶片形状和颜色、花芽分化、花瓣颜色和性状、种皮花纹和种子结构等。有研究表明,与野生型处理试验结果相比,接种过哈茨木霉qid74基因转化体的黄瓜和番茄植株个体比未接种过该基因的同种植物根系侧根数量明显增多、长度明显变长、生物量显著增大,而接种过qid74基因表达体突变植株的黄瓜和番茄植株个体侧根长度则明显变短,给植物个体的地上部和地下部生长造成消极影响[29]。在‘Arina’和‘Forno’重组自交系群体中,由冬小麦品种‘Arina’植物体细胞提供的sun-5BL基因使试验植物个体小麦秆锈病严重程度降低了12%~15%,且植物体整体生长状态良好[30]。在植物茎尖分生组织中叶片开始进行细胞增殖和叶原基发育的同时,CLAVATA1、CLAVATA3、WUSCHEL、KNOTTED1和PHANTASTICA等基因就通过调节植物体激素水平梯度和运输过程,进行相应的基因表达,在植物叶片后续的形状形成过程中开始发挥重要作用[31]。从植物体生长外部环境影响因子角度分析,植物体生长外部环境因子(如地形、气候、土壤、生物等)能够通过增强或减弱植物体营养生长量影响植物体器官的外观表现,如植物器官的生长量、茎秆的粗细和叶片的大小等。在3 种土壤肥力水平(高水分+高肥力、高水分+低肥力、低水分+低肥力)和2种光照强度处理(100%全日照强度、20%全日照强度)的交叉试验中,北方红栎(Quercus rubra)和黄杨(Liriodenron tulipifera)2个树种地上部植物器官生长量与地下部根系生物量之间有显著差异;且在高光照+高水分+高营养的试验处理中,黄杨地上部叶片和茎的质量、地下部根系的质量和吸收水分和养分的表面积均比北方红栎大[32]。单就植物叶片的形态结构分析,小型叶片能够显著降低植物叶片对阳光的吸收和植物蒸腾速率,用以保护植物叶片免受强光照和水分损失的危害[33-34]。大型叶片由于受热面大,吸收的阳光多,相对叶片气孔数量多,蒸腾量大,在高温干旱的地区或季节容易使叶片萎蔫,甚至死亡,所以全球生态系统中热带雨林中的植物叶片面积相对较大[35-36]。即使对于同一种植物,分布在同一地区的不同垂直海拔高度地带之间,或分布在同一垂直海拔高度地带的不同分布地区之间,随着植物生长环境中各种影响因子的改变,其叶片面积也会发生明显变化,以便适应所生长的环境。例如,黄背栎(Quercus guyavifolia) 和多型铁心木(Metrosideros polymorpha)2个树种在高海拔地区减少植物叶面积以适应相对寒冷的气候和贫瘠的土壤环境条件[37-38],油棕(Elaeis guineensis)和淫羊藿(Epimedium brevicornu)2种植物的叶片外部形态和内部生理解剖结构特征在不同省份和区县之间产生变异,以适应不同的人工栽培方式方法和规格要求[39-40]。
由本研究结果可以明显看出,在10个生境中不同环境条件下,紫茎泽兰植株叶片的长、宽和叶面积在人工半遮荫条件下达到最大值,说明:(1)高肥力+高水分+弱光照环境条件比较适合紫茎泽兰叶片外部形态结构的构成和叶片的生长;(2)强光照不仅会减小紫茎泽兰植株叶片面积,还会改变其空间朝向和位置,以便降低强光照对植株叶片的危害,这也可能是紫茎泽兰植株在强光照环境条件下的一种自我保护机制;(3)作为外来入侵物种,虽然紫茎泽兰对各种恶劣环境条件的适应性很强,但是绝大多数野外自然条件下,紫茎泽兰植株的生长还是会受到光照强度、土壤水分和养分含量等环境条件的抑制,生长情况并没有达到最佳状态。不过在10个生境中,强光照+低水分+寡营养的路基处紫茎泽兰植株可以勉强存活,足以说明其生命力的顽强。而对于10 个生境中紫茎泽兰植株叶片长宽比例、叶缘左右侧的锯齿数目和比例等数据差异较小,可能是这些叶片外部形态特征是由紫茎泽兰植物体内某些特定基因控制。此外,玉溪地区属于低纬度、高海拔地区,紫外线较强,对不同生境间光照强度对比的结果显著性也有影响。
从光合作用有机物的形成和积累角度考虑,紫茎泽兰叶片的外部形态结构和生长状况直接影响了其植物体有机物的积累、营养生长的量和后期向生殖生长的转化,且其植物叶片提取液中的提取物对其他植物的化感和抑制作用还在不断的发现过程中,可以说,研究紫茎泽兰植物叶片的外部形态结构、内部器官构造和化学物质组成对研究其植物生理过程和防治其入侵蔓延等工作具有重要意义[2,11-12]。本研究从玉溪师范学院校园内各种小生态环境入手,围绕光照强度、土壤水分和养分含量等环境因子,挑选10个具有代表性的生境,观察紫茎泽兰植株叶片的外部形态结构特征,发现各生境中控制紫茎泽兰植株叶片外部形态结构的关键环境因子,为后期研究紫茎泽兰植株叶片的内部生理解剖结构和叶片提取物的化感作用奠定工作基础,并为紫茎泽兰植物群落内部生态结构功能和特性等研究工作提供理论依据。

