乙酰化花生球蛋白载酶颗粒的制备及表征
李薇 , 石爱民 , 焦博 , 王强
中国农业科学院农产品加工研究所,农业农村部农产品加工综合性重点实验室,北京 100193
脂肪酶被广泛用于催化脂类水解、酯交换、酯化等反应,目前在燃料、制药、化妆品和食品工业等领域备受青睐。脂肪酶具有高选择性,可以替代传统方法中的催化剂,在许多科学领域引起了研究人员的极大兴趣。然而,由于游离脂肪酶存在稳定性差、重复使用率低、对反应介质敏感等缺点,其应用存在一定的局限性[1]。固定化脂肪酶可以提高脂肪酶的热稳定性和化学稳定性,增强脂肪酶的重复利用性、特异性和物理强度[2-3],从而促进脂肪酶活性位点与底物分子的接触,在一定程度上减少扩散阻力[4],提高催化活性,促进反应进行。近年来,脂肪酶固定化的研究受到了越来越多科研工作者的关注。适合的固定化方法是固定化酶制备过程中重要的一步[5]。固定化过程影响脂肪酶的催化效率和重复利用率等。通常,根据脂肪酶与固定化载体之间的相互作用将固定化方法分为物理法和化学法2类,其中物理法有吸附法[6]和包埋法[7],化学法有交联法[8]和共价结合法[9]等。
常用于脂肪酶固定化的材料有中空材料[10]、无机氧化物[11]以及碳材料[12](石墨烯和碳纳米管)等,这些固载材料一般都具有多孔性,能够提供与脂肪酶结合的丰富位点,以提高脂肪酶的固载效率。但是这些材料多是非食品级,可能会存在污染产物、危害环境等问题。随着人们对食品安全和环境保护的意识越来越强,开发食品级脂肪酶固载材料的需求越来越大。近年来,使用蛋白[13-14]、多糖[15]等天然大分子制备固体或软颗粒作为稳定乳液及固载材料等方面得到了广泛应用。前期研究发现,花生分离蛋白微凝胶颗粒(peanut-protein-isolate microgel particles,PPIMP)具有较高的乳化性和界面吸附性,可以作为良好的稳定剂[16-17]。Guan等[18]发现α-乳清蛋白纳米管(α-lac NTs)可以作为脂肪酶的固定化载体,提高脂肪酶的催化效率。此外,有研究发现乙酰基作为亲电基团与蛋白质侧链中的亲核基团发生取代反应,会使蛋白正电荷下降,由此减弱蛋白在酸性条件下(pH 5.5)的聚集沉降。基于此,本研究使用乙酰化花生球蛋白作为脂肪酶的固载材料制备蛋白载酶颗粒(lipase-AAPs),提高了游离脂肪酶的比活性,可以在酸性条件下(pH 5.5)发挥催化活性。
本文使用丁二酸酐对花生球蛋白进行乙酰化处理得到了乙酰化花生球蛋白,利用盐热法制备乙酰化花生球蛋白颗粒(acetylated arachin particles,AAPs),使用戊二醛(glutaraldehyde,GDA)对AAPs和脂肪酶进行交联固定,改变交联固定过程中乙酰化程度、GDA浓度、交联时间、脂肪酶浓度以及脂肪酶与颗粒比例,优化了固定化脂肪酶的固载效率和比活性。对固载前后颗粒的微观形态进行了观察,并通过傅里叶变换红外光谱(fourier transform infrared spectroscopy,FTIR)分析AAPs和脂肪酶的相互作用,以期为制备天然的脂肪酶固定化材料提供理论依据。
1 材料与方法
1.1 材料
花生脱脂粉购自青岛长寿食品有限公司;丁二酸酐购自北京索莱宝科技有限公司;游离脂肪酶购自北京大宏利辉生物科技中心;无水乙醇、氯化钠(NaCl)和碳酸钠(Na2CO3)购自国药集团化学试剂有限公司;Cy5荧光染色剂购自泛博生物有限公司;透析袋(10 kD)GDA、棕榈酸酯(nitrophenyl palmitate,p-NPP)购自北京萃锋试剂有限公司;对硝基苯酚(p-nitrophenol,p-NP)购自上海萨恩化学技术有限公司。
1.2 仪器
恒温水浴锅购自常州金坛良友仪器有限公司;F-2500荧光分光光度计购自日本日立公司;离心机购自德国Thermo Scientific公司;pH计购自瑞士Mettler Toledo公司;剪切机和磁力搅拌器购自德国IKA公司;Spectra MAX 190酶标仪购自美谷分子公司;TENSOR 27傅里叶变换红外光谱仪(fourier transform infrared spectroscopy,FTIR)购自德国布鲁克公司;HITACHI扫描电子显微镜(scanning electron microscopy,SEM)购自日本日立公司。
1.3 花生球蛋白提取
参考本团队前期方法[19]提取花生球蛋白。
1.4 花生球蛋白乙酰化改性
参考Wang等[20]的方法,略有改动。将干燥的花生球蛋白粉末分散于去离子水中(质量百分数为10.0%),用6 mol·L-1NaOH调节溶液pH至10.5,水浴加热至30 ℃,边搅拌边添加含30%蛋白质干基(质量分数)的丁二酸酐,同时要控制溶液保持pH在10.5。得到的酰化花生球蛋白溶液用10 kD透析袋透析24 h。
按照以下方法测定酰化度:使用0.1 mol·L-1NaOH配制上述酰化后和未酰化的1 mg·mL-1蛋白溶液,然后与等体积质量百分数0.1%的茚三酮混合,沸水浴15 min,后置于冰水浴中冷却。冷却后每根试管加入样品溶液等体积的50%(体积分数)的乙醇,用分光光度计在570 nm处测定吸光度。酰化度根据公式(1)进行计算:
其中,C0和C1分别是初始样品和酰化改性样品的吸光度。
1.5 AAPs制备
AAPs制备参考Liu等[21]的方法,略有改动。将透析后的花生球蛋白90 ℃水浴加热30 min,pH调节至5.5,迅速冷却至室温后浓度稀释至6.5%(质量分数),并加入700 mmol·L-1NaCl颗粒制备乙酰化花生球蛋白颗粒。
1.6 固定化酶固载效率和比活性测定
固定化酶的固载效率和比活性测定参考Guan等[18]的方法进行。按照脂肪酶∶AAPs为1∶4的比例加入浓度为10%的脂肪酶,边搅拌(300 r·min-1)边分5次加入共400 μL浓度为1.0%的GDA,室温进行交联固定,固定期间一直搅拌,交联固定时间为1 h,该过程注意避光操作。交联完成后测定固载效率和比活性。
1.6.1 固定化酶固载效率测定 取10 mL 10%脂肪酶溶液与5 mL Cy5荧光染色剂避光搅拌混合染色15 min,转移到透析袋中,放到大烧杯中加入去离子水,避光搅拌透析5.5 h。、透析完后取出大透析袋中的混合物并分别稀释0、5、10、20、40、50倍测定荧光强度。荧光强度对脂肪酶浓度绘制标准曲线(图1)。
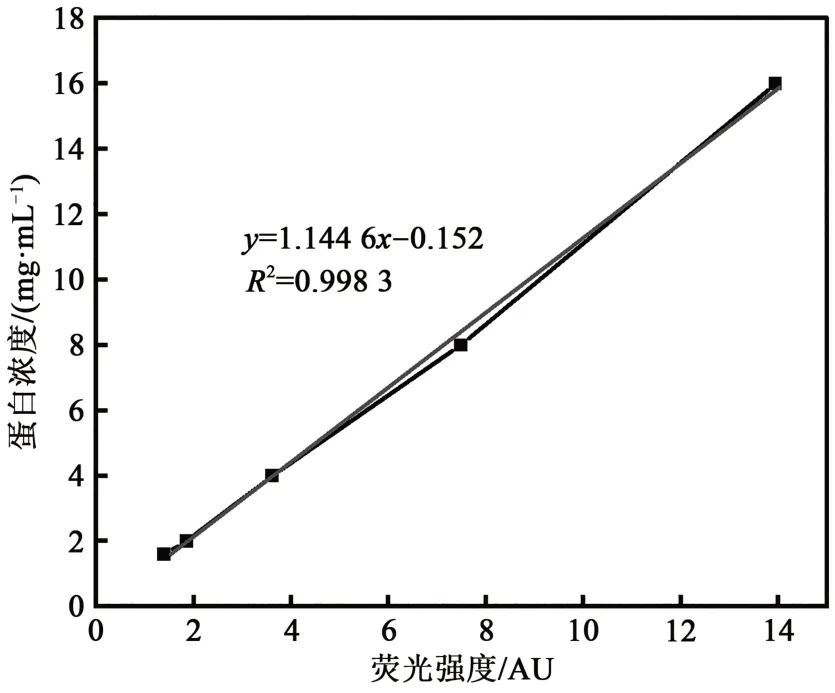
图1 蛋白浓度-荧光强度标准曲线Fig.1 Standard curve of protein concentration and fluorescence intensity
固载效率测定参考Guan等[18]方法进行。取10 mL 12.5%的脂肪酶加入6.25 mL的Cy5荧光染色剂,避光搅拌混合染色15 min,转移到透析袋中。取一定体积和浓度的AAPs按照一定的脂肪酶与颗粒比例加入已染色的脂肪酶(AAPs和脂肪酶总体积保持10 mL),边搅拌边分5次加入共400 μL的GDA,于室温下进行交联固定,固定期间持续搅拌且注意避光操作。固定化后的脂肪酶溶液10015 r·min-1离心15 min(标记好离心前的体积或质量),弃掉上清液,加入一定质量的水,保证离心前后离心管的质量相同,制备得到荧光染色的颗粒,使用6000 r·min-1剪切1 min破碎,测定荧光强度,代入标准曲线,确定被固定的脂肪酶浓度,按照公式(2)计算固载效率。
1.6.2 游离脂肪酶和固定化酶比活性测定 将4 mL 50 mmol·L-1的脂肪酶分别与4、8、12、16、20 mg的p-NP和4 mL 0.5 mol·L-1Na2CO3混合,稀释200倍后于波长410 nm处测定吸光度,吸光度对P-NP浓度绘制标准曲线。空白为不添加p-NP的酶液和Na2CO3的混合溶液。脂肪酶比活性测定具体为:4 mL矿物油溶解40 mg对硝基苯基棕榈酸酯,加入4 mL待测游离脂肪酶和固定化酶,使用剪切机于13000 r·min-1条件剪切1 min。加入4 mL 0.5 mol·L-1Na2CO3终止反应,然后6000 r·min-1条件离心5 min得到水相,于波长410 nm处测定吸光度,代入标准曲线,确定被固定的脂肪酶的酶活,见式(3)。
1.7 固载条件对固定化酶固载效率和比活性的影响
1.7.1 乙酰化程度对固载效率和比活性的影响按照1.4中方法对花生球蛋白进行乙酰化改性,丁二酸酐添加蛋白含量(蛋白质干基质量)分别为0、15%、30%和45%(质量分数),分别对应乙酰化程度为0、9.31%±0.01%、41.71%±0.01%和53.80%±0.30%。制备完AAPs后按照脂肪酶:AAPs为1∶4的比例加入浓度为10%的已染色的脂肪酶,边搅拌(搅拌条件为300 r·min-1)边分5次加入共400 μL浓度为1.0%的GDA,室温下进行交联固定1 h,固定期间一直搅拌,此过程注意避光操作。交联后测定固载效率和比活性。
1.7.2 GDA浓度 按照脂肪酶:AAPs为1∶4的比例加入已染色脂肪酶(质量百分数为10%),边搅拌(搅拌条件为300 r·min-1)边分5次加入共400 μL浓度分别为1.0%、1.5%、2.0%、2.5%、3.0%的GDA,室温下交联固定1 h,固定期间持续搅拌,此过程需避光操作。交联后测定固载效率和比活性。
1.7.3 交联时间对固载效率和比活性的影响 按照脂肪酶:AAPs为1∶4的比例加入浓度为10%已染色的脂肪酶,边搅拌(搅拌条件为300 r·min-1)边分5次加入共400 μL的浓度为1.0 %的GDA于室温进行交联固定,固定期间一直搅拌,交联固定时间分别为0.5、1.0、1.5、2.0、2.5、3.0 h。交联完后确定固载效率和比活性。
1.7.4 脂肪酶浓度对固载效率和比活性的影响按照脂肪酶:AAPs为1∶4的比例分别加入浓度为5.0%、7.5%、10.0%、12.5%、15.0%已染色的脂肪酶,边搅拌(搅拌条件为300 r·min-1)边分5次加入共400 μL的浓度为1.0%的GDA,室温下进行交联固定1 h,固定期间持续搅拌。交联完后确定固载效率和比活性。
1.7.5 脂肪酶与AAPs比例对固载效率和比活性的影响 分别按照脂肪酶:AAPs为1∶3、1∶4、1∶5、1∶6、1∶7、1∶8的比例分别加入浓度为10.0%已染色的脂肪酶,边搅拌(搅拌条件为300 r·min-1)边分5次加入共400 μL的浓度为1.0%的GDA,室温进行交联固定1 h,固定期间持续搅拌。交联完后确定固载效率和比活性。
1.8 AAPs-lipase的微观结构
AAPs-lipase微观结构的观察参考王强研究团队前期方法并略有改动[14]。将冻干后的AAPs、交联后的AAPs以及AAPs-lipase分别粘在铜带上,喷金后使用SEM观察微观结构。
1.9 AAPs-lipase傅里叶变换红外光谱分析
傅里叶变换红外光谱分析参考葛艳争等[22]的方法进行。固体粉末样品的制备采用溴化钾压片法:取适量溴化钾晶体(粉末)于玛瑙研钵中充分研磨成细粉末,装入模具内,在液压机上压制成片,作为空白样品测定;然后将溴化钾粉末与少量冻干固体样品(100∶1)混合制成片用于检测。
1.1 0 数据分析
每项实验均重复3次,取平均值,使用Origin Pro 2021作图。采用SPSS Statistics 26进行数据处理和显著性分析。实验中P<0.05表示差异具有统计学意义。
2 结果与分析
2.1 乙酰化程度对固载效率和比活性的影响
丁二酸酐的乙酰基与蛋白发生乙酰化反应,会影响AAPs与脂肪酶的交联,因此有必要探究乙酰化程度对固载效率和比活性的影响。实验结果表明,随着乙酰化程度增大,lipase-AAPs的固载效率(图2)呈现先增大后减小的趋势,说明适当的乙酰化程度有利于脂肪酶与AAPs的交联固定,但随着乙酰化程度继续增大,由于乙酰基与蛋白质侧链氨基的酰胺反应,减少了AAPs与脂肪酶以及GDA羟基之间的交联位点,使得lipase-AAPs固载效率下降。比活性(图2)随着乙酰化程度增大逐渐减小,这可能是由于酰胺反应掩盖了脂肪酶部分活性位点。同时过多的丁二酸酐会破坏脂肪酶活性位点,进而导致脂肪酶活性下降。因此,后续选择乙酰化程度为41.71%±0.1%的AAPs进行脂肪酶的交联固定。
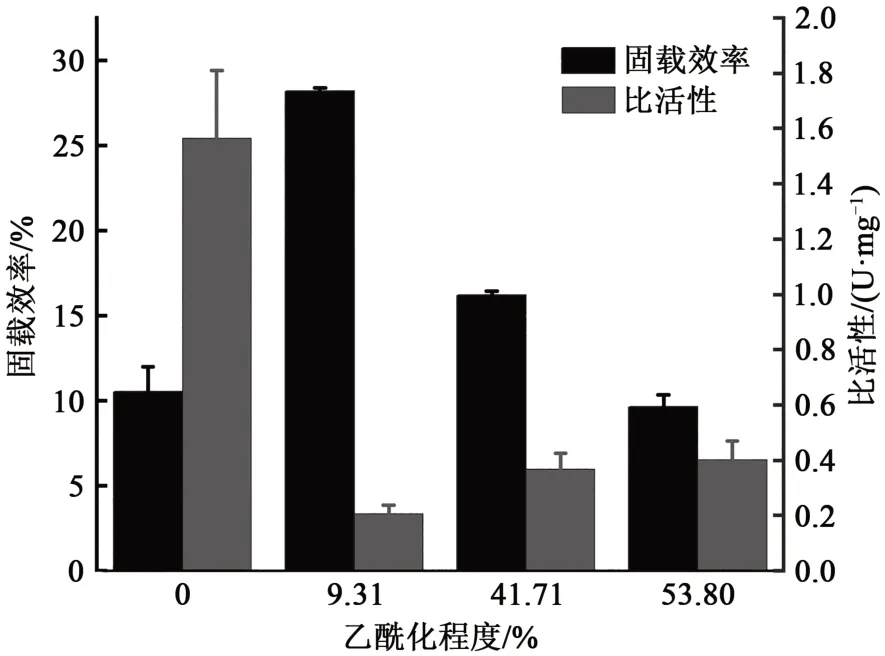
图2 乙酰化程度量对lipase-AAPs固载效率和比活性影响Fig. 2 Effect of the degree of acetylation on immobilization efficiency and specific activity of lipase-AAPs
2.2 GDA浓度对固载效率和比活性的影响
采用双功能试剂GDA作为交联剂,一方面GDA上的醛基可以与蛋白颗粒表面的羟基发生羟醛缩合反应使得蛋白之间发生交联;另一方面也可以与脂肪酶上的羟基或氨基发生羟醛缩合或席夫碱反应,使得酶与蛋白颗粒之间的结合牢固[23]。如图3所示,本研究探究了不同GDA浓度对lipase-AAPs比活性的影响,发现随着GDA浓度增大,lipase-AAPs的比活性先上升,当GDA浓度增大到1.0%时,比活性达到最大,为1.74±0.07 U·mg-1,这可能是因为随着GDA浓度的增大,更多的脂肪酶可以牢固的结合在蛋白颗粒表面,并且保持开放的催化构象,脂肪酶“盖子”呈现打开的状态,脂肪酶催化有效性提高,脂肪酶活性增大[24]。GDA浓度在0.5%~3.0%之间时,随着浓度的增加,固载效率增大。同时,随着GDA浓度增大,更多的醛基与蛋白和脂肪酶发生交联,使得更多的脂肪酶交联固定在AAPs上。更多的脂肪酶固定在AAPs上,导致空间位阻增大,造成拥挤效应[25],这也是比活性下降的原因。当GDA浓度过高时,过多的GDA会包裹住脂肪酶的活性位点,使得脂肪酶比活性下降[26]。因此,后续使用1.0%的GDA对颗粒和脂肪酶进行交联。
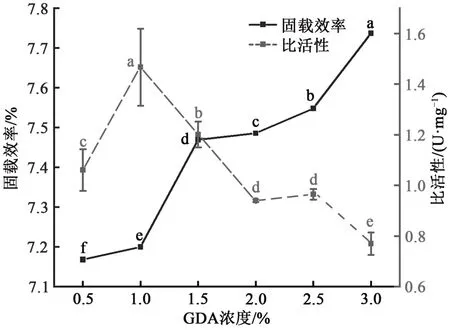
图3 GDA浓度对lipase-AAPs固载效率和比活性影响Fig. 3 Effect of GDA concentration on immobilization efficiency and specific activity of lipase-AAPs
2.3 交联时间对固载效率和比活性的影响
结果发现(图4),随着交联时间的延长固载效率先增加后减小,这可能是因为随着交联时间的延长,GDA和脂肪酶与AAPs之间充分反应,促进了脂肪酶在颗粒上的固定。当交联时间为1 h时固载效率达到最大。但随着时间进一步延长,固载效率下降,这可能是因为随着交联时间延长,GDA发生自交联并促使蛋白与蛋白之间的交联,减弱了脂肪酶与AAPs的交联。脂肪酶比活性随着交联时间的延长呈上升趋势。这与陈强[26]使用陶瓷吸附乳糖酶辅助GDA交联的研究结果一致。陈强[26]将乳糖酶与陶瓷交联固定,需要GDA交联4 h,本实验缩短了脂肪酶与蛋白颗粒交联的时间。随着时间延长,AAPs已完成与脂肪酶的交联,综合考虑1 h为最佳交联时间。
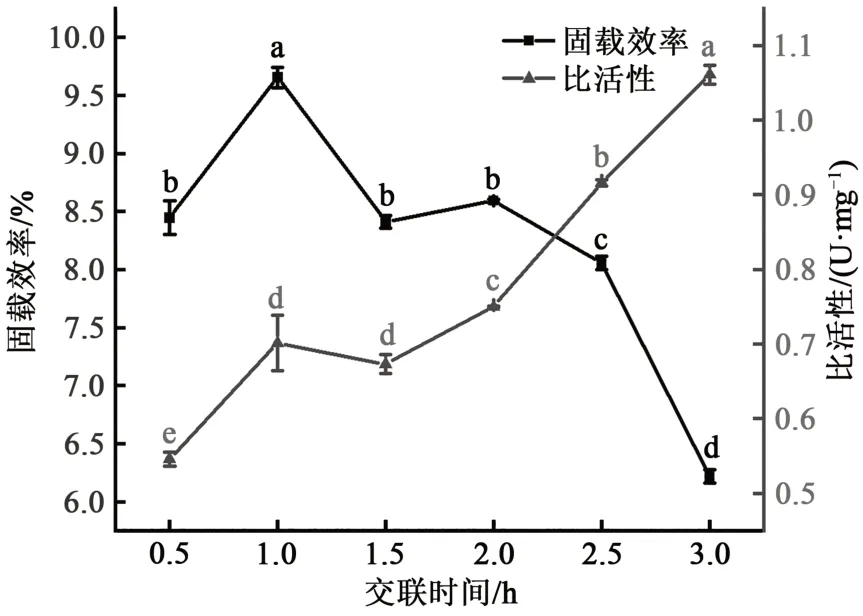
图4 交联时间对lipase-AAPs固载效率和比活性影响Fig. 4 Effect of crosslinking time on the immobilization efficiency and specific activity of lipase-AAPs
2.4 脂肪酶浓度对固载效率和比活性的影响
结果发现(图5),随着脂肪酶浓度的增加固载效率呈下降趋势,这可能是因为随着脂肪酶浓度升高,GDA会引起脂肪酶之间的交联,减少了脂肪酶与颗粒之间的交联,从而降低了固载效率。同时,随着脂肪酶浓度升高脂肪酶比活性呈现出先升高后降低的趋势,这可能是因为前期脂肪酶浓度升高,脂肪酶在颗粒上交联,其比活性升高,脂肪酶浓度过大产生位阻效应,降低了脂肪酶的比活性。这与前述增大GDA浓度提高脂肪酶的固载效率降低比活性的结果是一致的。在王琳[27]的研究中采用共价结合的方法对脂肪酶与磁性纳米颗粒进行结合固定也呈现出相似的结果。王琳[27]认为随着脂肪酶浓度增大脂肪酶易在蛋白颗粒的表面发生团聚,掩盖彼此的活性中心,影响脂肪酶与底物的结合,使比活性下降。因此,后续采用10%的脂肪酶制备固定化酶。
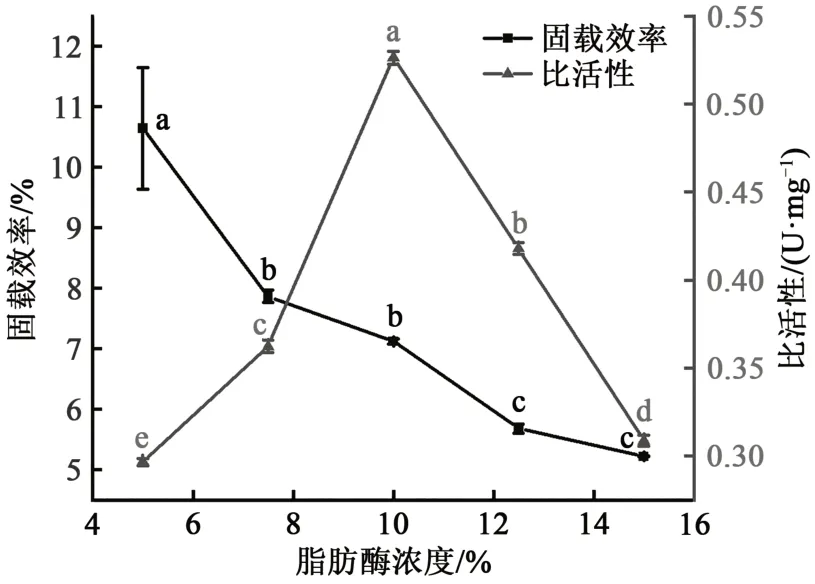
图5 脂肪酶浓度对lipase-AAPs固载效率和比活性影响Fig. 5 Effect of lipase concentration on the immobolization efficiency and specific activity of lipase-AAPs
2.5 脂肪酶与AAPs比例对固载效率和比活性的影响
固载效率随着AAPs占比的增大而减小,这是因为AAPs占比增大在GDA的作用下蛋白颗粒之间彼此交联,降低了其与脂肪酶之间的交联。这与上述改变脂肪酶浓度的结果是一致的。比活性随着颗粒占比的增加呈先增加后减小的趋势。当脂肪酶与颗粒比例为1∶4时,固载效率为12.95%±0.03%(图6)。前期比活性增加是因为在脂肪酶与蛋白颗粒的交联作用下脂肪酶移至油水界面,增大了催化活性。而随着颗粒占比的增大,更多颗粒发生自身交联的同时,会掩盖脂肪酶的活性位点降低脂肪酶的比活性。综合考虑,制备Lipase-AAPs的脂肪酶与AAPs的比例为1∶4。
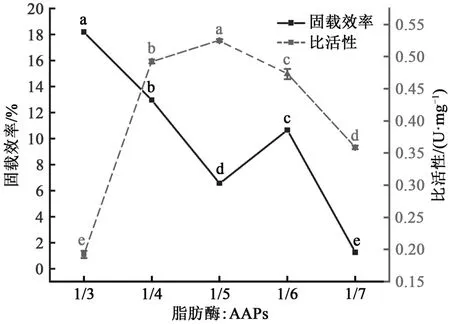
图6 脂肪酶与AAPs比例对lipase-AAPs固载效率和比活性影响Fig. 6 Effect of the ratio of lipase to AAPs on immobilization efficiency and specific activity of lipase-AAPs
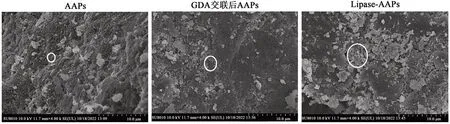
图7 AAPs、GDA交联后的AAPs以及lipase-AAPs的SEM图像Fig. 7 SEM images of AAPs, AAPs after GDA crosslinking and lipase-AAPs
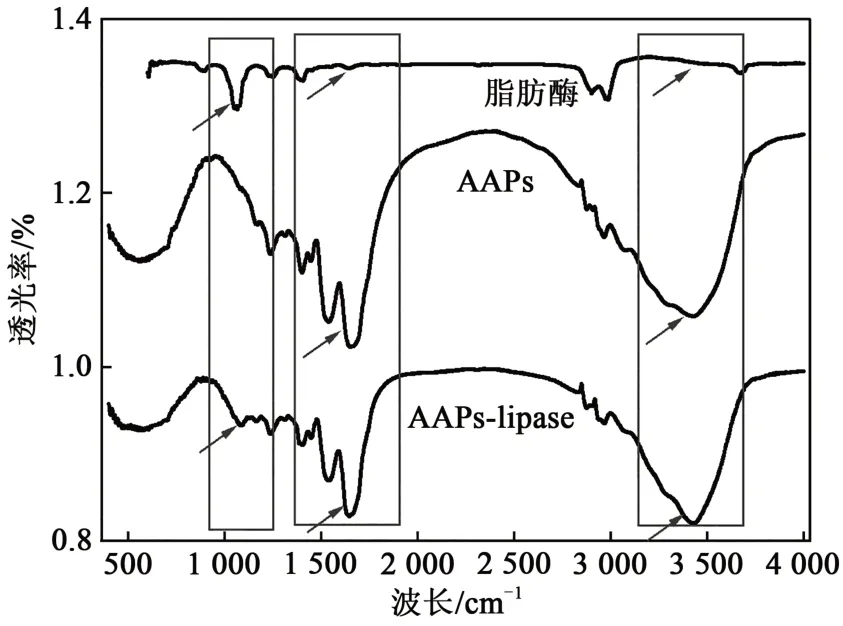
图8 脂肪酶、AAPs和lipase-AAPs傅里叶变换红外光谱图Fig. 8 FTIR of lipase, AAPs and lipase-AAPs
2.6 最佳条件下的固载效率和比活性
综上所述,当乙酰化程度为41.71%±0.01%,GDA浓度为1.0%,交联时间1 h,脂肪酶浓度为10.0%以及脂肪酶与AAPs比例为1∶4时,制备lipase-AAPs,此时lipase-AAPs的固载效率和比活性分别为12.95%±0.03%和1.74±0.07 U·mg-1,其中比活性为游离脂肪酶的120%。比活性上升的原因可能是在测定脂肪酶比活性时,脂肪酶被固定在蛋白颗粒上可以强烈地吸附在蛋白颗粒表面,而在油水界面上的脂肪酶构象转变为活性更高的开放形式[24]。蛋白载酶颗粒在催化底物(油相)时,由于剪切过程产生了无数个小液滴,增大了催化的界面面积,缩短了传质距离[21],因此有利于催化活性的提高。同时,蛋白载酶颗粒在油水界面上吸附有利于与底物(油相)的接触,脂肪酶可以在界面处发挥催化作用,增大了其催化的有效性。
2.7 AAPs、GDA交联后的AAPs以及lipase-AAPs微观结构
使用SEM分别观察AAPs、GDA交联后的AAPs以及lipase-AAPs。结果发现,AAPs呈现出不规则球状,Liu等[28]通过原子力显微镜观察到使用盐热法制备的大豆球蛋白纳米颗粒大多也呈现出椭球形和不规则球形,这与本实验结果类似。经过GDA交联后的AAPs依然呈现出上述形状,并且在GDA的交联作用下颗粒彼此之间更加紧密。Lipase-AAPs仍为紧密椭球形或球形,在视野中出现较大的脂肪酶团簇,这在Guan等[18]通过透射电镜观察利用GDA将脂肪酶固载到α-乳白蛋白纳米管(α-lac-NTs)上的结果类似。
2.8 Lipase-AAPs傅里叶变换红外光谱分析
脂肪酶在1060~1070 cm-1处有透射峰,这主要是由C—O拉伸引起的,而AAPs在该波长处没有出现此透射峰,交联后形成的lipase-AAPs在该范围内出现透射峰。AAPs在1630~1690 cm-1处有C=O伸缩振动[29],脂肪酶在该波长处没有相应的透射峰,而lipase-AAPs在此处也表现出相应的透射峰。AAPs在3300~3500 cm-1处存在较宽的N—H伸缩振动[30],lipase-AAPs也出现此透射峰。综上说明,脂肪酶与AAPs发生了交联。
3 讨论
实验探究了lipase-AAPs固载效率和比活性的最适条件,当丁二酸酐添加量为蛋白质干基质量的30%(乙酰化程度为41.71%±0.01%)、GDA浓度为1.0%、交联时间1 h、脂肪酶浓度为10.0%以及脂肪酶和AAPs比例为1∶4时,最终得到lipase-AAPs的最佳固载效率和比活性分别为12.95%±0.03%和1.74±0.07 U·mg-1,比活性为游离脂肪酶的120%。由此制备具有良好固载效率和比活性的lipase-AAPs。用SEM观察颗粒微观形态,AAPs、GDA交联后的AAPs以及lipase-AAPs,均呈现出不规则的球形,脂肪酶与AAPs经GDA交联后,有脂肪酶簇覆盖在AAPs上。FTIR结果显示,lipase与AAPs交联后存在同lipase相同的C—O拉伸透射峰,脂肪酶与AAPs已共价交联。
综上可知,研究初步将脂肪酶与蛋白颗粒进行了交联固定,并使用对固载前后颗粒的微观形态进行了观察,并通过FTIR分析了AAPs和脂肪酶的相互作用,为制备天然的脂肪酶固定化材料提供了理论依据。但是,目前对于脂肪酶与蛋白颗粒之间的分子相互作用机制尚不清楚,有待于通过分子动力学模拟蛋白和脂肪酶之间的相互作用和构象关系,对更加精细的分子相互作用变化进行深入研究,以构建更高比活性和固载效率的固定化酶颗粒。固定化酶颗粒有着广阔的应用前景,例如应用到油脂脱酸、制备功能性油脂等,将为食品产业多样化需求提供绿色可持续的途径。

