乳腺癌原发灶与肝转移灶受体表达差异研究
金奕滋,林明曦,张 剑
复旦大学附属肿瘤医院Ⅰ期临床试验病房,复旦大学上海医学院肿瘤学系,上海 200032
乳腺癌是全世界发病率最高的恶性肿瘤,并且是导致癌症相关死亡的主要原因之一[1]。临床上常根据雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)表达和Ki-67增殖指数来定义乳腺癌的分子分型,作为区分乳腺癌内在亚型的替代分类方法。ER、PR和HER2的表达特征决定了患者的预后,同时也是临床医师制订诊疗方案时的重要依据。
由于肿瘤异质性的存在,乳腺癌的ER、PR和HER2表达存在一定的时间和空间异质性。在乳腺癌诊治过程中,为了能够更精准地制订治疗计划,重新评估乳腺癌转移灶的受体状态十分重要。由于病理学检查仍然是评估受体状态的金标准,目前美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)、欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)等发布的指南推荐在诊断转移灶时重新进行肿瘤活检[2-3]。
肝脏是乳腺癌转移的主要靶器官之一,发生肝转移的乳腺癌患者预后较差[4]。既往研究[5]提示乳腺癌存在肿瘤转移异质性,不同分子亚型的乳腺癌存在器官选择性。同时,转移性肿瘤在适应靶器官的微环境和增殖生长的过程中表现出器官特异性的特征,转移至不同器官的转移灶可能呈现不同的分子和表型特征。大样本人群的meta分析[6-7]显示,不同部位转移灶的受体状态变化率可能不同,因此有必要根据不同转移部位分别进行分析。肝脏是乳腺癌转移主要靶器官中相对易行再活检的部位,然而既往对乳腺癌肝转移灶中该现象发生率和预后意义的研究尚不充分。同时,受体转变受到哪些因素的影响尚不明确,治疗因素是否会影响受体状态的转变目前结论不一。此外,随着近期抗体药物偶联物(antibody-drug conjugate,ADC)类药物的疗效在HER2低表达患者中被证实,HER2低表达乳腺癌或将成为一类新的靶向治疗亚型[8-10]。然而HER2低表达状态在乳腺癌的疾病演变中具有一定的不稳定性。对于乳腺癌肝转移灶中HER2零表达和HER2低表达状态转变的发生比例尚未见报道。
本研究旨在分析乳腺癌原发灶和配对肝转移灶之间ER、PR和HER2表达情况的异质性,探究受体状态转变的影响因素,以及受体状态变化对患者生存预后的影响。
1 资料和方法
1.1 研究对象
回顾性收集2013年1月—2020年5月在复旦大学附属肿瘤医院行肝组织活检或外科切除术后经病理学检查确诊为乳腺癌肝转移的患者的临床和病理学资料。根据复旦大学附属肿瘤医院电子病历系统及病理科诊断记录,本研究纳入了乳腺癌原发灶和匹配的肝转移灶均完整记录ER、PR和HER2检测结果[采用免疫组织化学(immunohistochemistry,IHC)和原位杂交(in situhybridization,ISH)检测]的患者。排除HER2 IHC为2+但无ISH检测结果或罹患多原发性恶性肿瘤的患者。病理学诊断结果均以复旦大学附属肿瘤医院病理科的会诊报告结果为准。
1.2 乳腺癌受体状态的解读
根据最新版A S C O/美国病理学家协会(College of American Pathologists,CAP)指南[11-12]对受体状态进行判读。当HER2 IHC评分为3+,或2+且ISH显示HER2有扩增时,认为HER2状态为阳性;当HER2 IHC评分为0或1+,或HER2 IHC评分为2+且ISH显示HER2无扩增时,认为HER2状态为阴性。在HER2阴性肿瘤中,当HER2 IHC 1+或IHC 2+且ISH结果阴性时,定义为HER2低表达;当HER2 IHC为0时,定义为HER2零表达。当至少1%的肿瘤细胞IHC染色阳性时,ER和PR状态被定义为阳性。当肿瘤为ER阳性和(或)PR阳性时,激素受体(hormone receptor,HR)状态为阳性。
1.3 统计学处理
采用描述性统计分析患者的基线情况和临床病理学特征。采用Kappa一致性检验分析原发灶和转移灶ER、PR及HER2表达的一致性,0.8 <Kappa值≤1表示一致性强,0.6<Kappa值≤0.8表示一致性较强,0.4<Kappa值≤0.6表示一致性中等,0.2<Kappa值≤0.4表示一致性一般,Kappa值≤0.2表示一致性较差。采用配对χ2检验分析原发灶及转移灶的受体表达变化差异是否有统计学意义。使用桑基图直观反映乳腺癌原发灶到配对肝转移灶的受体状态和分子分型的变化。对于在不同时间点多次进行肝转移灶病理学检查的患者,将肝转移首次病理学诊断的结果纳入统计学分析,对其余结果作描述性补充。
无病间隔期(disease-free interval,DFI)定义为手术切除乳腺癌原发灶至确诊乳腺癌复发或转移的时间。总生存期(overall survival,OS)定义为从确诊乳腺癌复发或转移至死亡的时间。采用Kaplan-Meier法绘制生存曲线,采用log-rank检验比较组间差异。基于COX比例风险回归模型进行多因素分析并计算风险比和95% CI。
为探究与乳腺癌肝转移灶中ER、PR和HER2状态转变相关的因素,我们首先采用χ2检验或Fisher精确概率检验进行单因素分析。感兴趣的变量包括乳腺癌初诊时的年龄(≤50岁或>50岁)、DFI(初治Ⅳ期;≤24个月;>24个月)、组织学类型(浸润性导管癌或其他)、原发灶和肝转移灶的确诊时间间隔(<3个月或≥3个月)、再次活检前是否进行过内分泌治疗、再次活检前是否进行过抗HER2治疗、再次活检前是否进行过化疗。采用logistic回归模型进行多因素分析,计算比值比(odds ratio,OR)及其95% CI。
采用SPSS 26.0和R软件3.6.3版进行统计学分析和可视化处理。所有统计学分析均为双侧检验,P<0.05为差异有统计学意义。
2 结 果
2.1 患者基线情况
2013年1月—2020年5月,共有468例患者于复旦大学附属肿瘤医院行肝组织活检或外科切除术后经病理学检查证实为乳腺癌肝转移,排除乳腺癌原发灶ER、PR和HER2表达情况缺失的患者100例,排除肝转移灶ER、PR和HER2表达情况缺失的患者8例,排除罹患多原发性恶性肿瘤的患者7例,最终纳入353例乳腺癌肝转移患者。纳入排除流程见图1。
入组患者的人口学及临床病理学特征汇总情况见表1。入组患者的中位年龄为46岁。有91.5%的患者乳腺癌组织学类型为浸润性导管癌。在原发灶和肝转移灶中,HR+/HER2-亚型均占比最高(原发灶中占比61.5%,肝转移灶中占比53.8%)。

表1 纳入患者的基线特征Tab. 1 Baseline characteristics of the included patients[n( %)]
入组患者原发灶和肝转移灶病理学检查确诊的中位间隔时间为32.3个月。初治Ⅳ期患者、DFI≤24个月及DFI>24个月的患者比例分别为13.0%、38.0%及49.0%。在首次发现转移时,51%的患者有2个及以上部位的转移,90.1%的患者合并内脏转移。在所有纳入的患者中,在肝转移灶再活检前接受过内分泌治疗、抗HER2治疗及化疗的患者比例分别为64.9%、15.9%及87.8%。
2.2 原发灶与肝转移灶之间受体状态的不一致 率
从原发灶到肝转移灶,ER状态的总不一致率为19.5%(69/353),其中14.2%(50/353)的患者ER状态由阳性转为阴性,5.4%(19/353)的患者由阴性转为阳性;Kappa一致性检验结果提示ER表达在原发灶和肝转移灶之间的一致性中等(Kappa值 = 0.569);配对χ2检验提示ER状态在原发灶和转移灶之间的变化差异有统计学意义(P<0.001)。
从原发灶到肝转移灶,PR状态的总不一致率为39.4%(139/353),其中33.1%(117/353)的患者PR状态由阳性转为阴性,6.2%(22/353)的患者由阴性转为阳性;Kappa一致性检验结果提示PR表达在原发灶和肝转移灶之间的一致性一般(Kappa值 = 0.258);配对χ2检验结果提示PR状态在原发灶和转移灶之间的变化差异有统计学意义(P<0.001)。
从原发灶到肝转移灶,HER2状态的总不一致率为4.8%(17/353),由阳性转为阴性的仅有2.3%(8/353),由阴性转为阳性的仅有2.5%(9/353);Kappa一致性检验提示HER2表达在原发灶和肝转移灶之间的一致性强(Kappa值 = 0.876);配对χ2检验提示HER2状态在原发灶和肝转移灶之间的变化差异无统计学意义(P> 0.05)。
在初治Ⅳ期患者中,ER、PR和HER2的不一致率分别为15.2%(7/46)、28.3%(13/46)和2.2%(1/46),其中ER、PR和HER2由阳转阴率分别为8.7%(4/46)、21.7%(10/46)和0.0%(0/46),由阴转阳率分别为6.5%(3/46)、6.5%(3/46)和2.2%(1/46)。
将HER2阴性进一步分为HER2低表达和HER2零表达亚型,有37.9%(50/132)的HER2零表达患者在肝转移灶中转变为HER2低表达。从原发灶到肝转移灶,在HER2阳性转为HER2阴性的8例患者中,6例患者转变为HER2低表达,仅2例患者转变为HER2零表达。HER2表达在原发灶和肝转移灶之间一致性的Kappa值为0.532,配对χ2检验提示HER2状态的变化差异无统计学意义(P= 0.296)。
采用桑基图描绘了原发灶和肝转移灶之间ER、PR和HER2状态的变化情况(图2)。总体来看,PR的不一致率最高,尤其是PR由阳性转为阴性的患者比例较高。ER和PR表达由阳性转为阴性的比例均高于由阴性转为阳性的比例,而HER2状态由阳性转为阴性与由阴性转为阳性的比例相当。
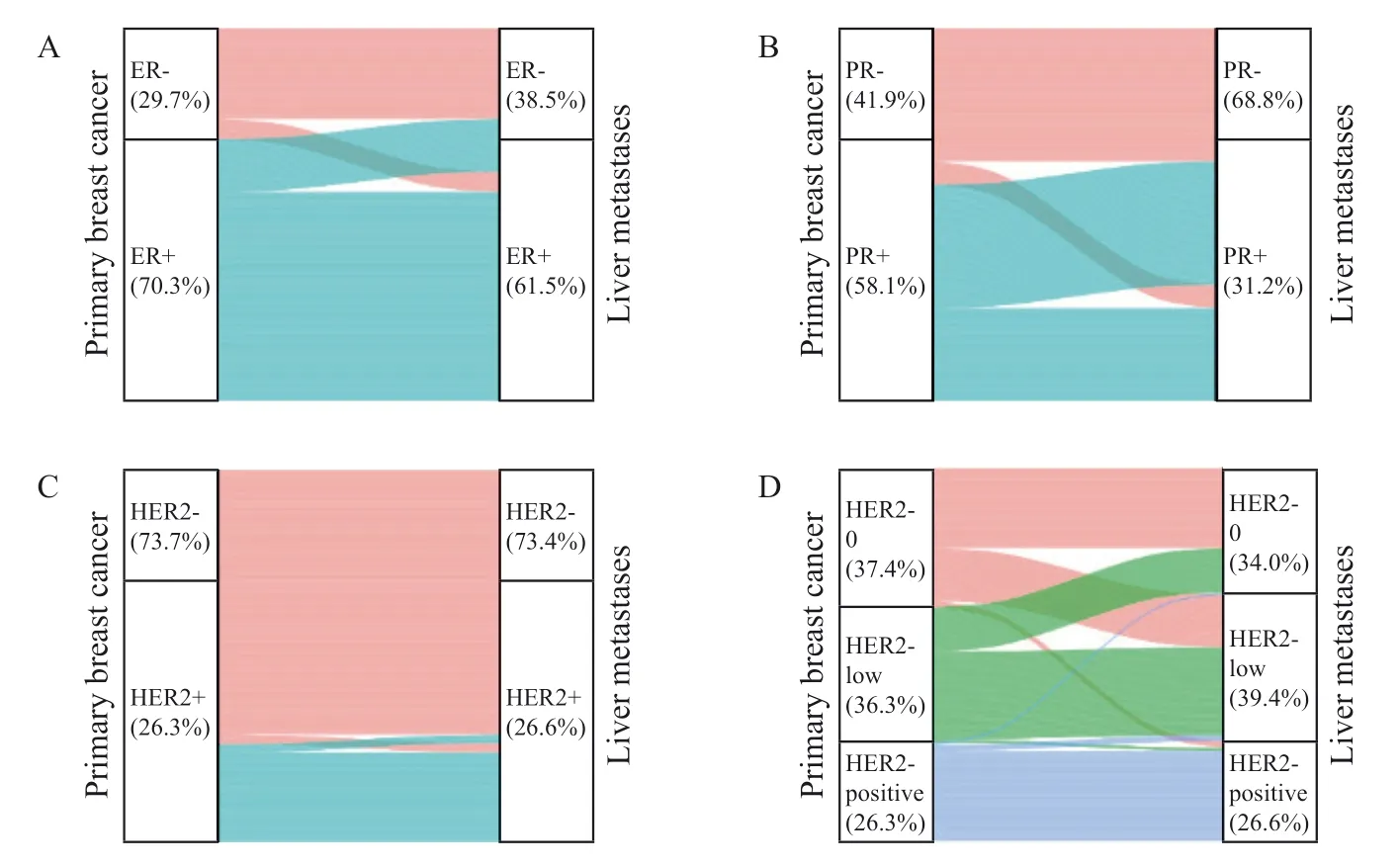
图2 乳腺癌原发灶和肝转移灶之间ER、PR和HER2状态变化的桑基图Fig. 2 Sankey diagrams of changes in ER, PR and HER2 status between primary breast cancer and liver metastases
乳腺癌原发灶与配对肝转移灶的分子分型变化情况见图3。肝转移灶更多呈现为三阴性型(从12.2%上升至19.5%),更少表现为HR+/HER2-型(从61.5%下降至53.8%)。有16.6%(36/217)的HR+/HER2-患者转变为三阴性型;4.1%(9/217)的HR+/HER2-患者转变为HER2+型。27.9%(12/43)的三阴性型患者转变为HR+/HER2-型;未观察到有三阴性型患者转变为HER2+型。分子分型不一致率最高的是HR+/HER2+,仅53.7%(22/41)的患者肝转移灶维持原分型;分子分型不一致率最低的是HR-/HER2+型,84.6%(44/52)的患者肝转移灶维持原分型。
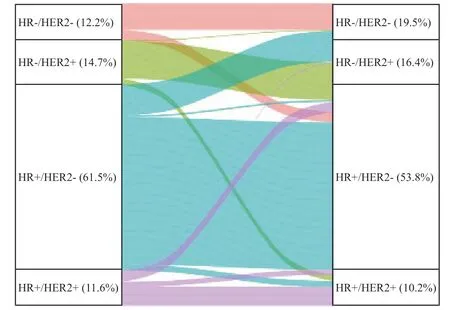
图3 乳腺癌原发灶与配对肝转移灶的分子分型变化情况Fig. 3 Changes in molecular typing of primary breast cancer and paired liver metastases
在接受两次肝穿刺活检的患者中,6例患者第1次和第2次检查的受体状态不一致,其中3例由HR+/HER2-型转变为三阴性型,另外3例仅PR状态不一致(表2)。
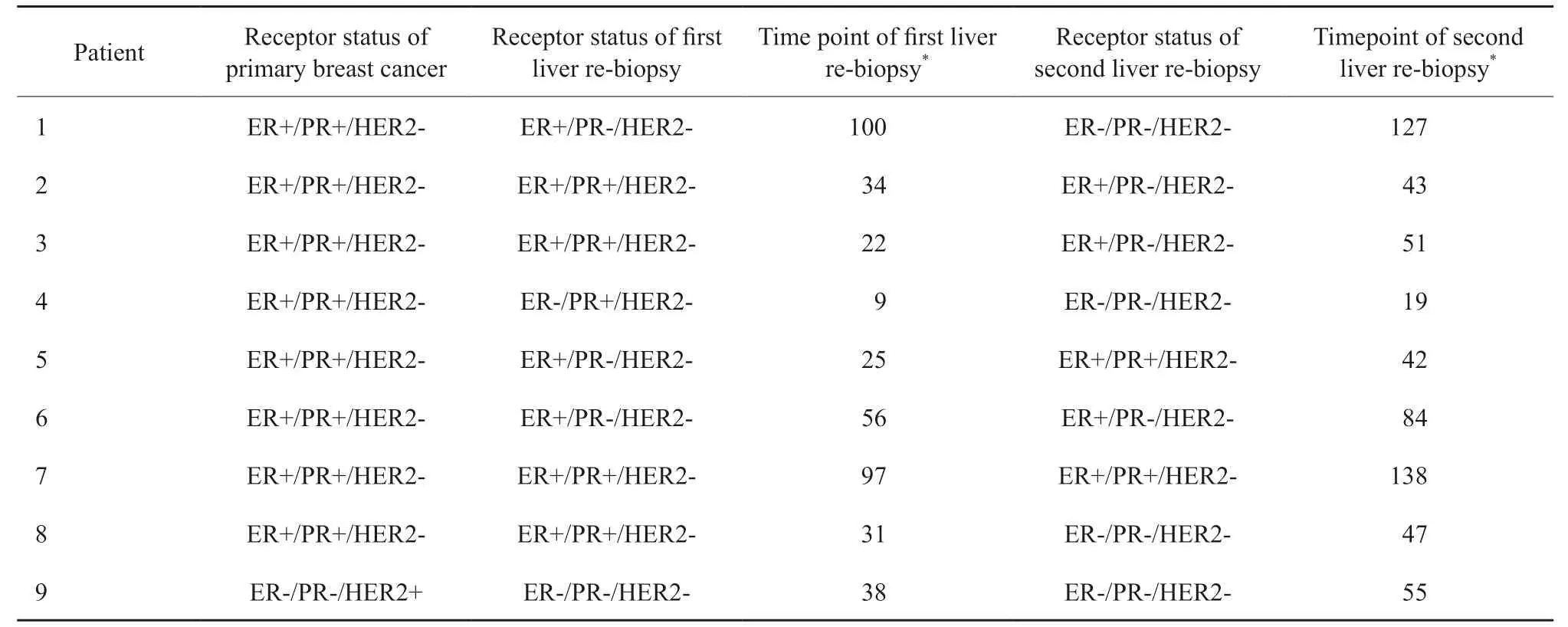
表2 接受两次肝穿刺活检的患者原发灶与肝转移灶受体状态Tab. 2 The receptor status of primary breast cancer and liver metastases in patients who underwent second liver re-biopsies
2.3 受体状态改变的影响因素
为探究与ER、PR和HER2状态改变相关的因素,首先通过χ2检验或Fisher精确概率检验进行单因素分析。感兴趣的变量包括乳腺癌初诊时的年龄(≤50岁或>50岁)、DFI(初治Ⅳ期;≤24个月;>24个月)、组织学类型(浸润性导管癌或其他)、原发灶和肝转移灶的确诊时间间隔(<3个月或≥3个月)、再次活检前是否进行过内分泌治疗、再次活检前是否进行过抗HER2治疗、再次活检前是否进行过化疗。单因素分析结果显示,DFI(P<0.001)、组织学类型(P= 0.023)和再次活检前经过内分泌治疗(P<0.001)是PR不一致的影响因素;在感兴趣的变量中未发现与ER、HER2不一致相关的因素(表3)。多因素logistic回归分析结果表明,只有内分泌治疗是PR不一致的独立影响因素,再活检前接受过内分泌治疗的患者更易出现PR状态的改变(OR = 4.76,95% CI:2.80 ~ 8.10,P<0.001)。
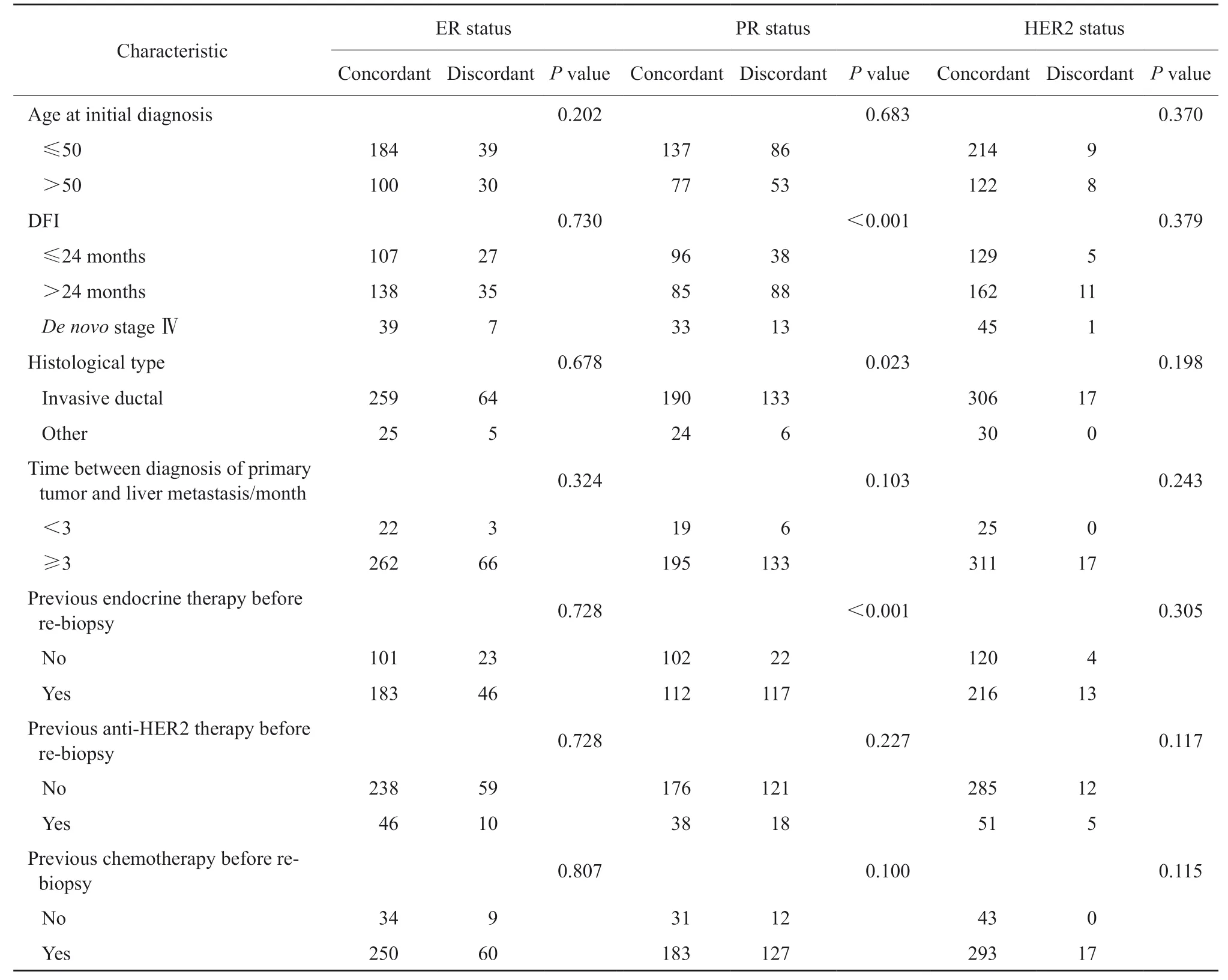
表3 受体状态不一致相关变量的单因素分析Tab. 3 Univariate analyses of factors associated with receptor discordance
2.4 受体状态改变对生存预后的影响
本研究中患者生存随访截至2 0 2 2 年6 月30日,中位随访时间为43.3个月(95% CI:37.1 ~ 49.4个月)。在原发灶为三阴性型的患者中,转移灶转变为HR+/HER2-的患者比保持三阴性型的患者呈现OS更长的趋势,但差异无统计学意义(中位OS:36.7个月vs20.9个月,P= 0.310,图4A)。对于原发灶为HR+/HER2-的患者,肝转移灶不同分型的患者OS存在显著差异(P= 0.022,图4B),其中肝转移灶转变为三阴性型的患者比维持原分型的患者OS显著更差(中位OS:28.5个月vs51.9个月,P= 0.013),肝转移灶转变为HER2阳性型的患者比维持原分型的患者呈现OS更短的趋势,但差异无统计学意义(中位OS:33.6个月vs51.9个月,P= 0.098)。在原发灶为HER2阳性型的患者中,肝转移灶转变为三阴性型的患者比维持原分型的患者呈现OS更短的趋势(中位OS:31.7个月vs46.7个月),但三组之间的差异无统计学意义(P= 0.780,图4C)。
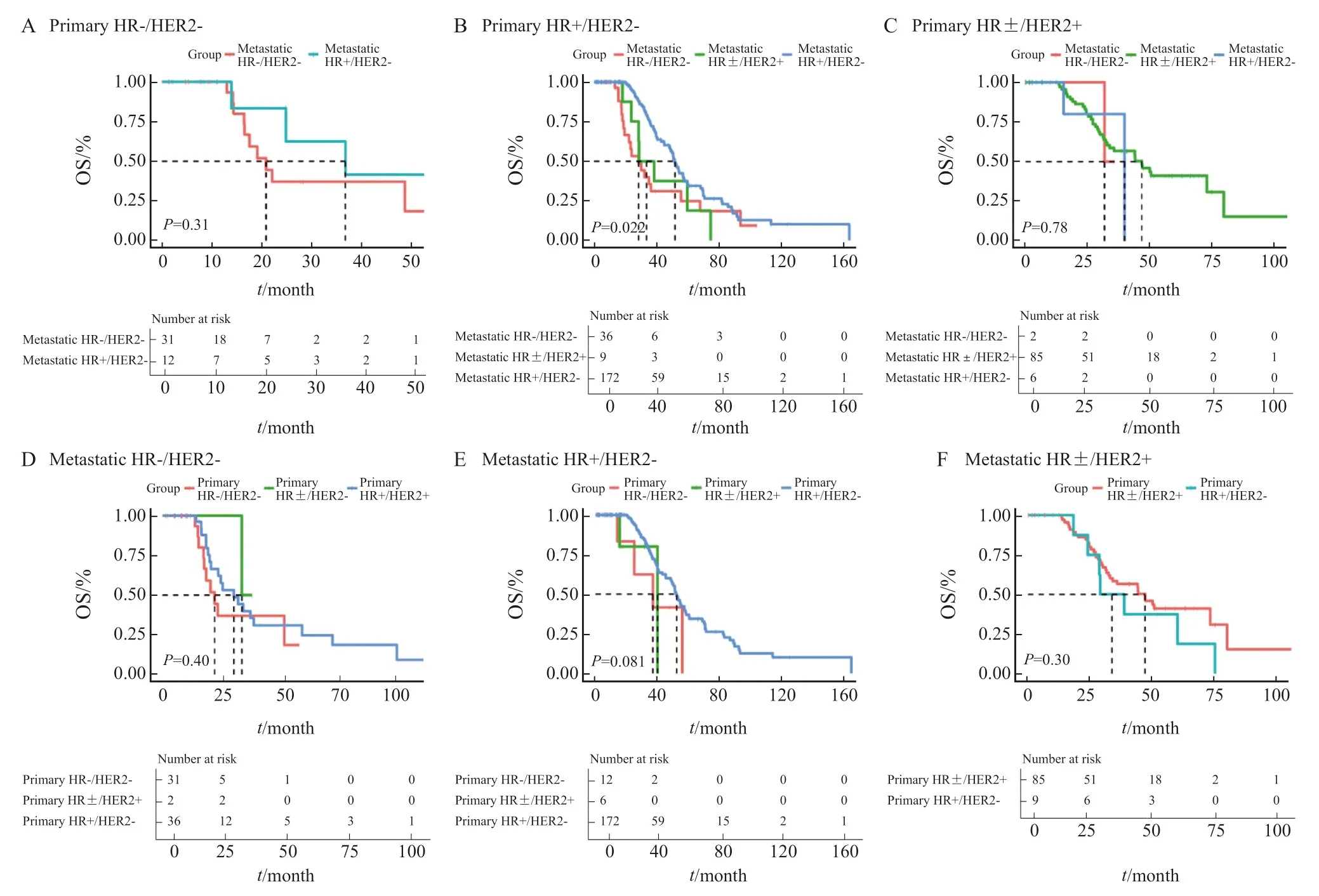
图4 受体状态转变对OS的影响Fig.4 The influence of receptor conversion on OS
而当肝转移灶分子分型相同时,无论原发灶为何种分子分型,不同组别之间的OS差异均无统计学意义(图4D:肝转移灶为HR-/HER2-型,P= 0.40;图4E:肝转移灶为HR+/HER2-型,P= 0.081;图4F:肝转移灶为HR±/HER2+型,P= 0.30)。
对原发灶为HR+/HER2-的患者进行多因素生存分析,将显著影响OS的因素纳入COX比例风险回归模型,经校正混杂因素(首诊复发转移时是否合并内脏转移)后,结果依然表明肝转移灶转变为三阴性型的患者比维持原分型的患者具有显著更短的OS(校正风险比 = 2.03,95% CI:1.21 ~ 3.39,校正P= 0.007)。
以上结果表明,原发灶分子分型一致但转移灶分子分型不同的患者倾向于具有不一致的OS,且预后情况主要由转移灶的分子分型决定;而转移灶分子分型相同的患者预后情况类似,尽管其原发灶分子分型不同。
3 讨 论
乳腺癌的瘤内异质性可能是导致治疗失败和肿瘤转移的潜在原因之一。ER、PR和HER2表达存在时空异质性,然而针对乳腺癌肝转移灶受体表达变化的数据有限。本研究主要探究了以下问题:乳腺癌肝转移灶ER、PR和HER2受体变化的发生率,其中包括HER2零表达、HER2低表达和HER2阳性之间的转换;乳腺癌肝转移受体变化的影响因素;乳腺癌肝转移受体变化对患者预后产生的影响。
本研究分析了353例乳腺癌肝转移患者的原发灶和配对肝转移灶受体表达情况,结果表明,原发灶中ER、PR的阳性率均显著高于转移灶,而HER2阳性率基本与转移灶一致。ER、PR和HER2在乳腺癌肝转移灶中的不一致率分别为19.5%、39.4%和4.8%,Kappa检验结果提示HER2在原发灶和肝转移灶之间的一致性强,ER一致性中等,PR一致性一般。一项针对乳腺癌原发灶和远处转移灶受体变化的meta分析[6]显示,受体状态的变化率在不同研究之间存在较大差异,且不同部位转移灶的受体状态变化率不同。例如,与肝转移灶相比,脑转移灶中的ER不一致率显著更高;而肝转移灶中的PR不一致率显著高于脑转移灶。该meta分析中,乳腺癌原发灶和配对肝转移灶中的ER、PR和HER2不一致率合并估计值分别为14.3%(95% CI:11.3 ~ 18.1)、47.0%(95% CI:41.0 ~ 53.0)和12.1%(95% CI:9.1 ~ 16.0)。本研究肝转移灶中的PR、HER2不一致率低于meta分析的合并估计率,推测部分原因可能为meta分析中各研究间异质性较大且纳入了部分小样本研究。与乳腺癌肝转移灶受体变化的回顾性研究[13-14]相比,本研究样本量更大,且提供了较新的数据(转移灶均于2013年后检测)。此外,本研究还观察到多次进行肝脏再活检的患者肝转移灶间受体状态不一致,提示再活检明确受体状态在乳腺癌诊治全程中的必要性。
本研究也探究了分子分型变化对乳腺癌肝转移患者生存的影响。在多因素分析中,肝转移灶转变为三阴性型的患者比肝转移灶维持HR+/HER2-型的患者具有显著更短的OS,这与先前的研究[15-17]结果一致。原发灶为三阴性型、转移灶转变为HR+/HER2-型的患者比转移灶仍为三阴性型的患者具有更长的OS,但差异无统计学意义,可能是由于该亚组的患者数量较少。肝转移灶分子分型相同的患者OS差异不显著。这一结果与Lin等[18]对乳腺癌骨转移受体变化预后分析的研究结果相互印证,提示转移灶分子分型发生变化的乳腺癌患者,其远期预后主要是由转移灶的分子分型决定,而不是由原发灶的分子分型决定的。
转移灶的受体变化对患者的临床管理具有较大影响。根据ESMO指南[3],当至少1次病理学检查结果中受体状态为阳性时,建议使用内分泌治疗和(或)抗HER2治疗。而ASCO指南[2]则推荐根据转移灶的病理学检查结果来指导治疗决策。本研究表明,部分患者的转移灶将重新获得HR阳性或HER2阳性的表型,对转移灶分子分型的重新评估使他们获得接受靶向治疗的机会,或改变原有的靶向治疗。此外,本研究分析提示,37.9%的HER2零表达患者在肝转移灶中转变为HER2低表达。从HER2零表达到HER2低表达的转变赋予了这些患者新的治疗契机,这再次说明了转移灶再活检的必要性。然而,对于受体状态发生改变的患者,目前仍缺乏数据表明治疗方案的改变将影响疾病转归[19],仍有待大样本量的研究来进一步评估治疗改变对生存的影响。
本研究探究了与ER、PR和HER2状态变化相关的因素,发现肝转移再活检前接受过内分泌治疗的患者更易出现PR状态的改变。本研究未发现与肝转移ER、HER2不一致显著相关的影响因素,而既往研究提示化疗[20]或内分泌治疗[21]与ER受体变化显著相关。转移灶中受体变化的机制尚不清楚,目前主要的观点包括肿瘤内异质性[22-23]、克隆演进[24]和治疗压力选择[25-26]。基因测序研究提示大部分病例中原发灶和转移灶、转移灶之间呈现密切的遗传相关性,但同时发现转移灶中也存在额外的突变,这导致了遗传的多样性。一项最新的对原发肿瘤和匹配转移瘤的全外显子测序分析[26]显示,未经治疗的转移瘤通常起源于原发肿瘤中的主要克隆,而经过药物治疗的转移瘤中往往存在转移瘤所特有的驱动突变,这主要是由于药物治疗的压力选择使得转移灶来源于原发肿瘤中的稀有克隆。因此,转移瘤所特有的驱动突变并非是肿瘤转移的驱动因素,而是与耐药相关。多克隆起源在未经治疗的转移瘤中比经治转移瘤更为普遍。上述证据都提示治疗压力能够重塑克隆演进过程[26]。此外,有研究[27]表明,ER具有降低肿瘤细胞侵袭性的生物学功能,而受体状态的改变可能与促进肿瘤侵袭或转移相关。受体状态的变化究竟是由于侵袭转移过程中肿瘤细胞的适应性改变,还是肿瘤细胞在治疗压力下克隆选择的结果,值得在未来进一步研究。
本研究也存在一定局限性。本研究为基于单中心的回顾性分析,无法避免研究人群选择偏倚的存在。尽管指南推荐对转移性乳腺癌患者常规进行转移灶再活检,但在真实世界中,并非所有肝转移患者都接受了肝脏病理学检查,根据患者的临床特征和肿瘤演进的表现怀疑受体发生转变的患者有更大的概率接受转移灶病理学检查。此外,本文未对所有患者的切片统一进行重新检测阅片。但需注意到的是,本文所有入组患者的肝转移病灶均经过复旦大学附属肿瘤医院病理科会诊;同时,根据最新版ASCO/CAP指南[11-12]的标准对原发灶和转移灶的受体状态进行了重新判读。因此,受体状态判读指南的更新对本文结果影响较小。最后,本研究未对后续系统治疗的变化进行分析,基于转移灶受体状态改变治疗方案能否改善患者预后这一问题仍有待进一步研究。
综上,本研究探讨了乳腺癌原发灶和肝转移灶之间ER、PR和HER2表达的异质性、影响因素及其远期预后影响,结果提示仅有PR状态改变受到内分泌治疗的影响;ER、HER2受体状态是否转变与患者是否为初治Ⅳ期无关,伴有肝转移的初治Ⅳ期患者同样有必要联合肝脏病灶穿刺病理学检查。患者的远期预后主要受肝转移灶的分子分型影响,而非原发灶。超过1/3的HER2零表达患者在肝转移中转变为HER2低表达,这部分患者有必要再行穿刺活检以获得新型ADC类药物治疗的机会。
利益冲突声明:所有作者均声明不存在利益冲突。

