癌胚抗原、组织多肽抗原、糖类抗原19-9、维生素K缺乏或拮抗剂-Ⅱ诱导蛋白、甲胎蛋白联合检测对原发性肝癌的诊断价值
张琳倩,彭艳芝,王佳宁,宁文君
西安大兴医院检验科,西安 710016
原发性肝癌是一种消化系统肿瘤,是临床常见的恶性肿瘤,好发于肝细胞、肝内胆管上皮细胞[1]。目前原发性肝癌的发病机制还未完全明确,既往研究发现,其主要与肝硬化、病毒性肝炎等因素有关。原发性肝癌病情发展较快,具有极高的病死率和复发率,预后较差,因此早期及时接受治疗十分关键,是提高临床疗效的关键。由于该病早期症状不明显,缺乏典型症状,因此诊断难度较高,大部分患者发现时已发展至中晚期,错过了最佳治疗时机。目前临床主要采用实验室和影像学检查对原发性肝癌患者进行早期筛查,其中血清癌胚抗原(carcinoembryonic antigen,CEA)、组织多肽抗原(tissue peptide antigen,TPA)、糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)、甲胎蛋白(alpha fetoprotein,AFP)、维生素K 缺乏或拮抗剂-Ⅱ诱导蛋白(protein induced by vitamin K absence or antagonist-Ⅱ,PIVKA-Ⅱ)等肿瘤标志物较为常用[2-3],然而单一指标检测的诊断效能并不是很高。临床研究发现,多项肿瘤标志物联合检测对原发性肝癌的诊断效能更高[4-5]。基于此,本研究探讨血清CEA、TPA、CA19-9、PIVKA-Ⅱ、AFP 联合检测对原发性肝癌的诊断价值,现报道如下。
1 资料与方法
1.1 一般资料
收集2019 年1 月至2020 年12 月西安大兴医院收治的疑似原发性肝癌患者的病历资料。纳入标准:①经病理检查确诊;②年龄≥18 岁;③临床资料完整。排除标准:①合并凝血功能障碍;②合并认知功能障碍;③合并其他系统恶性肿瘤;④有精神疾病史;⑤合并免疫系统疾病;⑥合并高度传染性疾病。依据纳入和排除标准,本研究共纳入83 例患者,其中,男43 例,女40 例;年龄18~72 岁,平均(42.61±10.58)岁。本研究经医院伦理委员会审批通过,所有患者均知情同意。
1.2 检测方法
所有患者入院时均抽取空腹外周静脉血5 ml,3500 r/min 离心5 min,取上层血清,应用全自动免疫分析仪检测血清CEA、TPA、CA19-9、AFP水平,应用全自动化学发光免疫分析仪检测血清PIVKA-Ⅱ水平,操作步骤均严格按照仪器说明书和试剂盒说明书进行。
1.3 观察指标
以手术病理结果作为金标准,分析血清CEA、TPA、CA19-9、PIVKA-Ⅱ、AFP 单独及联合检测对原发性肝癌的诊断效能,计算灵敏度、特异度、准确度和约登指数,联合诊断时5 项指标中至少2 项阳性即诊断为阳性。各指标正常参考值:CEA≤5 μg/L,TPA﹤55 U/L,CA19-9≤37 U/ml,PIVKA-Ⅱ﹤20 μg/L,AFP﹤25 μg/L。
比较不同临床分期原发性肝癌患者的血清CEA、TPA、CA19-9、PIVKA-Ⅱ、AFP 水平,分析血清CEA、TPA、CA19-9、PIVKA-Ⅱ、AFP 水平与原发性肝癌患者临床分期的相关性。原发性肝癌临床分期[6]:Ⅰ期,肿瘤直径﹤2 cm,可出现扩散至胆管和动静脉情况,但未侵犯至肝脏血管;Ⅱ期,肿瘤直径为2~5 cm,存在扩散至胆管和动静脉情况,但无淋巴结转移和远处转移;Ⅲ期,肿瘤直径﹥5 cm,可出现扩散至附近器官或腹膜情况,但未扩散至淋巴结,无远处转移;Ⅳ期,肿瘤出现肝内转移,或扩散到附近器官和淋巴结,或出现远处转移。
1.4 统计学方法
采用SPSS 20.0 软件对数据进行统计分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析;计数资料以例数和率(%)表示,组间比较采用χ2检验;采用Pearson相关分析法进行相关性分析。以P﹤0.05为差异有统计学意义。
2 结果
2.1 血清CEA、TPA、CA19-9、PIVKA-Ⅱ、AFP 单独及联合检测对原发性肝癌的诊断效能
经病理检查,83 例患者中,74 例阳性,9 例阴性。血清CEA、TPA、CA19-9、PIVKA-Ⅱ、AFP 联合检测诊断原发性肝癌的灵敏度、特异度、准确度及约登指数分别为95.95%、88.89%、95.18%、0.85,均高于各指标单独检测。(表1、表2)
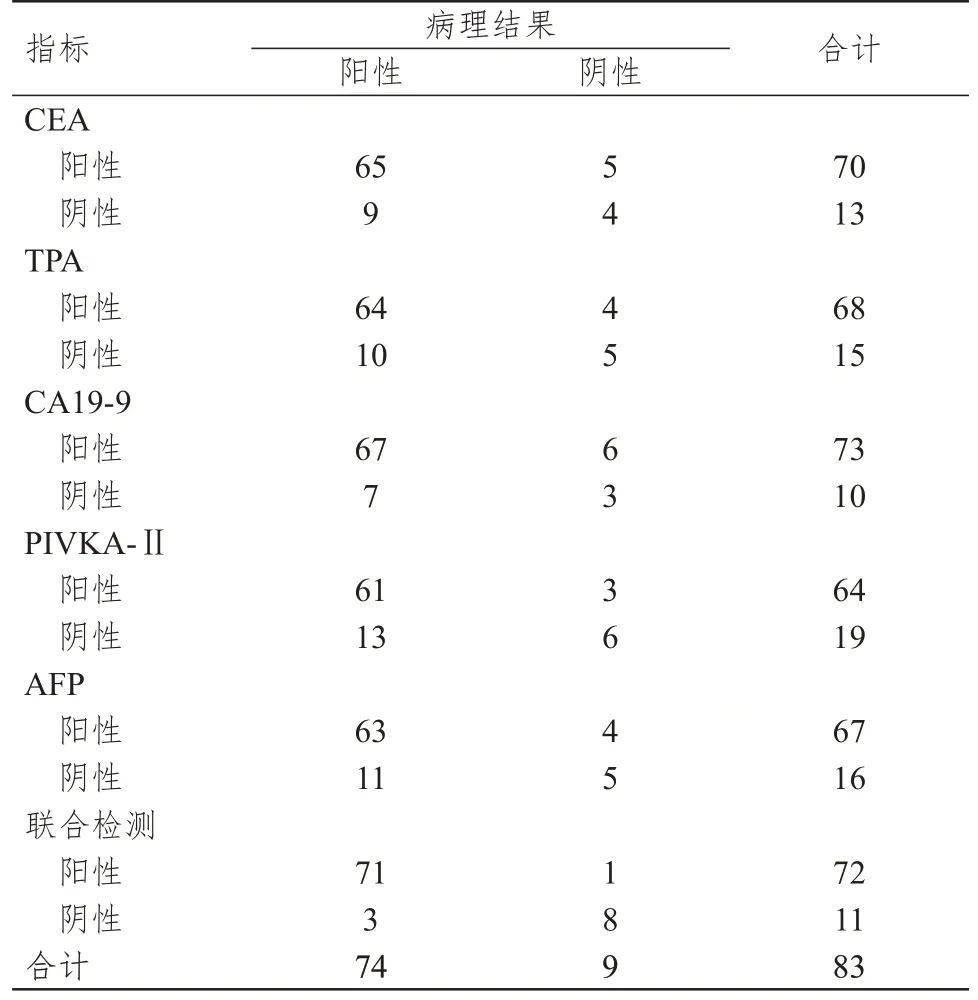
表1 血清CEA、TPA、CA19-9、PIVKA-Ⅱ、AFP 单独及联合检测诊断原发性肝癌的结果与病理结果的对照
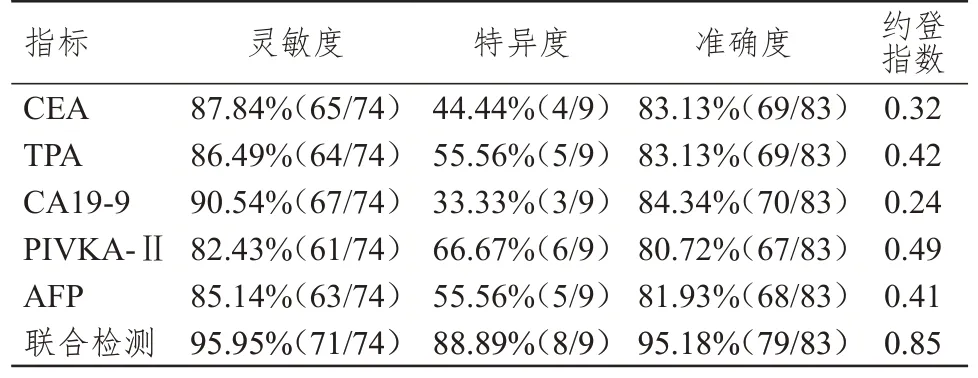
表2 血清CEA、TPA、CA19-9、PIVKA-Ⅱ、AFP 单独及联合检测对原发性肝癌的诊断效能
2.2 不同临床分期原发性肝癌患者血清CEA、TPA、CA19-9、PIVKA-Ⅱ、AFP 水平的比较
不同临床分期原发性肝癌患者的血清CEA、TPA、CA19-9、PIVKA-Ⅱ、AFP 水平比较,差异均有统计学意义(P﹤0.01);随着临床分期的升高,原发性肝癌患者的血清CEA、TPA、CA19-9、PIVKA-Ⅱ、AFP 水平均逐渐升高。(表3)
表3 不同临床分期原发性肝癌患者血清CEA、TPA、CA19-9、PIVKA-Ⅱ、AFP 水平的比较(±s)
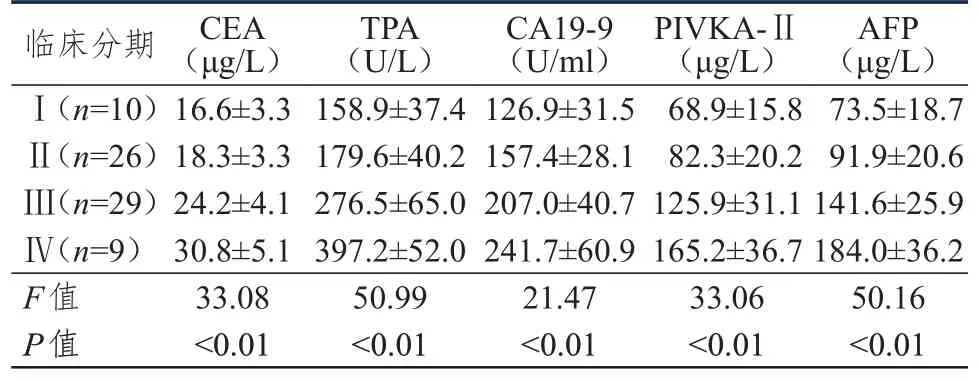
表3 不同临床分期原发性肝癌患者血清CEA、TPA、CA19-9、PIVKA-Ⅱ、AFP 水平的比较(±s)
临床分期Ⅰ(n=10)Ⅱ(n=26)Ⅲ(n=29)Ⅳ(n=9)F值CEA(μg/L)16.6±3.3 18.3±3.3 24.2±4.1 30.8±5.1 33.08 TPA(U/L)158.9±37.4 179.6±40.2 276.5±65.0 397.2±52.0 50.99 CA19-9(U/ml)126.9±31.5 157.4±28.1 207.0±40.7 241.7±60.9 21.47 PIVKA-Ⅱ(μg/L)68.9±15.8 82.3±20.2 125.9±31.1 165.2±36.7 33.06 AFP(μg/L)73.5±18.7 91.9±20.6 141.6±25.9 184.0±36.2 50.16 P值<0.01<0.01<0.01<0.01<0.01
2.3 血清CEA、TPA、CA19-9、PIVKA-Ⅱ、AFP 水平与原发性肝癌患者临床分期的相关性
相关性分析结果显示,血清CEA、TPA、CA19-9、PIVKA-Ⅱ、AFP 水平与原发性肝癌患者的临床分期均呈正相关(P﹤0.05)。(表4)
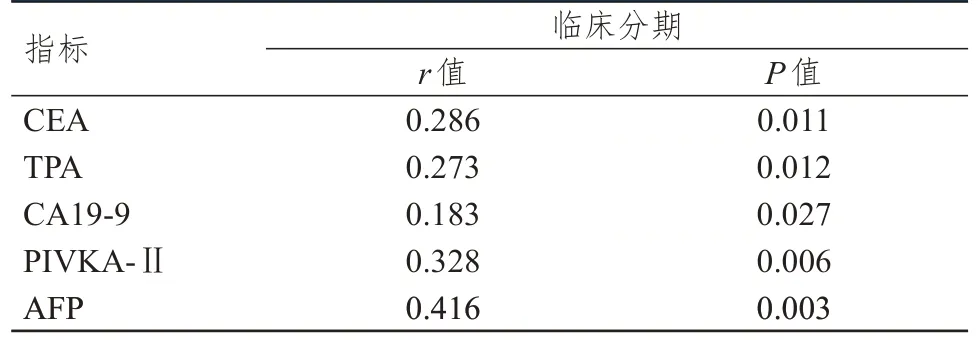
表4 血清CEA、TPA、CA19-9、PIVKA-Ⅱ、AFP 水平与原发性肝癌患者临床分期的相关性
3 讨论
原发性肝癌是对人体健康危害极大的恶性肿瘤,在中国,原发性肝癌的发病率居全部恶性肿瘤第4 位,病死率居全部恶性肿瘤第2 位[7]。肿瘤标志物检测是诊断原发性肝癌的常用实验室检测方式,其主要由人体内相关组织合成并分泌,与肿瘤的发生发展密切相关,一般主要存在于体液中,正常情况下水平极低,但发生恶变时会急剧升高,因此是恶性肿瘤的重要辅助诊断方式之一[8]。目前临床中往往只选择其中一项肿瘤标志物进行检测,但诊断效果不是很理想。冷俊和秦兵[9]的研究发现,多项肿瘤标志物联合检测会大大提升原发性肝癌临床诊断的准确度,减少漏诊和误诊情况。
CEA 是一种肿瘤相关抗原,属于酸性糖蛋白,具有细胞膜和人类胚胎抗原特性,最初从人体结肠和胚胎组织中提取出来,广泛存在于内胚层细胞分化而来的肿瘤细胞表面[10]。既往临床主要将CEA 作为特异性标志物用于结肠癌和直肠癌的早期诊断,经临床研究验证,除结肠癌和直肠癌外,其他消化系统肿瘤患者的CEA 水平也急剧上升,同时肺癌、乳腺癌等其他系统肿瘤患者也可出现CEA 水平升高,因此临床逐渐将该指标作为广谱肿瘤标志物,为肿瘤的临床诊断、病情监测提供参考。TPA 最初发现于肿瘤细胞培养液中,因其特异性不高导致临床推广性不高,但是随着近几年多项指标联合检测在临床上的推广,该指标也成为肿瘤标志物常规检测指标之一[11]。CA19-9 属于糖类抗原,是临床常用的肿瘤标志物之一,其主要分布于肿瘤细胞表面,是肿瘤细胞分泌的糖蛋白[12]。PIVKA-Ⅱ是诊断原发性肝癌的特异性肿瘤标志物之一,一般经肝脏合成和释放,异常升高主要是因为肝细胞癌细胞增殖,且其异常升高还会对谷氨酸造成影响,导致其无法进行羟化反应[13-16]。AFP是临床诊断原发性肝癌的特异性肿瘤标志物,也是一种糖蛋白,由肝细胞和卵黄囊合成分泌[17-18]。临床研究发现,AFP 在胎儿时期浓度较高,出生后随着月龄增加而逐渐降低,基本3 个月后低至正常水平,由于其基本被白蛋白替代,因此在血液中较难检出,在血液中含量极低[19]。AFP 在人体中具有多种重要的生理功能,如免疫抑制,对生长因子进行双向调节,参与T淋巴细胞诱导靶细胞凋亡等,同时与肝癌的发生发展密切相关,因此肝癌患者血液中的AFP 含量会急剧升高[20-22]。本研究通过对比血清CEA、TPA、CA19-9、PIVKA-Ⅱ、AFP 单独及联合检测对原发性肝癌的诊断效能发现,虽然单独诊断的准确度均达到80%以上,但联合检测的诊断效能更高,由此可见多项肿瘤标志物联合检测可为原发性肝癌的术前诊断提供依据。本研究还对不同临床分期原发性肝癌患者的血清CEA、TPA、CA19-9、PIVKA-Ⅱ、AFP 水平进行分析,结果显示,随着临床分期的升高,原发性肝癌患者的血清CEA、TPA、CA19-9、PIVKA-Ⅱ、AFP 水平均逐渐升高,且相关性分析发现,各指标与原发性肝癌患者的临床分期均呈正相关,可见血清CEA、TPA、CA19-9、PIVKA-Ⅱ、AFP 不仅可为原发性肝癌的临床诊断提供依据,还可作为监测病情进展的指标。
综上所述,血清CEA、TPA、CA19-9、PIVKA-Ⅱ、AFP 可作为临床诊断原发性肝癌和监测病情进展的客观实验室指标,单独检测的诊断效能一般,联合检测可提高诊断效能,更有利于原发性肝癌的早期检出。

