犬细小病毒吉林流行株的分离鉴定及VP2 基因的遗传进化分析
李紫仟,赵新宇,李向南,冯楚楚,李子树,蔡佳希,薛向红※
(1.中国农业科学院特产研究所,吉林 长春 130112;2.吉林省特种经济动物分子生物学重点实验室,吉林 长春 130112;3.吉林特研生物技术有限责任公司,吉林 长春 130112)
犬细小病毒病,又称犬传染性出血性肠炎,是由犬细小病毒(Canine parvovirus,CPV)引起的急性传染病,动物感染后临床表现为出血性肠炎、心肌炎、白细胞减少及脱水等[1],尤其幼犬消化道的感染最为严重[2],在20 世纪70 年代,美国首次发现细小病毒,随后其他国家内也陆续报道,该病毒传染性强,病死率高,对犬只的健康造成严重影响,给我国宠物饲养行业造成巨大的经济损失[3]。
CPV属于细小病毒科细小病毒属,病毒粒子呈12面体结构,且无囊膜,其直径约为25 nm[4]。CPV 基因组全长为5 233 bp,其中含盖了两个开放阅读框(ORF),分别由VP1、VP2 为主要成分的结构蛋白(又称衣壳蛋白)以及NS1、NS2 为主要成分的非结构蛋白组成。VP2蛋白是病毒衣壳的主要组成部分,占病毒衣壳的90%,具有良好的免疫原性,在病毒复制和感染过程中有着至关重要的作用;VP2 蛋白氨基酸位点的改变对病毒感染宿主的范围也有着重要的影响[5-7]。虽然CPV 是DNA 病毒,但其进化十分迅速,目前根据CPV VP2 基因的进化分为CPV-2a、CPV-2b、NewCPV-2a、NewCPV-2b、CPV-2c 等基因型,与原始CPV-2 型相比,新的基因型对宿主更具感染性,因此,新基因型已慢慢取代原有CPV-2型,在世界范围内大规模传播[8-10]。2010 年CPV-2c 在中国吉林省犬细小病毒2c型首次发现,随后一些研究人员在2014~2016年成功分离鉴定CPV-2c,并发现CPV-2c在传播的同时,VP2 基因产生新的突变[11-13],证明了CPV-2c 型在中国犬科动物的继续传播发展。
本试验从长春某动物医院3 只患细小病毒犬只的肠道内容物中,分离获得3 株犬细小病毒,并对其VP2基因进行遗传进化分析,以期了解长春市目前CPV的流行变化规律和分子特征,为更好地研究犬细小病毒以及该地区犬细小病毒的预防和治疗提供参考。
1 材料与方法
1.1 材料
1.1.1 病料 3 份犬细小病毒病料,来自吉林省长春市某动物医院。发病犬为3~5 月龄,临床表现为呕吐、腹泻和体温升高等,利用Anigen Rapid CPV Ag Test Kit 检测患病动物粪便拭子,结果为阳性。
1.1.2 细胞及试剂 猫肾传代细胞F81 株、CPV-VP2蛋白单克隆抗体由本实验室保存;胎牛血清、1640 细胞培养液、胰酶消化液、PBS 购自Gibco 公司;DNA Marke(rDL 2 000、DL 15 000)、DNA提取试剂盒、DNA凝胶回收试剂盒、pEASY-Blunt Cloning Kit、Trans1-T1 感受态细胞、TransStartFastPfu DNA Polymerase、EasyPurePlasmid MiniPrep Kit 等购自北京全式金生物技术有限公司;Goat Anti-Mouse IgG FITC 购自北京博奥森生物有限公司;引物由生工生物(上海)工程股份有限公司合成。
1.2 方法
1.2.1 病料处理 将采集粪便样品用PBS 按1:3 比例稀释,震荡混匀10 min,10 000 r/min,4℃离心30 min,吸取上清,加入等体积氯仿,震荡混匀15 min,12 000 r/min,4 ℃离心30 min,吸取上清使用0.22μm 滤膜过滤除菌后按4:1的比例添加双抗(Penicillin-Streptomycin),4 ℃过夜放置,80℃保存。
1.2.2 病料DNA 提取及PCR 鉴定:2021 年12 月分离的3 株病毒命名为CPV-JL21-L1、CPV-JL21-L2、CPV-JL21-L3,将处理好样品提取DNA,详细步骤参照DNA提取试剂盒说明书提取基因组,80℃保存留用。
PCR 鉴定反应体系(20μL):模板DNA 1μL、上游引物1μL、下游引物1μL、Tap 酶10μL、ddH2O7μL。PCR 反应程序:95 ℃预变性5 min;95 ℃变性20 s,48℃退火30 s,72 ℃延伸1 min,35 个循环;72 ℃延伸10 min,4 ℃保存。扩增产物进行琼脂糖凝胶电泳鉴定。
1.2.3 病毒分离培养 将生长良好的F81 细胞消化成悬液,按照体积比1:5 同步接种病料上清,另设正常细胞作为阴性对照,置于37 ℃、5% CO2细胞培养箱中培养。每天观察细胞生长以及病变情况,盲传3 代,若无细胞病变(Cytopathic effect,CPE)弃掉,产生CPE的细胞继续传代培养,当细胞出现80% CPE 时,反复冻融3 次后,收集病毒液,80 ℃保存。
1.2.4 血凝实验(HA)使用96 孔V型血凝板对CPV阳性第5 代细胞培养物上清液进行HA 测定,每孔先加入25μL PBS 缓冲液,第1 排孔加入25μL 抗原,吹打混匀后依次倍比稀释至11 排孔,弃掉25μL,第12孔为红细胞对照,同时设置3 个重复及阳性对照。每孔补充25μLPBS 后加入50μL1%猪红细胞悬液,置于微量振荡器震荡摇匀1 min,4 ℃静置40~60 min,判定结果。
1.2.5 病毒TCID50测定 将F81 细胞制备成2×105个/mL的细胞悬液,每孔100μL 均匀添加至96 孔细胞培养板中,将第5 代病毒液在无血清1640 培养基中10 倍倍比稀释至第11 个稀释梯度,设置正常细胞对照组,每个稀释度做4 个重复,按每个稀释度每孔100μL同步接入96 孔细胞培养板中,置于35 ℃5% CO2培养箱中培养,观察记录3~5 d 内的细胞病变情况,按Reed-Muench 法计算病毒TCID50。
1.2.6 间接免疫荧光(IFA)将F81 细胞均匀铺在96孔板中,按5%体积同步接种分离株病毒,置于35℃5% CO2培养箱中培养48 h,弃去上清,PBST 清洗3 次,每次3 min;每孔添加预冷80%丙酮固定30~45 min,PBST 清洗3 次;使用5% BSA 封闭1h 后弃液,PBST 清洗5 次;加入一抗后置于37 ℃恒温培养箱作用1 h,PBST 清洗5 次;加入FITC 标记的二抗,避光置于37℃恒温培养箱作用1 h,PBST清洗5 次,将清洗后96 孔细胞培养板放置荧光显微镜下观察,同时设正常细胞作为阴性对照。
1.2.7 病毒电镜观察 病毒扩增至30 mL,12 000 r/min离心15 min,使用0.22μm 滤膜过滤除去细胞碎片,送至电镜观察。
1.2.8 VP2 基因扩增 根据GenBank 收录的CPV-2株(GenBank 登录号为M38245)基因序列,针对病毒VP2 基因区域,使用Primer 5.0 软件设计引物(表1)扩增VP2 基因全长。
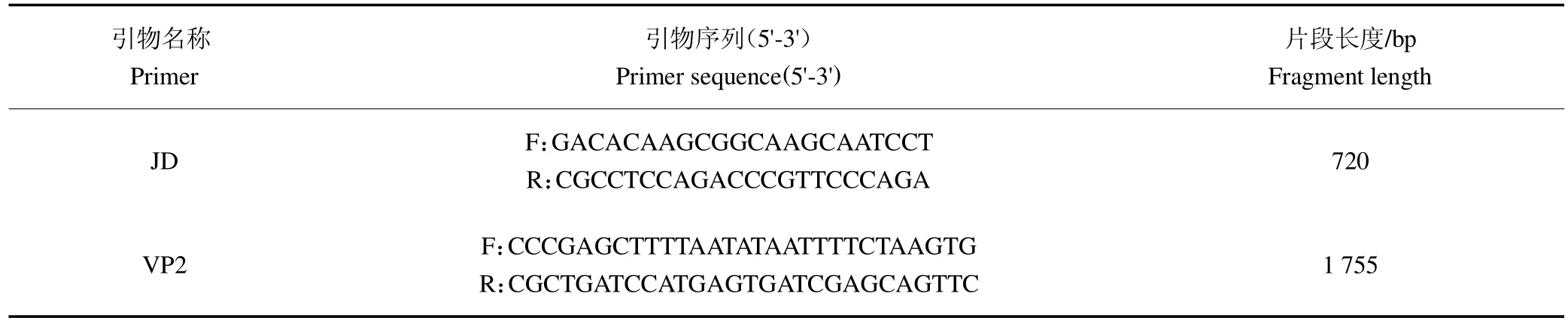
表1 引物序列Table 1 Primer Sequence
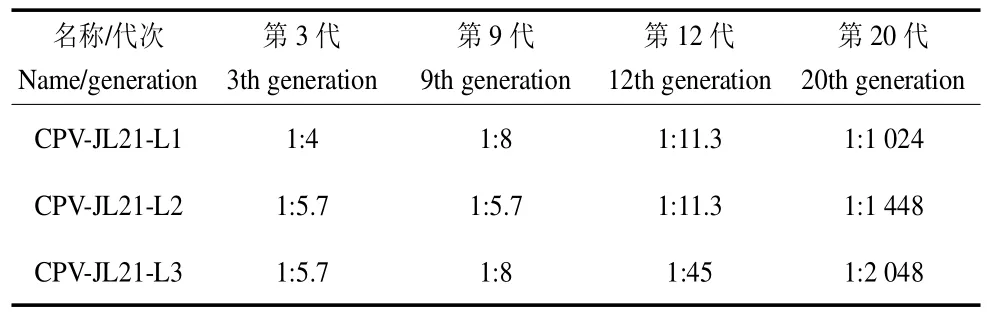
表2 分离CPV 的HA 效价测定结果Table 2 Separate CPV hemagglutination assay results
PCR 反应体系(50μL):上游引物1μL、下游引物1μL、Tap-Buffer 10μL、dNTPs 4μL、DNA Polymerase 1μL、模板DNA 3μL、ddH2O 30μL。PCR 反应程序:95 ℃预变性5 min;95 ℃变性20 s,52 ℃退火30 s,72 ℃延伸1 min,35 个循环;72 ℃延伸10 min,4 ℃保存。扩增产物进行琼脂糖凝胶电泳,使用胶回收试剂盒进行目的基因纯化回收。
1.2.9 VP2 基因链接转化及重组阳性质粒鉴定 将纯化后的产物链接到pEASY-Blunt 载体上,转化至Trans1-T1 感受态细胞,涂于含Amp+琼脂培养板上,37 ℃过夜培养,挑取单克隆菌落至含有5mL LB 培养液的试管中,200 rpm 37℃过夜培养,并提取质粒,使用限制性内切酶HindIII 和XhoI 进行双酶切鉴定,鉴定正确质粒送往生工生物(上海)工程股份有限公司测序。
1.2.10 序列测定与分析 利用DNASTAR 软件对基因组序列进行拼接,截取VP2 基因与GenBank 数据库中VP2 基因使用MEGA7.0 构建系统发育树,使用MegAlign软件分析VP2 蛋白氨基酸位点的变异情况。
2 结果
2.1 PCR鉴定
PCR 扩增产物经1%琼脂糖凝胶电泳检测,1、2、3 号样品观察到大约720 bp目的条带,与4 号阳性对照结果相同,见图1。
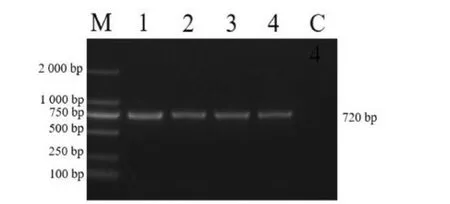
图1 病毒PCR 鉴定结果Fig.1 PCR result of virus
2.2 病毒分离
将病料样品分别接种至单层培养的F81 细胞,在接种后48~72 h左右呈现出不同程度的圆缩、聚集、拉网样病变,对照组细胞轮廓清晰,表现正常,见图2。

图2 CPV 感染F81 细胞和正常的F81 细胞Fig.2 F81 cell infected with CPV and Healthy F81 cell
2.3 HA检测结果
采用血凝实验对分离株的3、9、12、20 代病毒进行血凝效价检测,结果显示,分离的3 株病毒第20 代血凝效价均保持在210~211。
2.4 TCID50 检测结果
对培养出第5、20 代毒株进行TCID50测定,根据Reed Muench 法计算,测得第5 代病毒含量在TCID50值为10-4.5~10-5.5/0.1 mL,第20 代病毒含量在TCID50值为10-7~10-7.5/0.1 mL。
2.5 间接免疫荧光结果
荧光显微镜下,正常细胞对照未见特异性荧光;3株CPV分离毒株可见明显的特异性绿色荧光,如图3。
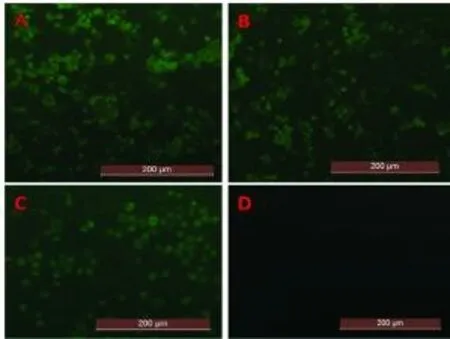
图3 间接免疫荧光结果Fig.3 The results of IFA
2.6 电镜形态学观察
病毒液浓缩后,置于电镜下观察,3 株CPV 分离株均可观察到直径为20~25 nm 无囊膜、呈立体对称形态,与细小病毒的形态大小特征相符,见图4。
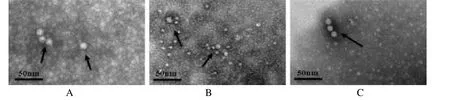
图4 病毒粒子电镜下形态观察Fig.4 Electron microscopy images of virus particles
2.7 分离株VP2基因扩增及酶切鉴定结果
分离株VP2 PCR 扩增产物经1%琼脂糖凝胶电泳检测,1、2、3 号样品观察到大约1 755 bp目的条带,与预期结果相符,见图5;VP2 回收基因与Blunt 载体链接,酶切鉴定与预期目的片段大小相符,见图6。
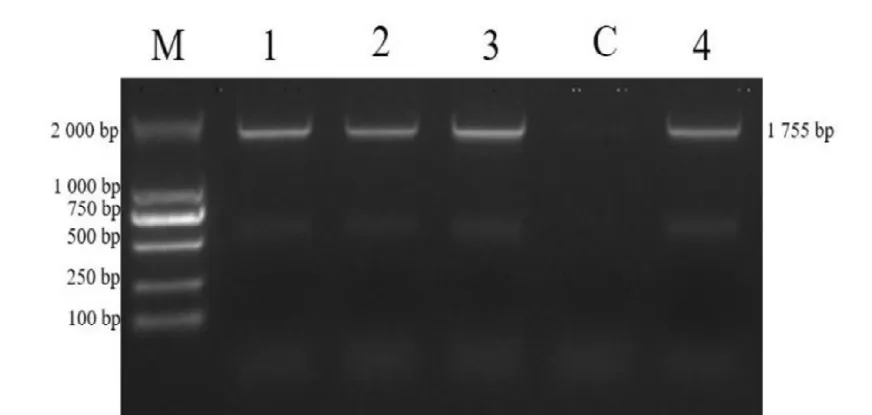
图5 CPV μgene
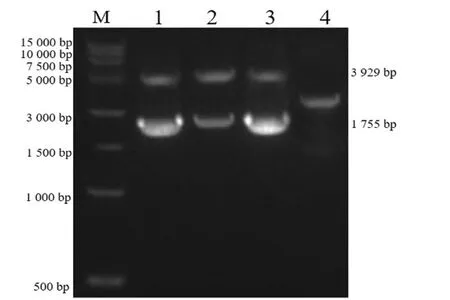
图6 pEASY-Blunt-VP2 重组质粒酶切鉴定结果Fig.6 The identification of the pEASY-Blunt-VP2 vector by restriction endonuclease digestion
2.8 VP2基因进化分析及同源性结果
使用MEGA7.0 软件,将CPV-JL21-L1、CPV-JL21-L2、CPV-JL21-L3 株犬细小病毒与GenBank数据库中15 株国内和8 株国外CPV 的VP2 基因进行比对,绘制系统进化树。结果显示,CPV-JL21-L1、CPV-JL21-L2、CPV-JL21-L3 与国内江苏、北京地区分离得到的CPV-2c 亚型毒株遗传关系较近,同属于CPV-2c 亚型毒株,与3 株疫苗株(DM381006.1、EU659116.1、EU914139.1)遗传关系较远(图7)。

图7 CPV VP2 核苷酸序列遗传进化树Fig.7 The nucleotide sequence genetic tree analysis of VP2 gene of CPV
2.9 同源性分析
将此次分离得到的3 株CPV 毒株与GenBank上已发表的数据库中15 株国内和8 株国外CPV的VP2基因进行比对,结果显示,3 株CPV 毒株之间的核苷酸同源性都在99.8%,与3 株疫苗株DM381006.1、EU659116.1、EU914139.1 的同源性为98.6%~99.0%,与其他参考毒株同源性为98.6%~99.9%(图8)。
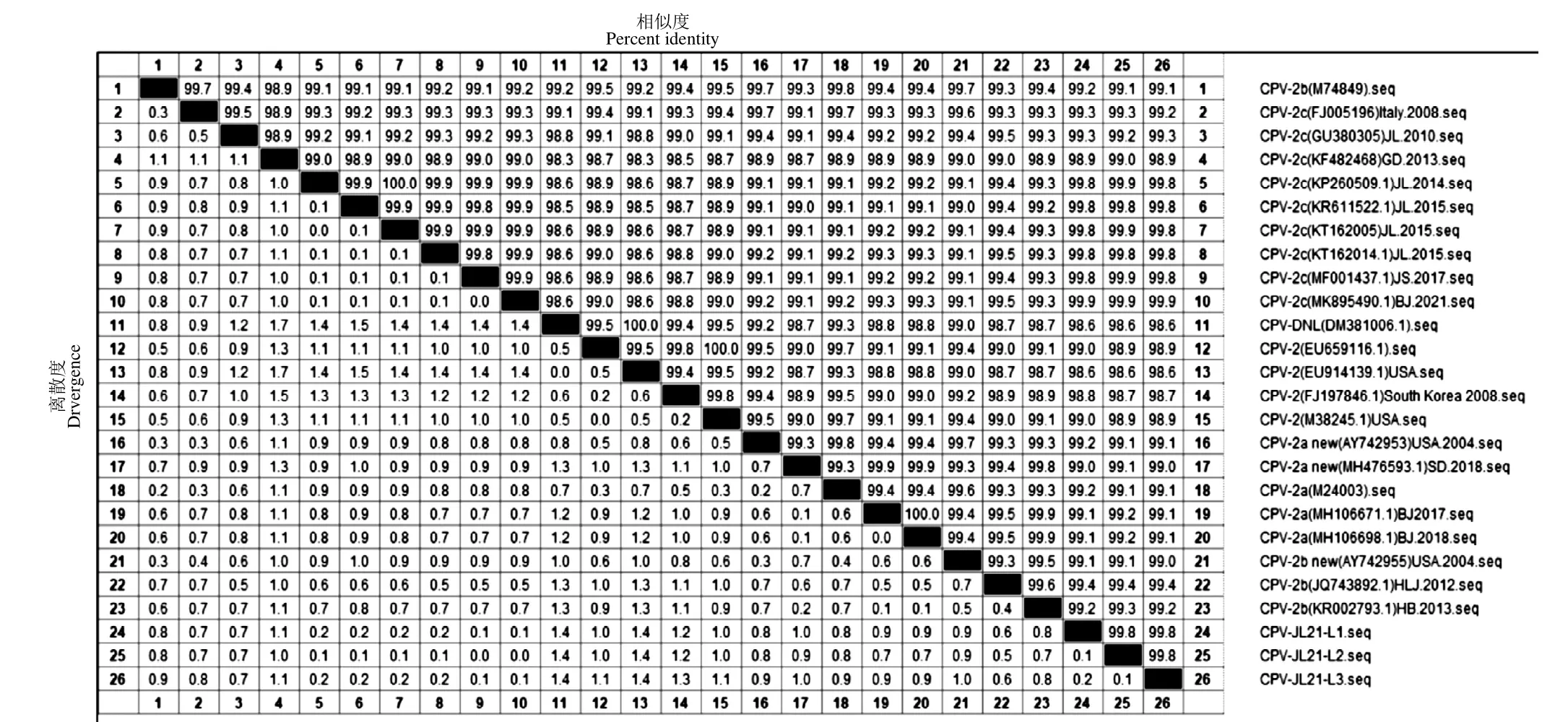
图8 CPV 毒株μgene of the CPV isolate
2.10 氨基酸变异分析
CPV VP2 基因共编码584 个氨基酸,通过核苷酸序列翻译分离的3 株病毒,并与GenBank 数据库中23 株具有代表性CPV 毒株VP2 基因所推导的氨基酸序列,运用DNASTAR 中Clustal W 方法进行相互对比,见表3。由表3 可知,本试验中分离的3 株病毒株属于CPV-2c 亚型,与GenBank 中参考CPV-2c 氨基酸序列相比,分离株CPV-JL21-L1、CPV-JL21-L3 氨基酸序列80L、101T、267Y、297A、300G、324I、375D、426E、555V 位点与国内流行株相同,CPV-JL21-L2 与国内参考氨基酸序列相比,有Y267F 一处突变,总体来看,国外分离毒株CPV-2c 亚型在267 位多数为F,国内多为Y。
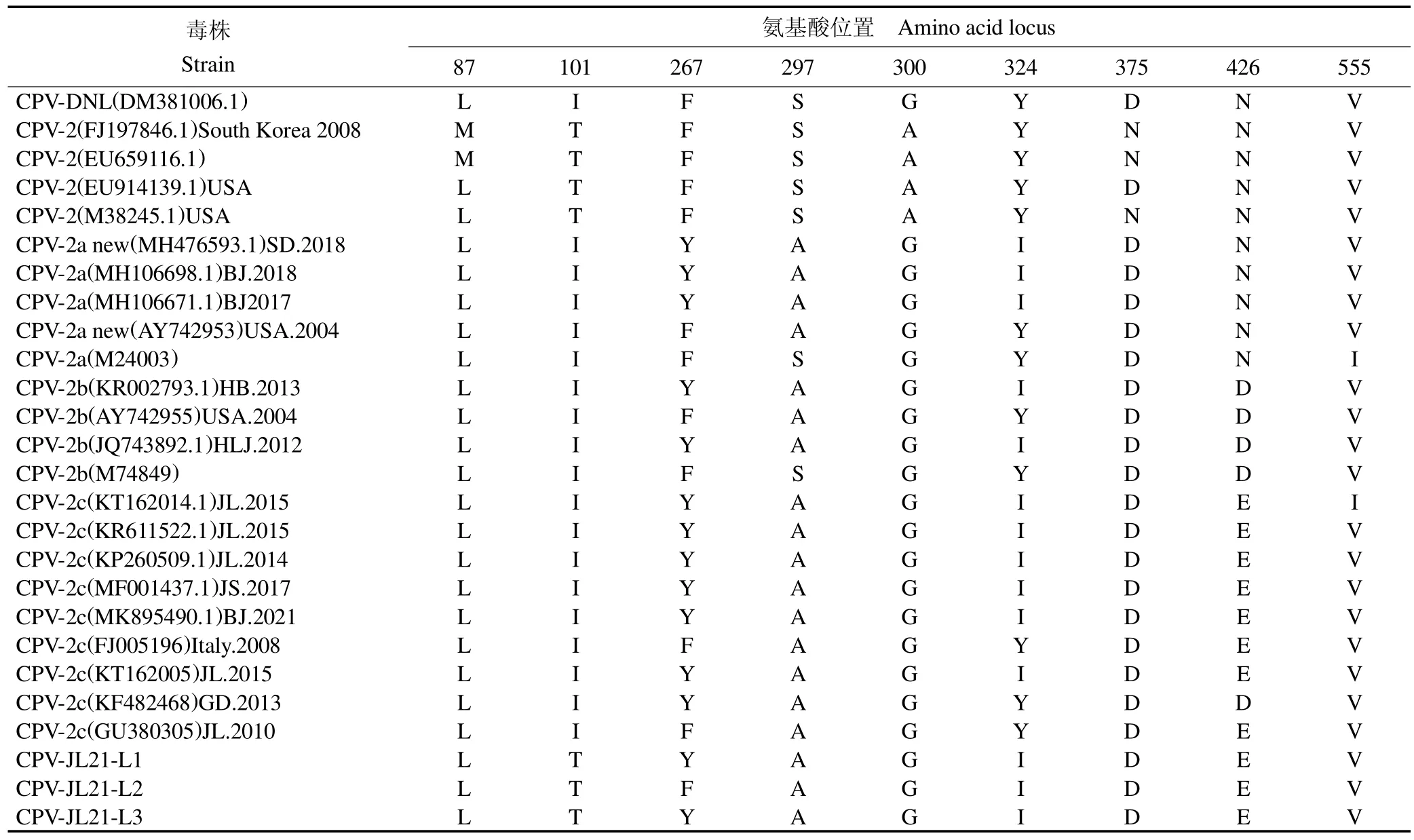
表3 CPV VP2 蛋白关键氨基酸位点比较Table 3 Comparison of key amino acid sites of CPV VP2 protein
3 讨论
随着宠物行业的快速发展,宠物犬的养殖数量日益增加,犬细小病毒性腹泻是犬科动物最严重传染病之一,近些年来一直倍受关注。自细小病毒发现以来,我国每年因感染CPV死亡的犬科动物逐年上升,CPV的主要宿主为幼犬,幼犬感染CPV 后,发病率可达90%,死亡率为35%左右[14],严重影响了养犬业的健康发展[15]。因此,CPV 的流行病学调查以及病毒遗传进化方向的研究,对CPV 的防控以及CPV 疫苗的研发都有着重要意义。
本试验从患病犬粪便中成功分离3 株CPV毒株,经PCR 实验、细胞病变、电镜观察、血凝实验、间接免疫荧光以及VP2 基因测序分析,证明分离毒株确为CPV,将其命名为CPV-JL21-L1、CPV-JL21-L2、CPVJL21-L3,通过与GenBank 中国内外23 株CPV 流行毒株VP2参考序列同源性及进化分析,结果显示,CPVJL21-L1、CPV-JL21-L2、CPV-JL21-L3 分离株均为CPV-2c 亚型,分离株CPV-JL21-L1、PV-JL-L3 与CPV-2c(MK895490.1)BJ、CPV-2c(MF001437.1)JS、CPV-2c (KP260509.1) JL、CPV-2c (KR611522.1) JL、CPV-2c (KT162014.1) JL 株的关键氨基酸位点一致,CPV-JL21-L2 仅出现Y267F不一致。VP2 是犬细小病毒的主要抗原决定簇,与宿主免疫反应有关,VP2 基因的少量突变可能导致致病性的改变[16]。Phe267Tyr突变存在于吉林省早期新CPV-2a 分离株2010(GU380303)中,随后于2013 也有相关报道。值得关注的是,VP2 蛋白的267 位点氨基酸是G 和H 链之间GHloop 区的组成部分,且位于衣壳面[17,18]。一些研究表明,目前商品化疫苗都是CPV-2 和CPV-2b型疫苗,对CPV-2c型毒株不能起到很好的保护效率[19]。JIANG等[20]对CPV 遗传进化的研究中指出,国内的CPV-2c型正以其特有的方向遗传进化。因此,国内CPV 267位点氨基酸取代可能导致其抗原性和免疫原性的改变,还需要进一步的研究来证实。
综上所述,本研究从吉林省长春地区某动物医院患病犬粪便样品中分离得到3 株CPV-2c 亚型毒株,与目前国内流行毒株VP2 基因有较高的同源性,与近几年吉林省内CPV-2c 亚型发病和检出率结果大致相同,因此,应该加强对东北地区CPV-2c基因型的监测,同时本研究结果为了解长春地区CPV 遗传变化及开发CPV 新型疫苗提供了参考。

