西洋参果肉提取物对UVB 辐射HaCaT 细胞损伤保护作用
郝岩,王英平,刘继玲,金银萍※
(1.中国农业科学院特产研究所,吉林 长春 130112;2.吉林农业大学中药材学院,吉林 长春 130118;3.吉林省蛟河市木材检查总站,吉林 蛟河 132500)
西洋参(Panax quinquefolium L.)是五加科人参属多年生草本植物。传统药用部位为干燥的根[1],近年来,西洋参地上部位如茎叶、花和果肉越来越受到研究者的关注[2-5],西洋参茎叶总皂苷已作为药品(国药准字号Z20030072)应用于临床。随着研究的深入,西洋参果肉的研究逐渐增多,与根部和茎叶提取物相比,西洋参果肉中的拟人参皂苷F11、人参皂苷Rb2、人参皂苷Rb3及人参皂苷Rg3含量相对较高[5,6],并具有抗氧化、保护心血管系统、影响代谢、肝肾保护作用和抗肿瘤等作用[7],但是对于西洋参果肉的紫外防护作用的研究较少。
皮肤衰老分为内源性和外源性。内源性即身体内部的自然衰老;外源性即外界因素带来的影响,紫外辐射是占比最大的因素,其中又以中波紫外线(UVB)为主,又称光老化,UVB可以穿透皮肤进入结缔组织,损伤弹力纤维和胶原纤维,使脂肪细胞减少,加速皮肤角化,也会触发活性氧(ROS)的产生诱发皮肤炎症和各种皮肤损伤[7]。皮肤最外层即表皮是直接与紫外线接触的位置,HaCaT 细胞为永生化角质细胞,可以作为模拟人体受紫外辐射的实验材料。市面上的化学防晒品经常出现刺激皮肤从而导致皮肤过敏的现象,故而寻找天然无害无刺激的防晒产品成为主流趋势[23],故本试验以西洋参果肉提取物为研究对象,通过建立UVB 辐射HaCaT 细胞模型,探讨其各组分对UVB 辐射HaCaT 细胞损伤的保护作用,并初步探讨其保护机制。
1 材料与仪器
1.1 试剂与材料
甲醇、正丁醇和乙酸乙酯均为分析纯;AB-8 大孔树脂购自沧州宝恩吸附材料科技有限公司;HacaT 细胞购自上海川翔生物科技发展有限公司;RPMI 1640培养基购自Gibco 公司;胰蛋白酶购自HyClone 公司;噻唑蓝、DPPH 购自Sigma 公司;胎牛血清购自Clack 公司;RIAP 裂解液购自Thermo 公司;总抗氧化能力检测试剂盒(ABTS法)购自碧云天生物技术研究所;SOD 试剂盒、GSH 试剂盒和MDA 试剂盒购自南京建成生物工程研究所。
西洋参果采自吉林市左家镇中国农业科学院特产研究所药用植物资源圃,经许世泉研究员鉴定为五加科植物4 年生西洋参(Panax quinquefolium L.)的果实,去籽后将样品用蒸馏水洗净,用烘箱40 ℃烘干,研磨后过100 目筛,备用。
1.2 仪器
离子肼-轨道阱-四级杆三合一液相色谱质谱联用仪(购自Thermo 公司),电子天平(CPA225D,购自德国Satorius 公司);数控超声波清洗器(KQ-500DE型,购自昆山市超声仪器有限公司);酶标仪(ST-360,购自美国Biotek Epoch 公司);分液漏斗、冻干机(FDU-2100,购自日本Eyela 公司)、离心机(Allegra X-30R centrifuge,购自美国贝克曼库尔特公司);二氧化碳培养箱(BB150,购自美国Thermo Scientific 公司)。
2 试验方法
2.1 样品前处理
2.1.1 样本提取 精密称取西洋参果肉200.00 g 至2 000 mL 烧杯中,以料液比1:8 精密加入80%甲醇,超声提取(500 W,40 kHz)3 次,每次30 min,过滤后合并滤液,备用。
2.1.2 样品制备 西洋参果肉提取物经适量的水分散,依次经过乙酸乙酯(V/V 1:1)、水饱和正丁醇(V/V 1:1)萃取3 次,得到乙酸乙酯层、水饱和正丁醇层。水层上AB-8 大孔树脂,蒸馏水冲洗弃去后95%乙醇洗脱,乙酸乙酯层、水饱和正丁醇层、水层减压浓缩,浓缩液经冷冻至干后备用。
2.2 DPPH法测定样品抗氧化能力
精密称取DPPH 粉末5.0 mg,80%乙醇溶解并定容至100 mL 容量瓶中,避光备用,将样品溶解并稀释为不同质量浓度的待测液,吸取待测液0.1mL及3.9mL的DPPH 溶液,加入到5 mL 具塞试管中,室温摇匀,避光静置90 min 后取200μL 于96 孔板中,重复3次,517 nm 处测定其吸光度Abs1,计算公式:
式中:Abs0为空白对照,Abs1为待测液与DPPH混合溶液吸光值。
用IC50表示清除DPPH 的能力。
2.3 ABTS法测定样品总抗氧化能力
根据ABTS 试剂盒说明书精密称取样品并溶解,取10μL 置于96 孔酶标板上,以50%乙醇为空白吸收,加入工作液。于754 nm 处进行测定吸收值,代入回归方程计算[8]。
2.4 HaCaT细胞培养
将HaCaT 细胞置于含10%小牛血清培养基,在37 ℃、5% CO2细胞培养箱中培养,取处于对数生长期细胞,用含0.02% EDTA 的0.5% 胰酶消化,以2×105个/mL 浓度细胞定量铺于96 孔板中,培养24 h备用。以6×105个/mL 浓度细胞定量铺于6 孔板中,培养24 h 备用。
2.5 MTT检测HaCaT 细胞存活率
试验分为空白对照组,药物处理组,每组至少5个复孔。筛选样本无细胞毒性浓度。空白对照组给予无血清培养基,水饱和正丁醇萃取层设为4 个剂量(300μL 上述浓度组分,培养24 h 后,加入20μL含5% MTT 溶液,避光培养4 h 后弃上清,每孔加入150μL DMSO,低速摇动10 min 后于490 nm 处测定吸光值。通过公式计算细胞存活率。
2.6 不同浓度样品对损伤细胞的保护作用
取处于对数生长期的细胞接种于96 孔板上,密度同上。试验分为空白对照组、UVB 辐射模型组、药物处理组,以无血清培养基作为空白对照,模型组给予30 mj/cm2辐射剂量[24],药物处理组加入安全剂量浓度水饱和正丁醇萃取层(200μg/mL、500μg/mL、800μg/mL、900μg/mL 和1000μg/mL)、乙酸乙酯萃取层(50μg/mL、100μg/mL、125μg/mL、150μg/mL、175μg/mL、200μg/mL和250μL 含5% MTT 溶液,避光培养4 h 后弃上清,每孔加入150μL DMSO,低速摇动10 min 后于490 nm 处测定吸光值。通过公式计算细胞存活率。
2.7 不同浓度样品对损伤细胞MDA、SOD和GSH的影响
取培养于6 孔板细胞的空白对照组、UVB 辐射模型组[8]、药物处理组的HaCaT细胞(处理方式同上),按照MDA、SOD 和GSH 检测试剂盒说明进行操作。
2.8 统计学分析
2.9 UPLC-MS分析样品皂苷含量
2.9.1 色谱条件 采用HypersilGlod Vanquish UPLC(100 mm 2.1 mm,1.9μm;Thermo,USA)色谱柱;流动相:乙腈(A)和0.1%甲酸水(B)溶液,流速为0.30 mL/min,梯度洗脱程序为:0~34 min,15%~55% A;34~35 min,55%~98% A;35~36 min,98% A,36~37 min,98%~15% A,37~40 min,15% A,柱温35 ℃。
2.9.2 质谱条件 最佳离子源参数:喷雾电压:2.7 kV;鞘层气体流量:40 Arb;辅助气体流量:5 Arb;离子转移管温度:320 ℃;汽化器温度:320 ℃。在负离子模式下,以60 000 的分辨率从150~1 500 m/z 收集全扫描质谱数据。
3 结果与分析
3.1 样品清除DPPH自由基能力测定
DPPH 法测定各组分抗氧化能力,得到标准曲线与IC50值,见表1,从回归方程所得各组分IC50值从小到大依次为Vc <水层<乙酸乙酯萃取层<水饱和正丁醇萃取层,明显看出3 个组分中水层抗氧化能力最强,乙酸乙酯层次之,且清除DPPH能力均小于Vc,但差别并不明显。
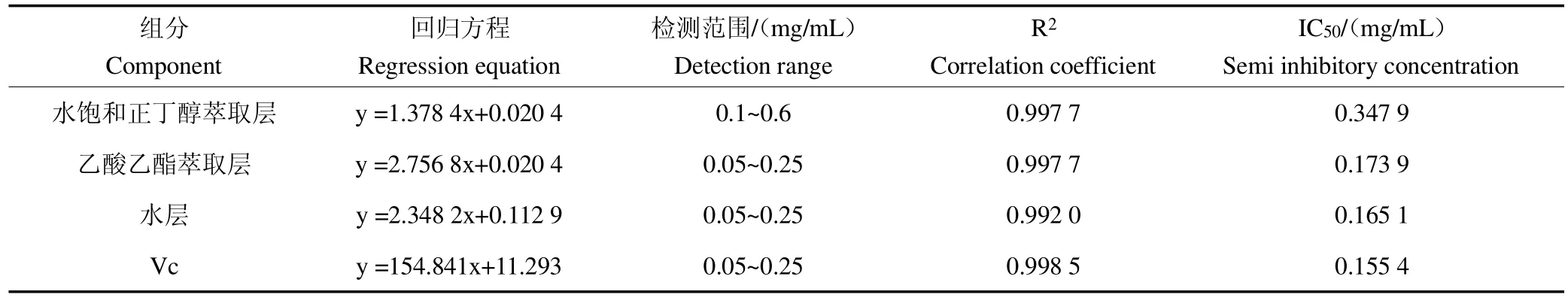
表1 西洋参果肉各组分对DPPH 清除作用Table 1 The scavenging effect of components of American ginseng berry on DPPH
3.2 ABTS法测定样品总抗氧化能力
采用Trolox 作为标准品进行总抗氧化能力检测,将各组分样品做适当稀释,得到标准曲线y=1.365 3x+0.043 6(0.5~1.5 mM,R2=0.997 4),结果显示,西洋参果肉总抗氧化能力的大小顺序为:乙酸乙酯萃取层(4.649)>水饱和正丁醇萃取层(1.346)>Vc(1.000)>水层(0.654)。乙酸乙酯萃取层的抗氧化能力与其他组分相比,具有极显著差异(P<0.01),且与水饱和正丁醇萃取层效果皆强于Vc。
3.3 细胞增殖检测
3.3.1 不同浓度样品对细胞活性影响 采用MTT 法检测不同浓度西洋参果肉各组分对HaCaT 细胞生长活性的影响(如图1),结果发现,水饱和正丁醇萃取层浓度在1 000μg/mL、乙酸乙酯萃取层浓度在250μg/mL、水层浓度在5μg/mL以内没有细胞毒性,并有促进细胞生长的作用。相对而言,水层细胞毒性略高于乙酸乙酯萃取层以及水饱和正丁醇萃取层,因此不做进一步研究。
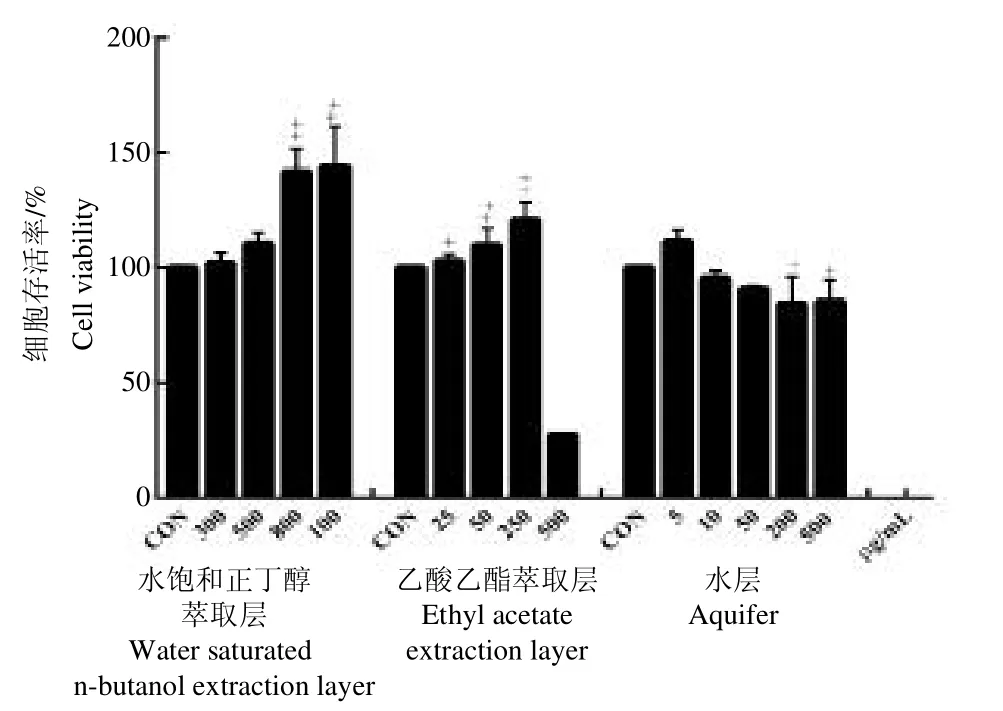
图1 西洋参果肉各组分对细胞生长影响Fig.1 Effects of different components of American ginseng berry on cell growth
3.3.2 不同浓度样品对损伤细胞的保护作用 根据筛选得到的西洋参果肉各组分的安全剂量范围,水饱和正丁醇萃取层设定4 个剂量组,乙酸乙酯萃取层设定6 个剂量组,预处理24 h 后采用MTT 法检测不同剂量组对于UVB 辐射HaCaT 细胞保护作用,结果显示,水饱和正丁醇萃取层在500~1000μg/mL、乙酸乙酯萃取层在50~125μg/mL 之间时对UVB 损伤的HaCaT细胞均有一定保护作用,且呈现浓度依赖性,但乙酸乙酯萃取层伴随浓度继续增加,细胞出现凋亡甚至死亡现象,存活率下降,两组与模型组比较有极显著差异(P<0.01),且乙酸乙酯萃取层细胞增殖效果比水饱和正丁醇萃取层更加明显,并在125μg/mL浓度效果最好,见图2。
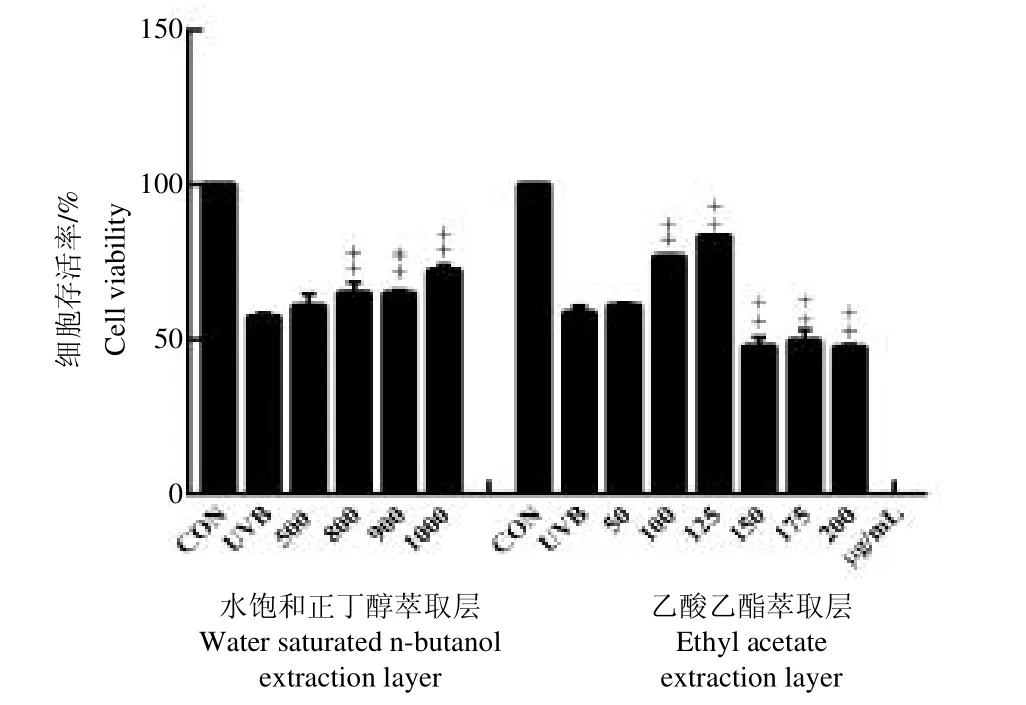
图2 不同浓度西洋参果肉各组分对UVB 辐射HaCaT 细胞保护作用(n=6,)Fig.2 Protective effects of different concentrations of American ginseng berry components on HaCaT cells irradiated by UVB(n=6,)
3.3.3 不同浓度样品对损伤细胞MDA、SOD 和GSH的影响 用UVB 辐射后HaCaT 细胞与空白组相比,脂质氧化物MDA 增加37%左右,抗氧化酶SOD 降低51%左右,GSH降低65%左右;用药物乙酸乙酯萃取层、水饱和正丁醇萃取层安全剂量浓度处理过后,明显减少MDA 生成,增加了SOD 与GSH 的生成,提高了细胞活力。其中尤以125μg/mL 乙酸乙酯层最为显著,与UVB 辐射组对比,有效减少MDA 生成量51%左右,有效增加SOD 量1.85 倍左右,GSH 增加量在1.99 倍左右(P <0.01),见表2。
表2 乙酸乙酯萃取层、水饱和正丁醇萃取层对HaCaT 细胞MDA、SOD 和GSH 的影响(n=3,)Table 2 Effects of ethyl acetate extraction layer and water saturated n-butanol extraction layer on MDA,SOD and GSH in HaCaT cells(n=3,)
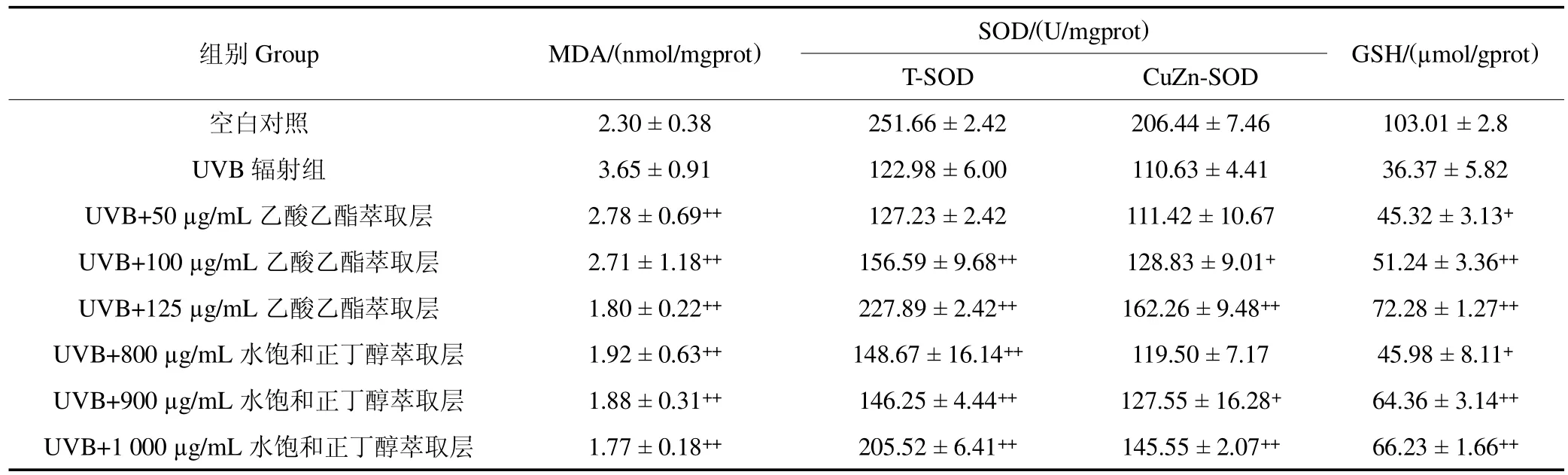
表2 乙酸乙酯萃取层、水饱和正丁醇萃取层对HaCaT 细胞MDA、SOD 和GSH 的影响(n=3,)Table 2 Effects of ethyl acetate extraction layer and water saturated n-butanol extraction layer on MDA,SOD and GSH in HaCaT cells(n=3,)
注:与UVB 辐射处理组比较,+P <0.05;++P <0.01。Note:Compared with the UVB radiation treatment group,+P <0.05;++P <0.01.
3.4 UPLC-MS检测样品皂苷含量
试验结果表明,西洋参果肉的乙酸乙酯萃取层具有更好的抗辐射效果,为探讨其活性成分,利用超高压液相色谱质谱联用仪测定西洋参果肉各组分之间的成分差异。按照“2.9”项下色谱条件进行检测分析,如图3 所示,乙酸乙酯萃取层与其他两个组分间成分差异较大,通过离子流图的对比分析,初步推断活性成分可能与峰1~6 存在关联,其中峰1、5 和6 的裂解规律显示不带有皂苷特征,为非皂苷物质,并根据其母离子峰m/z 为283,推测其为黄酮类化合物;峰2、3 以及4 通过其质谱裂解规律、保留时间且与标准品进行对比确定为人参皂苷Rg2、F2 以及Rg3。峰1、5、6 的确切结构还需进一步研究。
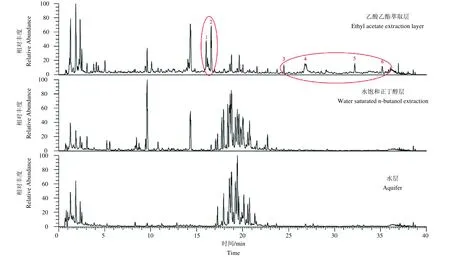
图3 西洋参果肉各组分总离子流图Fig.3 Total ion flow diagrams of different components in the American ginseng berry
4 结论
皮肤老化是一种光损伤,尤以紫外线为主,当过量紫外线照射皮肤时,人体会产生氧化应激反应,活性氧族(ROS)增多,临床以皮肤粗糙、松弛及出现皱纹等症状为主,轻者影响美观,重者危害健康[9,10]。
本研究考察了西洋参果肉提取物的不同萃取液对UVB辐射的HaCaT细胞保护作用,体外试验以DPPH自由基清除能力和ABTS 总抗氧化能力为考察指标,对各组分的自由基清除能力进行评价;采用MTT 法于细胞水平筛选出不同组分安全剂量浓度以及对于UVB 辐射HaCaT 细胞保护作用的最适浓度,结果显示,乙酸乙酯萃取层清除自由基能力最强并显著减少MDA 生成,提高SOD 和GSH 酶活性,这可能是对UVB 辐射HaCaT 细胞呈现保护作用的机制之一;利用液相质谱联用仪对其活性成分进行探讨分析,结果发现,乙酸乙酯萃取层组分与其他组分的成分差异主要体现在中性人参皂苷Rg2、低极性人参皂苷F2、Rg3以及3 种未知化合物,推测其可能是抗辐射作用的活性物质。
本试验表明,西洋参果肉提取液乙酸乙酯萃取层对UVB 辐射HaCaT 细胞损伤具有保护作用,其中起主要作用的可能为Rg2、F2、Rg3以及其黄酮类成分,已有研究表明,人参皂苷Rg2、F2 与Rg3具有抗氧化活性[11-13]。目前西洋参果肉常作为果汁、果胶商品出现在市场上[14],本研究提供了可将其制成防晒类化妆品的思路,为西洋参果肉的进一步开发利用提供理论依据。

