小儿先天性心脏病介入术后早期并发心律失常危险因素预测模型的构建
张倩玉
先天性心脏病(先心病)指胚胎发育期由于心脏及大血管的形成障碍或发育异常而引起的解剖结构异常,或出生后应自动关闭的通道未能闭合(在胎儿属正常)的情形。欧美国家相关监测显示,先心病发病率约为9‰[1],我国相关数据报道为低于8‰[2],但根据通过先心病注册信息,推算我国先心病的真实发病率约为11.1‰,最常见的类型包括室间隔缺损 (VSD),动脉导管未闭(PDA), 房 间 隔 缺 损 (ASD)[2]。其中,VSD长期存在可造成患儿血流动力学异常,导致心脏负荷加重,极易诱发肺动脉高压、心律失常等,危及患儿生命安全[3]。在检查方面常规可通过心脏彩超,在李姝等[4]研究中,采用256层CT进行增强可以多方位清晰显示心脏大血管结构。在治疗方面,中国每年先心病介入治疗3万多例,其中继发孔型ASD封堵术约占44.30%,VSD封堵术约占15.13%,二者成功率分别为98.78%及96.16%[5],而在并发症方面常见的有VSD封堵术后并发症发生率为2%~15%,其中心律失常占比为30%~50%,溶血也是严重的并发症之一[5]。为及早评估出并发症的风险因素,采取干预措施,本研究通过单因素、多因素分析,据此构建风险预测模型。现作报道。
1 对象与方法
1.1 研究对象 选择我院2019年1月至2023年5月收治的先心病介入术后患儿为研究对象。纳入标准:符合小儿先心病诊断标准,以ASD、VSD为主,且经超声、心电及影像学检查确诊;年龄0~18 岁,行介入封堵术,且术程顺利,术后心脏超声复查封堵满意无医源性心内结构和功能异常;无恶性肿瘤或脏器功能异常。排除标准:半年内曾行心脏手术治疗;合并有其他心血管畸形;感染性心内膜炎;合并出血性疾病;未进行介入封堵术治疗患儿。共纳入研究病例69例,男26例,女43例,<3岁39例,≥3岁30例。
1.2 研究方法 采用前瞻性方法,即患儿进入介入室后,护理人员通过医院病例管理系统搜索患儿资料,按自制一般资料量表登记患儿信息,包括性别、年龄、查看VSD解剖类型、VSD直径、VSD上缘到主瓣距离、封堵器直径、合并膜部瘤、封堵器类型、封堵器直径、手术时间、术前心律失常、术后残余分流等,患儿进入病房后进行随访。
ASD介入治疗:常规消毒铺巾,置入6F股静脉鞘。根据体质量把肝素钠从鞘管推入体内。从股静脉上5F带侧孔的端侧导管置于右房内,通过ASD口把导管送到右上肺静脉。在右上肺静脉造影,测量缺损的大小,选择合适的封堵器。选择加硬导丝,交换出造影导管。选择合适的输送鞘,沿着加硬导丝送至肺静脉。把封堵器固定在输送钢缆上,沿着输送鞘送入。到达位置后先打开一面伞盘,然后往后拖,碰到阻力后固定输送钢缆退输送鞘,当第二面伞盘打开后,做推拉试验。使用超声机观察伞盘与心脏瓣膜的关系,封堵器是否封堵完全等。超声没问题的情况下,旋转钢缆释放封堵器。拔出输送鞘,常规按压包扎,术后叮嘱注意事项及观察穿刺点出血情况。
VSD介入治疗:常规消毒铺巾,置入5F股动脉鞘及6F股静脉鞘。根据体质量把肝素钠从鞘管推入体内。小儿选择4F猪尾导管放置在左心室造影,C臂探测器选择左斜45°头25°(造影剂剂量根据按照小儿体质量设置)。根据造影结果测量缺损大小选择合适的封堵器。选择2.6M 0.032直径的导丝,从左心室通过VSD口到达右心室,把导丝头端置于肺动脉内。从静脉系统上抓捕器到达肺动脉,抓住2.6M导丝头端,抓出体外。成功建立轨道。沿着轨道送入输送鞘,把输送鞘压入左室内。从股动脉送4F猪尾导管至左心室内,行左心室造影术。观察输送鞘位置及再次确认封堵器大小。把封堵器固定在输送钢缆上,沿着输送鞘送入。到达位置后先打开一面伞盘,然后往后拖,碰到阻力后固定输送钢缆退输送鞘,当第二面伞盘打开后,做推拉试验。猪尾导管再次造影(造影剂量同上),观察封堵器封堵情况,位置合适的情况下旋转钢缆释放封堵器。如果位置不理想,可以把封堵器收入输送鞘中再调整。封堵器释放完成后,拔出输送鞘及猪尾,常规按压包扎。术后叮嘱注意事项及观察穿刺点出血。
转至病房实施24 h心电监护,术后1~3 d 复查经胸超声心动图(trans esophageal echocardiography,TEE)、心电图(electrocardiogram,ECG),并采取相应康复治疗或护理措施[6-7]。
1.3 统计学方法 采用χ2检验和多因素lasso回归分析。
2 结果
2.1 小儿ASD、VSD术后并发症影响因素的单因素分析 结果显示,并发症的影响因素有年龄、性别、VSD直径、封堵器直径、合并膜部瘤、术前心律失常(P<0.01)(见表1)。
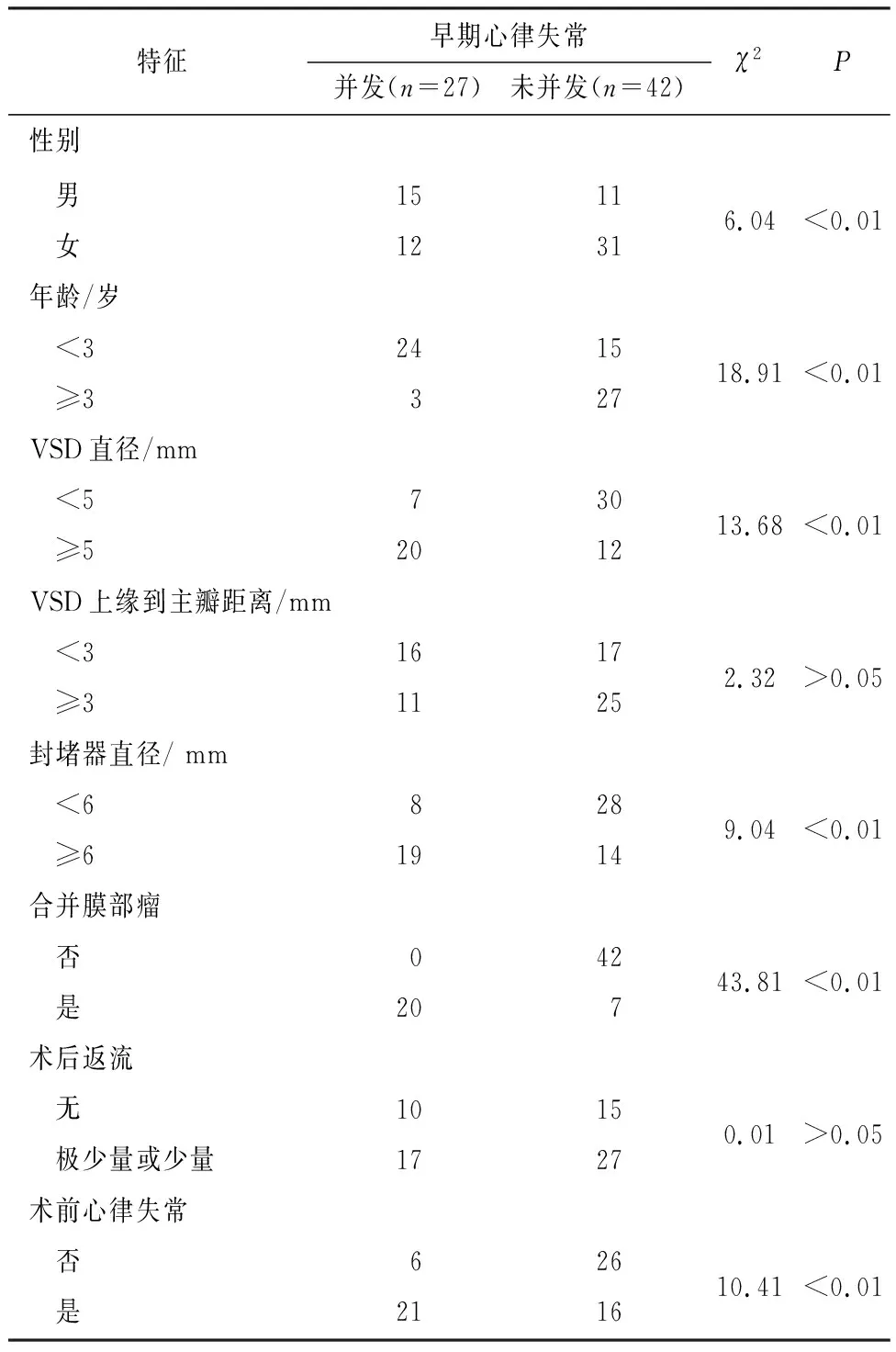
表1 小儿ASD介入术后并发早期心律失常危险因素的单因素分析(n)
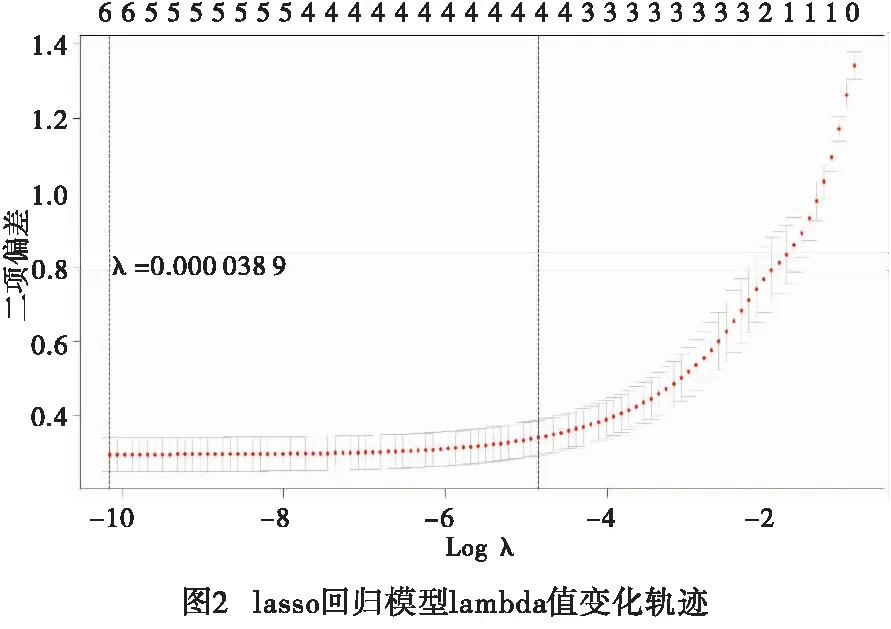
2.2 小儿ASD、VSD术后并发症危险因素的lasso回归分析 lasso回归分析结果显示,性别、年龄、VSD直径、合并膜部瘤、封堵器直径、术前心律失常均与并发早期心率失常有关(F=9.485、10.483、9.4738、11.374、8.4637、12.038、8.665,P<0.01)(见图1)。当模型lambda值=0.000 038时,模型系数:性别为-7.329,年龄为-7.781,VSD直径为2.046,合并膜部瘤为0.065,封堵器直径为19.93,术前心律失常0.319(见图2)。

3 讨论
本研究发现性别、年龄、VSD直径、合并膜部瘤、封堵器直径、术前心律失常均与并发早期心律失常有关,因数据存在共线性,采用lasso回归分析,结果显示,性别、年龄为并发症的保护因素,年龄越大、性别为女的患儿,越不易发生并发症,而VSD直径、术前心律失常、合并膜部瘤、封堵器直径为其危险因素。在性别研究中,查阅相关文献报道为女性并发症较少的未索引到,因而需要进一步深入研究,而手术年龄大是保护因素与郑鸿雁等[8]报道一致,这可能与为小儿先心病介入封堵术治疗中要多次建立动静脉轨道、选择封堵器,易导致手术操作时间长,且易对ASD、VSD周围组织造成损伤,小儿耐受力有限等导致术后早期心律失常风险增大有关[9]。VSD直径≥5 mm为危险因素,是因其距离心脏传导束较近,手术中传导束易受到相关刺激,封堵器具有压迫作用,易导致损伤;VSD直径较大,其血流动力学变化增大,更易出现心肌损伤,缺损边缘纤维化风险大,影响心脏传导系统,易诱发心律失常[10-11]。
术前心律失常导致并发症增加,可能与血流动力学异常引导心脏传导阻滞有关,介入术中如机体血流动力学异常未得到纠正,加之手术刺激,传导束压迫增大,极易引发心律失常,相关研究也显示早期并发症中患儿术前心律失常患儿占比超过了70%[12-14]。严帆等[15-16]研究提示,膜部瘤是因为心脏血流持续冲击,导致三尖瓣隔瓣与VSD周围组织出现粘连、纤维化,持续的高压,可致三尖瓣隔瓣出现瘤样改变,进而诱发膜部瘤,导致VSD直径缩小、闭合,易引起心律失常并发症。
封堵器直径大,导致封堵器边缘距离接近心脏传导束,VSD边沿的张力增大,心肌结构受到压力,导致周围出现水肿,早期心律失常风险显著增大,在相关研究[17-18]中VSD介入术中VSD直径应>1~3 mm,确保有效封堵下VSD直径尽可能小。
综上所述,在先心病介入封堵术中,在小儿能耐受下,年龄越大越不易出现并发症,在术前应尽可能控制术前心律失常,合理选择封堵器直径,对于膜部瘤积极予以控制,采取综合措施才能降低术后的并发症。

