维持性血液透析患者血小板/淋巴细胞比值与左心室肥厚的相关性研究
卜 希,刘沧桑
(长沙市第四医院,湖南 长沙 410006)
维持性血液透析(MHD)是终末期肾脏病(ESRD)患者最常见的肾脏替代治疗方式。截至2020年12月底,我国大陆地区登记的血液透析患者达70 万人。MHD患者的病死率高,比一般人群约高出十倍,心血管疾病是其主要并发症和主要死因,约占总死亡人数的50%[1]。左心室肥厚是MHD患者最常见的心血管疾病,是心源性猝死的高风险因素,也是心血管病死亡的预测因子[2]。左心室肥厚(LVH)的发生和持续进展与不良心血管预后和生存预后有关。除慢性容量和压力超负荷、神经激素激活、尿毒症毒素蓄积、贫血、甲状旁腺功能亢进、营养不良等原因外,炎症也是左心室肥厚的重要原因[3-4]。血小板/淋巴细胞比值(PLR)是一种全身炎症标志物,检测方法简捷,易动态监测,被证实能较好地反映机体炎症状态。PLR在心血管疾病中对疾病的发生或预后有独特的预测作用[5]。
但在维持性血液透析患者中,PLR与LVH的相关性研究较少。本研究通过回顾性分析维持性血液透析患者的临床资料,探讨PLR对LVH的预测价值,报告如下。
1 资料与方法
1.1 一般资料
选择我院2021年7月1日—2022年1月1日维持性血液透析患者105 例,根据左心室质量指数(LVMI)分为LVH组[75 例(71.43%)]和非LVH组[30 例(28.57%)]。
1.2 纳入和排除标准
纳入标准:年龄≥18 岁、透析龄≥3 个月、规律血液透析每周2~3次(每次4 h)且临床资料完整的患者。排除标准:合并腹膜透析的患者;肾移植患者;合并感染患者;合并急性心脑血管事件、恶性肿瘤、严重血液病患者;其他引起淋巴细胞减少的原因,如使用皮质类固醇,HIV感染,营养不良,系统性红斑狼疮,类风湿性关节炎,结节病,细胞毒性剂,免疫抑制药物。
1.3 研究方法
LVH的评定根据《亚洲高血压合并左心室肥厚诊治专家共识》[6],即LVMI男性≥115 g/m2、女性≥95 g/m2。研究期间由超声专科医生完善心脏超声检查,测定左室舒张末期内径(LVEDD)、室间隔厚度(IVST)及左室后壁厚度(LVPWT)。LVMI(g/m2)=左心室质量/体表面积;左心室质量(g)=0.8×1.04×[(LVEDD+IVST+LVPWT)3-LVEDD3]+0.6;体表面积(m2)=0.005 7×身高(cm)+0.012 1×体质量(kg)+0.088 2(男性);体表面积(m2)=0.007 3×身高(cm)+0.012 7×体质量(kg)-0.210 6(女性)。
1.4 观察指标
收集患者一般资料,包括年龄、性别、身高、体质量、透析血管通路、肾脏原发病类型(如高血压肾损害、糖尿病肾病、慢性肾小球肾炎、多囊肾等)和透析龄等。收集透析前实验室检查结果,包括白细胞计数、淋巴细胞计数、血红蛋白、血小板计数、超敏C反应蛋白(hs-CRP)、血清钙、血清磷、血清白蛋白、血肌酐、血尿素氮、血尿酸、全段甲状旁腺素(iPTH)等,根据血小板计数与淋巴细胞计数计算PLR。收集患者透析的相关资料,计算尿素下降率(URR)、尿素清除指数(Kt/V)。计算公式:URR=(透析前尿素浓度-透析后尿素浓度)/透析前尿素浓度;Kt/V=-ln(R-0.03)+(4-3.5×R)×UF/W,其中R为透析前后尿素比率,UF为透析超滤量,W为透析后体质量。
1.5 统计学方法
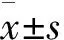
2 结 果
2.1 MHD患者的一般资料
共入选105 例MHD患者,其中男62 例,女43 例;年龄(63.02±12.55) 岁;长期中心静脉置管16 例,自体内瘘89 例;透析龄14.00(7.00,36.50) 个月;LVMI为(116.50±16.38) g/m2;PLR为191.51(135.72,300.06);肾脏原发病来源:高血压肾损害19 例,糖尿病肾病39 例,慢性肾小球肾炎41 例,肾病综合征1 例,梗阻性肾病2 例,多囊肾1 例,其他2 例。
2.2 两组临床资料比较
105 例MHD患者中,LVH组75 例,非LVH组30 例。两组血红蛋白、血小板计数、PLR和hs-CRP及LVMI比较,差异有统计学意义(P<0.05);两组年龄、男性比例、体质量指数、长期中心静脉置管例数、白细胞计数、淋巴细胞计数、血清钙、血清磷、血清白蛋白、血肌酐、血尿素氮、血尿酸、iPTH和URR及Kt/V比较,差异无统计学意义(见表1)。
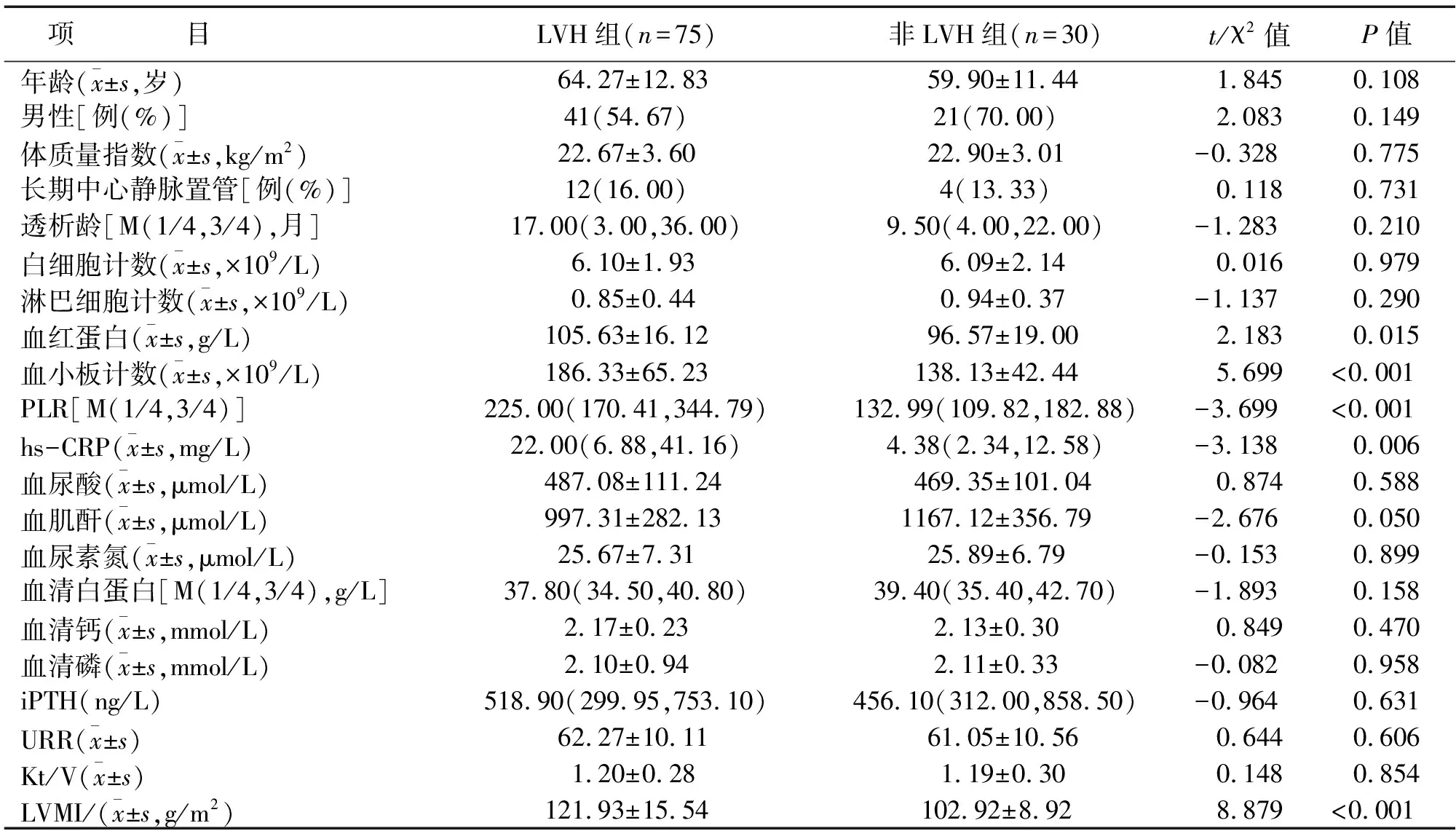
表1 两组临床资料比较
2.3 PLR与临床指标的相关性分析
通过Spearman相关性分析比较PLR与各个临床指标的相关性。PLR与超敏C反应蛋白(r=0.372,P<0.001)和LVMI(r=0.258,P=0.008)呈正相关;与年龄、男性比例、体质量指数、白细胞计数、血红蛋白、血清钙、血清磷、血清白蛋白、血肌酐、血尿素氮、血尿酸、iPTH和URR及Kt/V等无相关性(见表2)。
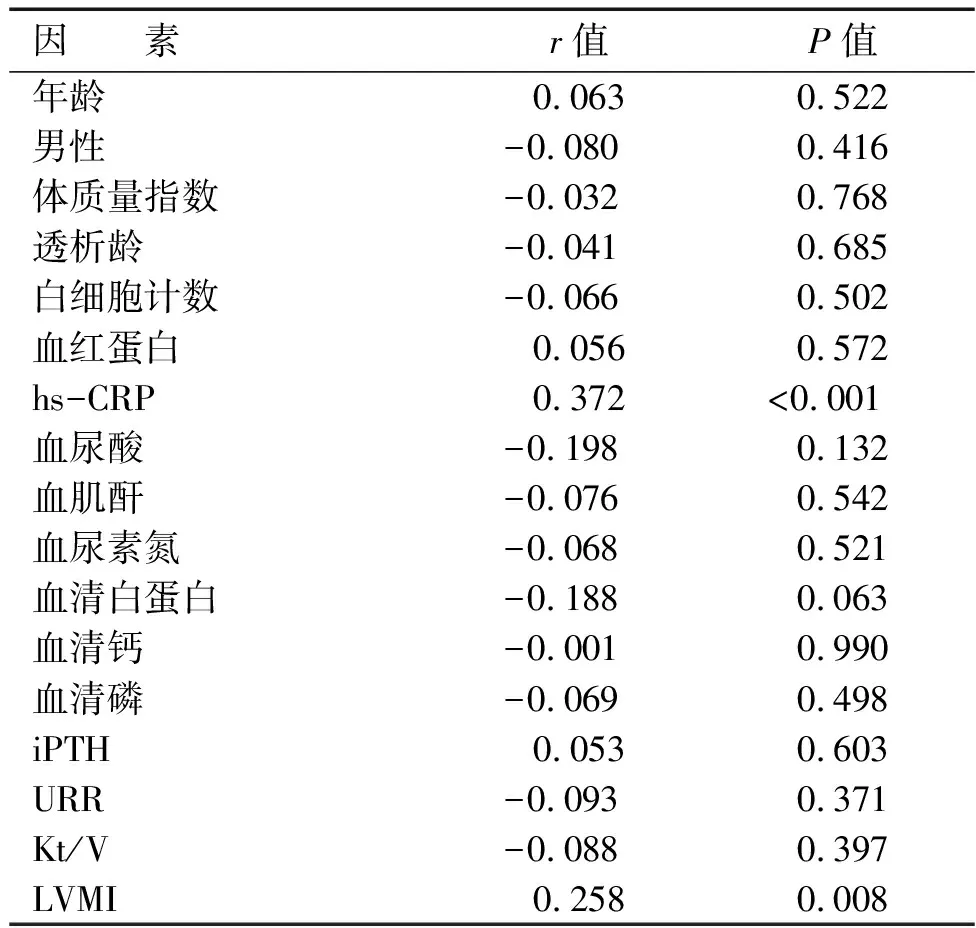
表2 PLR与临床指标的相关性
2.4 影响MHD患者并发LVH的因素
以是否LVH为因变量,以单因素分析中有统计学意义的指标为自变量,其中取PLR的中位数191.51进行二分类,将PLR作为分类变量,然后采用条件法建立二元Logistic回归分析结果显示PLR≥191.51和血红蛋白是MHD患者并发LVH的独立危险因素(见表3)。

表3 影响MHD患者并发LVH的二元Logistic回归分析
3 讨 论
LVH是MHD患者常见和严重的心血管并发症,严重影响患者预后,是心血管患者死亡的独立危险因素。据报道[7],在ESRD患者中LVH的患病率可高达71%~89%,并且随着透析时间的延长,LVH的风险逐渐增加。本研究中MHD患者的LVH发病率为71.43%,与以前的报道[8]基本一致。尽管对LVH的研究在不断进展,但临床上仍缺乏早期预测LVH的敏感、特异的生物学标志物,造成确诊延误,给患者和社会造成沉重的经济负担,因此研究早期识别MHD患者发生LVH的生物学标志物,对降低心血管事件病死率有重要临床意义。
PLR是一种新型的炎症标志物,被多项研究证实是可用于评估全身炎症状态的指标。多项研究表明[9],PLR对心血管疾病的发生或预后有独特的预测作用。Zhang等[10]的研究证实PLR是预测血液透析患者全因死亡、心血管死亡的廉价且可靠的生物标志物。在腹膜透析中,高PLR可用于预测持续不卧床腹膜透析患者发生心血管事件的风险,也被证实与患者发生LVH具有相关性,是LVH发生的独立影响因素[11]。PLR与心血管疾病的发展及预后密切相关,但在血液透析中其与LVH的关系研究较少。本研究中,LVH组PLR和hs-CRP显著高于非LVH组,且PLR是预测LVH的独立危险因素。
目前我们对MHD患者发生LVH的病理生理学认识尚不完全。研究认为[12],LVH的发病机制由多因素造成,除传统认为的肾素-血管紧张素系统的激活、一氧化氮合成的抑制、血管内容量扩张、骨骼和矿物质代谢紊乱、继发性贫血和动静脉内瘘的存在外都可能导致左心室肥厚甚至左心室纤维化;另一方面,尿毒症患者中的慢性炎症、氧化应激和内皮功能障碍加速动脉粥样硬化和心脏损伤,在左心室肥大的发展中也起着至关重要的作用。炎症因子和氧化应激通过诱导趋化因子表达,引起炎性细胞的聚集和浸润产生炎性损伤,从而影响心血管内皮功能,增加血流动力学负荷,使心室壁压力增加,还直接导致细胞增殖、凋亡,调节细胞外间质的合成和降解,长期受累导致不可逆的心肌损伤,促进LVH的发生[13]。临床研究中也发现炎症标志物如hs-CRP、肿瘤坏死因子-α(TNF-α)和白介素-6(IL-6)的浓度与LVMI相关,微炎症状态与MHD患者心脏的结构和功能障碍密切相关[14]。在本研究中PLR与hs-CRP和LVMI呈正相关,进一步验证炎症在LVH中的重要作用。
我们还发现贫血是MHD患者并发LVH的独立危险因素。MHD患者普遍存在一定的贫血,血液中血红蛋白携氧量减少,加重心肌缺血,心脏通过增加心排血量以维持机体正常的氧供需求,同时机体产生各种代谢产物导致血管扩张、心脏前负荷增加,进而逐渐发生左心室结构变化、容积增大、后壁厚度增加,导致LVH的形成。因此,对于MHD患者需积极纠正贫血,延缓LVH的进程,对预后改善有一定价值。
本研究具有一定的局限性:一是本研究为单中心回顾性研究,样本例数有限,需要更大样本、多中心、随机对照研究来进一步验证;二是由于经济原因,未纳入其他炎症指标(如IL-6,IL-11和TNF-α等)一同研究。
综上所述,PLR是一种简单的炎症标志物,廉价易得,检测方法简捷,便于动态监测。本研究显示其升高是MHD患者并发LVH的独立危险因素,可用于对MHD患者进行LVH危险分层的一个简单快捷的工具,临床工作中应重视PLR升高的MHD患者,从而及早采取预防措施。

